И ЛИМФООБРАЩЕНИЯ
Нормальную жизнедеятельность организма трудно представить без нор-
мальной работы органов кровообращения и лимфообращения, которые нахо-
дятся в тесном структурно-функциональном единстве.
Работа органов кровообращения определяет прежде всего уровень
процессов обмена веществ в каждой ткани и каждом органе свой, необхо-
димый для отправления специализированной функции. Эту транспорт-
н о-обменную функцию кровеносная система выполняет совместно
с лимфатической дренажной системой и системой крови. Из этого следует,
что в ходе микроциркуляции, с помощью которой осуществляется
транскапиллярный Обмен, кровеносная и лимфатическая системы, как и кровь,
служат одной задаче и функционируют сопряженно.
Понятие «микроциркуляция» охватывает ряд процессов, прежде всего такие, как законо-
мерности циркуляции крови и лимфы в микрососудах, закономерно-
сти поведения клеток крови (деформация, агрегация, адгезия), механизмы
свертывания крови, а главное механизмы транскапиллярного обмена.
Следовательно, микроциркуляция объединяет терминальные отделы кровеносного русла (арте-
риолы, прекапилляры, капилляры, посткапилляры, венулы и анастомозы), истоки лимфатиче-
ской системы (капилляры), нервные структуры и кровь, ее реологические особенности (реоло-
гия- наука о деформации течения). Микроциркуляторное русло, осуществляя транскапил-
лярный обмен, обеспечивает тканевый гомеостаз.
Кровеносная система координирует и связывает воедино функционально
разные органы и системы в интересах организма как целого. Эту коорди-
нирующую в отношении гомеостаза функцию кровеносная си-
стема выполняет с помощью лимфатической системы.
Функция кровеносной системы, как и лимфатической, обеспечивается меха-
низмами нейрогуморальной регуляции (нервные приборы сердца, рецепторы
сосудов, сосудодвигательный центр, гуморальные константы крови, лимфы,
вазоконстрикторы и вазодилататоры и т. д.). Но кровеносная, как и лимфати-
ческая, система объединяется в единое целое не только функционально, но
и структурно: сердце — источник кровотока, сосуды — источник кровораспре-
деления и лимфосбора, микроциркуляторное русло — плацдарм транскапил-
лярного обмена и тканевого метаболизма. Однако структурно-функциональ-
ная интеграция как кровеносной, так и лимфатической системы не исключает
структурное своеобразие и функциональные особенности этих систем в раз-
личных органах и тканях.
На основании приведенного краткого обзора можно высказать ряд прин-
ципиальных положений, касающихся расстройств крово- и лимфообращения.
Нарушения кровообращения нельзя рассматривать в отрыве от нарушений
лимфообращения и состояния системы крови, так как структурно и функцио-
нально эти системы тесно связаны. Нарушения нормального крово- и лим-
фообращения ведут к нарушению тканевого (клеточного) метаболизма, а зна-
чит, к повреждению структуры ткани (клетки), развитию того или иного вида
дистрофии или некроза. Морфология этих повреждений, помимо общих при-
знаков, присущих всем органам и тканям, имеет и ряд частных, характерных
лишь для данного органа или ткани, чтo определяется структурно-функцио-
нальными их особенностями и прежде всего особенностями кровеносной
и лимфатической систем.
Нарушения крово- и лимфообращения возникают не только в результате
расстройства кровеносной и лимфатической системы, но и нейрогуморальной
регуляции работы сердца, структурного полома на любом уровне — сердце,
кровеносные сосуды, микроциркуляторное русло, лимфатические сосуды,
грудной проток. При расстройстве регуляции деятельности сердца или разви-
тии патологического процесса в нем возникают общие, а при расстройстве
регуляции функции сосудистого русла на том или ином участке, как и струк-
турном поломе его,— местные нарушения крово- и лимфообращения.
Местные нарушения кровообращения (например, кровоизлияние в мозг) мо-
гут стать причиной общих нарушений. Общие и местные нарушения крово-
и лимфообращения наблюдаются при многих болезнях, они могут осложнять
их течение и приводить к опасным последствиям.
НАРУШЕНИЯ КРОВООБРАЩЕНИЯ
Различают следующие виды нарушений кровообращения: полнокровие
(артериальное и венозное), малокровие, инфаркт, стаз, тромбоз, эмболия,
кровотечение, плазморрагия. Некоторые из них имеют как общий, так-
и местный характер.
Многие из местных нарушений кровообращения патогенетически тесно
связаны и находятся в причинно-следственных отношениях, например связь
кровотечения и плазморрагии с полнокровием; связь малокровия и инфаркта
с эмболией и тромбозом, а последнего _ со стазом и венозным полнокро-
вием.
У плода, новорожденного и ребенка первых 3 лет жизни общее и местное полнокровие
малокровие, кровоизлияния, стаз возникают легче и чаще, чем у взрослых, что зависит от незре-
лости регуляторных механизмов кровообращения. Тромбоз и инфаркт у детей встречаются на-
много реже, чем у взрослых. Возникают эти нарушения кровообращения преимущественно
в связи с пороком развития сердечно-сосудистой системы и присоединением к ним вторичной
септической инфекции или при некоторых острых инфекционных болезнях (дифтерия, вирусный
миокардит и др.).
Полнокровие
Различают полнокровие артериальное и венозное.
Артериальное полнокровие
Артериальное полнокровие (гиперемия) — повышенное кро-
венаполнение органа, ткани вследствие увеличенного притока артериальной
крови. Оно может иметь общий характер, что наблюдается при увеличе-
нии объема циркулирующей крови (п л е т о р а) или числа эритроцитов
(эритремия). В таких случаях отмечаются красная окраска кожных покро-
вов и слизистых оболочек и повышение артериального давления. Чаще арте-
риальная гиперемия имеет местный характер и возникает от различных
причин.
Различают физиологическую артериальную гиперемию, возникаю-
щую при действии адекватных доз физических и химических факторов, при
чувстве стыда и гнева (рефлекторные гиперемии), при усилении
функции органов (рабочая гиперемия), и патологическую арте-
риальную гиперемию.
Учитывая особенности этиологии и механизма развития, различают сле-
дующие виды местной патологической артериальной гиперемии: 1) ангионе-
вротическую (нейропаралитическую); 2) коллатеральную; 3) гиперемию после
анемии (постанемическую); 4) вакатную; 5) воспалительную; 6) гиперемию на
почве артериовенозного свища.
1. Ангионевротическая (нейропаралитическая) гипере-
мия наблюдается как следствие раздражения сосудорасширяющих нервов
или паралича сосудосуживающих нервов. Кожа, слизистые оболочки стано-
вятся красными, слегка припухшими, на ощупь теплыми или горячими.
Этот вид гиперемии может возникать на определенных участках тела при
нарушении иннервации, на коже и слизистых оболочках лица при некото-
рых инфекциях, сопровождающихся поражением узлов симпатической нерв-
ной системы. Обычно эта гиперемия быстро проходит и не оставляет
следов.
2. Коллатеральная гиперемия возникает в связи с затруднением
кровотока по магистральному артериальному стволу, закрытому тромоом
или эмболом. В этих случаях кровь устремляется по коллатеральным
(окольным) сосудам. Просвет их рефлекторно расширяется, приток арте-
риальной крови усиливается и ткань получает необходимое количество крови.
При недостаточном развитии коллатералей в подобных случаях развивается
малокровие (ишемия) или инфаркт.
3. Гиперемия после анемии (постанемическая) развивается в тех
случаях, когда фактор, ведущий к сдавлению артерии (опухоль, скопление
жидкости в полости, лигатура и др.) и малокровию ткани, быстро устраняет-
ся. В таких условиях сосуды ранее обескровленной ткани резко расширяются
и переполняются кровью, что может привести не только к их разрыву и кро-
воизлиянию, но и к малокровию других органов, например головного мозга,
в связи с резким перераспределением крови (возможно развитие обморочного
состояния). Поэтому такие манипуляции, как извлечение жидкости из поло-
стей тела, удаление больших опухолей, снятие эластического жгута, нужно
производить медленно.
4. В а к а т на я гиперемия (от лат. vacuus — пустой) развивается в связи
с уменьшением барометрического давления. Она может быть общей, напри-
мер у водолазов и кессонных рабочих при быстром подъеме из области повы-
шенного давления. Возникающая при этом гиперемия сочетается с газовой
эмболией, тромбозом сосудов и кровоизлияниями. Местная вакатная гипе-
ремия появляется на коже под действием, например, медицинских банок, со-
здающих над определенным участком ее разреженное пространство.
5. Воспалительная гиперемия — постоянный спутник воспаления
(см. с. 115).
6. Гиперемия на почве артериовенозного свища возникает
в тех случаях, когда, например при огнестрельном ранении или другой трав-
ме образуется соустье между артерией и веной и артериальная кровь устре-
мляется в вену.
Рис. 41. Венозное полнокровие. Капил-
ляры и вены легкого расширены и
переполнены кровью.
Значение патологической ар-
териальной гиперемии опреде-
ляется главным образом ее ви-
дом. Коллатеральная гипере-
мия, например, является по су-
ществу компенсаторной, обес-
печивая кровообращение при
закрытии артериального ство-
ла. Воспалительная гипере-
мия — обязательный компонент
этой древней защитно-приспо-
собительной реакции. Однако
та же коллатеральная гипере-
мия становится одним из слагаемых кессонной болезни.
Венозное полнокровие
Венозное полнокровие (гиперемия) — повышенное кровенаполне-
ние органа или ткани в связи с уменьшением (затруднением) оттока крови;
приток крови при этом не изменен или уменьшен. Застой венозной крови
(застойная гиперемия) приводит к расширению вен и капилляров (рис.
41), замедлению в них кровотока, с чем связано развитие гипоксии, по-
вышение проницаемости базальных мембран капилляров и возник-
новение отека.
Венозное полнокровие может быть общим и местным.
Общее венозное полнокровие
Общеевенозноеполнокровие развивается при патологии сердца,
ведущей к острой и хронической сердечной (сердечно-сосудистой) недостаточ-
ности. При острой сердечной недостаточности (инфаркт миокар-
да, острая декомпенсация сердца) развивается острое венозное полнокровие,
а при хронической сердечной (сердечно-сосудистой) недо-
статочности, осложняющей многие хронические заболевания сердца (по-
рок, ишемическая болезнь, фиброэластоз эндокарда, миокардит, кардиопати-
ческий амилоидоз и др.), — хроническое венозное полнокровие.
При остром общем венозном полнокровии в результате ги-
поксического повреждения гистогематических барьеров и резкого повышения
капиллярной проницаемости в тканях наблюдаются плазматическое пропиты-
вание (плазморрагия) и отек, стазы в капиллярах и множественные кровоиз-
лияния диапеделного характера (см. с. 107), в паренхиматозных элементах ор-
ганов появляются дистрофические и некротические изменения.
Структурно-функциональные особенности органа, в котором развивается острый венозный за-
стой, определяют преобладание отечно-плазморрагических, геморрагических либо дистрофиче-
ских и некротических изменений. Возможно и сочетание их. Так, в легких гистофизиологиче-
ские особенности аэрогематического барьера объясняют развитие при остром венозном застое
преимущественно отека и геморрагии. В почках вследствие особенностей структуры
нефрона и кровообращения возникают в основном- дистрофические и некротиче-
ские из м е н е н и я, особенно эпителия канальцев. В печени в связи с особен-
ностями архитектоники печеночной дольки и кровообращения при остром полнокровии
появляются как центролобулярные кровоизлияния, так и некрозы.

Рис. 42. Мускатная печень.
а - вид на разрезе; б - микроскопическая картина: в центре печеночное дольки
(вверху слева) синусоиды резко расширены и полнокровны, гепатоциты разрушены;
на периферии дольки (внизу справа) они сохранены; в - электронограмма: в перисину-
соидальном пространстве (ПрП) фибробласты (Ф6) и коллагеновые волокна (КлВ).
х 27 000.
Хроническое общее венозное полнокровие, которое встре-
чается значительно чаще по сравнению с острым, приводит к тяжелым,
нередко необратимым, изменениям. Длительно поддерживая состояние тка-
невой гипоксии, оно определяет развитие не только плазморрагии, отека
и кровоизлияний, дистрофии и некроза, но и атрофических и склеро-
тических изменений.
Склеротические изменения, т. е. разрастание соединительной ткани (см.
с. 165), связаны с тем, что состояние хронической гипоксии стимулирует
синтез коллагена фибробластами. Соединительная ткань вытес-
няет паренхиматозные элементы, развивается застойное уплотнение
(индурация) органов и тканей.
Изменения органов при хроническом венозном застое, несмотря на ряд
.общих черт (застойная индурация), имеют ряд особенностей.
Кожа, особенно нижних конечностей, при общем хроническом венозном
застое становится холодной и приобретает синюшную окраску (цианоз).
Вены кожи и подкожной клетчатки расширены, переполнены кровью; также
расширены и переполнены лимфой лимфатические сосуды. Выражены отек
дермы и подкожной клетчатки, разрастание в коже соединительной ткани.
В связи с венозным застоем, отеком и склерозом в коже легко возникают во-
спалительные процессы и изъязвления, которые долгое время не за-
живают.
Печень при хроническом венозном застое увеличена, плотная, ее края
закруглены, поверхность разреза пестрая, серо-желтая с темно-красным кра-
пом и напоминает мускатный орех, поэтому такую печень называют му-
скатной (рис. 42).
При микроскопическом исследовании видно, что полнокровны лишь цен-
тральные отделы долек, где гепатоциты разрушены (см. рис. 42); эти отделы
на разрезе печени и выглядят темно-красными. На периферии долек клетки
печени находятся в состоянии дистрофии, нередко жировой, чем объясняется
серо-желтый цвет печеночной ткани.
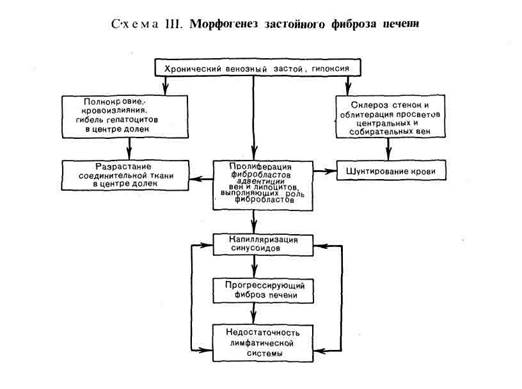
Морфогенез изменений печени при длительном венозном застое сложен.
Избирательное полнокровие центра долек связано с тем, что застой печени
охватывает прежде всего печеночные вены, распространяясь на собирательные
и центральные вены, а затем и на синусоиды. Последние расширяются, но
только в центральных и средних отделах дольки, где встречают сопротивле-
ние со стороны впадающих в синусоиды капиллярных разветвлений печеноч-
ной артерии, давление в которых выше, чем в синусоидах. По мере нараста-
ния полнокровия в центре долек появляются кровоизлияния, гепатоциты
здесь подвергаются дистрофии, атрофии и погибают. При этом гепатоциты
периферии долек компенсаторно гипертрофируются и приобретают сходство
с центролобулярными. В печени начинает разрастаться соединительная ткань.
Ее образование в зоне кровоизлияний и гибели гепатоцитов связано с проли-
ферацией клеток синусоидов — липоцитов, которые могут выступать в роли
фибробластов (см. рис. 42), а вблизи центральных и собирательных вен — с
пролиферацией фибробластов адвентиции этих вен. В результате разрастания
соединительной ткани в синусоидах появляется непрерывная базальная мем-
брана (в нормальной печени она отсутствует), т. е. происходит капилляриза-
ция синусоидов, которая, усугубляя гипоксию, ведет к прогрессированию
атрофических и склеротических изменений печени. Этому способствуют также
шунтирование крови, развивающееся при склерозе стенок, обтурапия просве-
тов многих центральных и собирательных вен и нарастающий застой лимфы.
Возникающая недостаточность лимфатической системы печени становится од-
ним из факторов прогрессирующего застойного фиброза (склероза)
печени (схема III).
По мере разрастания соединительной ткани возникают несовершенная ре-
генерация гепатоцитов с образованием узлов-регенератов, перестройка
и деформация органа. Развивается мускатный цирроз печени, который
называют также сердечным, так как он обычно встречается при хрониче-
ской сердечной недостаточности.
В л е г к и х при хроническом венозном полнокровии развиваются два рода
изменений — множественные кровоизлияния, обусловливающие гемосиде-
роз легких, и разрастание соединительной ткани, т. е. склероз. Легкие
становятся большими, бурыми и плотными — бурое уплотнение (и н-
дурация) легких (рис. 43).
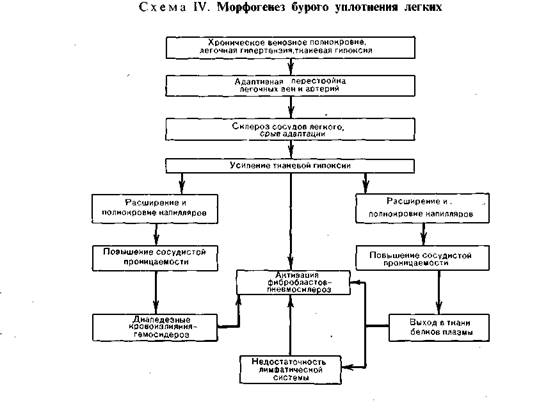
В морфогенезе бурого уплотнения легких основную роль играют застойное
полнокровие и гипертония в малом круге кровообращения, ведущие к гипок-
сии и повышению сосудистой проницаемости, диапедезным кровоизлияниям.
Развитию этих изменений предшествует ряд адаптивных процессов в сосуди-
стом русле легких. В ответ на гипертонию в малом круге кровообращения
происходит гипертрофия мышечно-эластических структур мелких ветвей ле-
гочной вены и артерии с перестройкой сосудов по типу замыкающих артерий,
что предохраняет капилляры легкого от резкого переполнения кровью.
Со временем адаптивные изменения сосудов легкого сменяются склероти-
ческими, развиваются декомпенсация легочного кровообращения, переполне-
ние капилляров межальвеолярных перегородок кровью. Нарастает гипоксия
ткани, в связи с чем повышается сосудистая проницаемость, возникают мно-
жественные диапедезные кровоизлияния. В альвеолах, бронхах, межальвео-
лярных перегородках, лимфатических сосудах и узлах легких появляются ско-
пления нагруженных гемосидерином клеток — сидеробластов. и сидерофагов
(см. рис. 43) и свободнолежаших гемосидерина и ферритина. Возникает диф-
фузный гемосидероз легких.
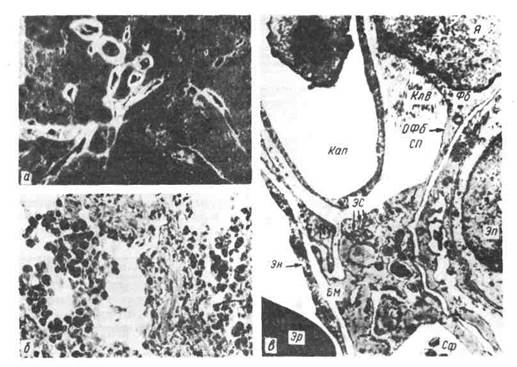
Рис. 43. Бурое уплотнение легких.
а — вид на разрезе; б — микроскопическая картина; сидерофаги в просвете легочных альвеол, склероз
альвеолярных перегородок; в — электронограмма: в расширенном септальном пространстве (СП)
сидерофаг (Сф) и активный фибробласт (Фб), цитоплазма которого образует длинный отросток
(ОФб) и содержит много канальцев гранулярной эндоплазматической сети (ЭС), свободных рибосом.
Вблизи тела фибробласта видны коллагеновые волокна (КлВ). Кап — капилляр; БМ — базальная мембрана;
Эн — эндотелий; Эп — альвеолярный эпителий; Эр - эритроцит; Я - ядро, х 12 500.
Гемосидерин, ферритин и белки плазмы (фибрин) «засоряют» строму
и лимфатические дренажи легких, что ведет к резорбционной недостаточности
их лимфатической системы, которая сменяется механической. Склероз крове-
носных сосудов и недостаточность лимфатической системы усиливают легоч-
ную гипоксию, которая становится причиной пролиферации фибробластов,
утолщения межальвеолярных перегородок (см. рис. 43). Развивается скле-
роз легких (схема IV, см. стр. 83).
Пневмосклероз при хроническом венозном застое связан с активацией фи-
бробластов, большое число которых обнаруживается в межальвеолярных
перегородках. Около тел и длинных отростков фибробластов появляются кол-
лагеновые волокна (см. рис. 43). Пролиферация фибробластов и склероз более
выражены в нижнезадних отделах легких, где сильнее выражен венозный за-
стой и больше скоплений кровяных пигментов, фибрина. Пневмосклероз, как
и гемосидероз, при буром уплотнении легких имеет каудоапикальное распро-
странение и зависит от степени и длительности венозного застоя в легких.
Помимо бурого уплотнения легких как проявления ряда заболеваний, сопровождающихся
длительным венозным застоем, существует идиопатическая бурая индурация легких
(идиопатический, или эссенциальный, гемосидероз легких; пневмогеморрагическая ремиттирую-
щая анемия; синдром Целена —Геллерстедта). Заболевание встречается редко, преимущественно
у детей в возрасте от 3 до 8 лет.
Морфогенез эссенциального гемосидероза легких принципиально не отличается от описан-
ного при вторичном буром уплотнении легких. Однако гемосидероз при этом выражен резче
и чаще сочетается с множественными геморрагиями. Причиной заболевания считают первичное
недоразвитие эластического каркаса легочных сосудов, в результате чего в легких возникают
аневризмы сосудов, застой крови и диапедезные кровоизлияния; не исключают роль инфекций
и интоксикаций, аллергии и аутоиммунизации.
Почки при хроническом общем венозном застое становятся большими,
плотными и цианотичными (цианотическая индурация); особенно
полнокровны вены мозгового вещества и промежуточной зоны. На фоне веноз-
ного застоя развивается лимфостаз. В условиях нарастающей гипоксии возни-
кают дистрофия эпителия канальцев главных отделов нефрона и склероз,
который, однако, не бывает резко выраженным. Хронический венозный за-
стой в селезенке также ведет к ее цианотической индурации.
Она увеличена, плотна, темно-вишневого цвета, отмечаются атрофия фолли-
кулов и склероз пульпы. При общем хроническом венозном застое циано-
тическая индурация свойственна и другим органам.
Местное венозное полнокровие
Местное венозное полнокровие наблюдается при затруднении
оттока венозной крови от определенного органа или части тела в связи с за-
купоркой просвета вены (тромбом, эмболом) или сдавливанием ее извне (опу-
холью, разрастающейся соединительной тканью). Так, резкое венозное полно-
кровие желудочно-кишечного тракта развивается при тромбозе
воротной вены. Мускатная печень и мускатный цирроз печени
встречаются не только при общем венозном полнокровии, но и при воспале-
нии печеночных вен и тромбозе их просветов (облитерирующий тромбофле-
бит печеночных вен), что характерно для болезни (синдрома) Бадда —
Киари. Причиной цианотической индурации почек может стать
тромбоз почечных вен. К венозному застою и отеку конечности ведет
также тромбоз вен, если коллатеральное кровообращение оказывается недо-
статочным.
Местное венозное полнокровие может возникнуть и в результате развития
венозных коллатералей при затруднении или прекращении оттока
крови по основным венозным магистралям (например, портокавальные ана-
стомозы при затруднении оттока крови по воротной вене). Переполненные
кровью коллатеральные вены резко расширяются, а стенка их истончается,
что может быть причиной опасных кровотечений (например, из расширенных
и истонченных вен пищевода при циррозе печени).
В заключение следует указать, что с венозным полнокровием связано воз-
никновение не только плазмогеморрагических, дистрофических, атрофических
и склеротических изменений, но и венозных (застойных) инфарк-
тов.
Малокровие
Малокровием, или ишемией (от греч. ischo — задерживать), назы-
вают уменьшенное кровенаполнение ткани, органа, части тела в результате
недостаточного притока крови. Речь идет как о недостаточном кровенаполне-
нии, так и о полном обескровливании.
Общее малокровие, или анемия, является заболеванием кроветворной системы и ха-
рактеризуется недостаточным содержанием эритроцитов и гемоглобина (см. «Анемия). К рас-
стройствам кровообращения анемия отношения не имеет.
Ишемизированная ткань становится бледной, дряблой, температура ее по-
нижается. Малокровный орган уменьшается, капсула его сморщивается. Из-
менения ткани, возникающие при малокровии, в конечном счете связаны
с гипоксией или аноксией, т.е. кислородным-голоданием.
В зависимости от причины, вызвавшей малокровие, момента внезапности
ее возникновения, длительности гипоксии и степени чувствительности к ней
ткани при малокровии возникают либо тонкие изменения на уровне ультра-
структур, либо грубые деструктивные изменения вплоть до ишемического
некроза — инфаркта.
При остром малокровии обычно возникают дистрофические и не-
кробиотические изменения: им предшествуют гистохимические и ультраструк-
турные изменения — исчезновение из ткани, гликогена, снижение активности
окислительно-восстановительных ферментов и деструкция митохондрий. На
основании результатов электронно-гистрохимического изучения тканевых из-
менений при остром малокровии и при инфаркте острую ишемию следует
рассматривать как предынфарктное (преднекротическое) состоя-
ние. При длительном малокровии развиваются атрофия паренхима-
тозных элементов и склероз в результате повышения коллагенсинтезирующей
активности фибробластов.
В зависимости от причин и условий возникновения различают сле-
дующие виды малокровия: 1) ангиоспастическое (рефлекторное); 2) обтура-
ционное; 3) компрессионное; 4) в результате перераспределения крови.
1. Ангиоспастическое (рефлекторное) малокровие возни-
кает вследствие спазма артерии в связи с действием различных раздражите-
лей. Например, болевое раздражение может вызвать спазм артерий
и малокровие определенных участков тела. Таков же механизм действия сосу-
досуживающих лекарственных препаратов (например, адреналина).
Ангиоспастическая ишемия появляется и при отрицательных эмоцио-
нальных аффектах («ангиоспазм неотреагированных эмоций»).
2. Обтурационное малокровие развивается вследствие закрытия
просвета артерии тромбом или эмболом, в результате разрастания соедини-
тельной ткани в просвете артерии при воспалении ее стенки (облитерирующий
эндартериит), сужения просвета артерии атеросклеротической бляшкой.
Обтурационная ишемия в связи с тромбозом артерии нередко завершает
ангиоспазм. И наоборот, ангиоспазм дополняет обтурацию артерии.
3. Компрессионное малокровие появляется при сдавлении ар-
терии опухолью, выпотом, жгутом, лигатурой.
4. Ишемия в результате перераспределения крови наблю-
дается в том случае, когда большая масса крови устремляется в ишемизиро-
ванную ранее область тела. Такова, например, ишемия головного мозга при
извлечении жидкости из брюшной полости (см. «Артериальное полнокро-
вие»).
Значение и последствия малокровия различны и зависят от особенностей
причины и продолжительности ее действия. Так, малокровие вследствие спаз-
ма артерий обычно непродолжительно и не вызывает особых расстройств. Од-
нако при длительных спазмах возможно развитие дистрофических изменений
и даже ишемического некроза (инфаркт). Острое обтурационное малокровие
особенно опасно, так как нередко ведет к инфаркту.
Если закрытие просвета артерии развивается медленно, то кровообраще-
ние может быть восстановлено с помощью коллатералей и последствия такой
анемии могут быть незначительными. Однако длительно существующее мало-
кровие рано или поздно ведет к атрофии паренхиматозных элементов
и склерозу.
Инфаркт
Инфаркт (от лат. infarcire — нафаршировать, набивать) — очаг некроза,,
возникающий в результате прекращения кровоснабжения, т. е. ишемии. По-
этому инфаркт называют также сосудистым или ишемическим не-
крозом. По существу инфаркт — это следствие и крайнее выраже-
ние ишемии.
Вид инфаркта (форма, величина, цвет) и его консистенция могут быть
различными.
Чаще инфаркты бывают клиновидными (см. рис. 44—47), основание
клина обращено к капсуле, а острие — к воротам органа. Инфаркты такой
формы образуются в селезенке, почках, легких, что определяется характе-
ром ангиоархитектоники этих органов — магистральным типом ветвления их
артерий. Реже инфаркты имеют неправильную форму (см. рис. 48).
Такие инфаркты встречаются в сердце, мозге, кишечнике, т. е. в тех органах,
где преобладает не магистральный, а рассыпной или смешанный тип ветвле-
ния артерий. Инфаркт может охватывать большую часть или весь орган
(субтотальный или тотальный инфаркт) или обнаруживается
лишь под микроскопом (микроинфаркт).
Если инфаркт развивается по типу коагуляционного некроза, то
ткань в области омертвения уплотняется, становится суховатой (инфаркт
миокарда, почек, селезенки); если же инфаркт образуется по типу коллик-
вационного некроза — она размягчается и разжижается (инфаркт моз-
га, кишки).
В зависимости от того, пропитывается ли ткань в зоне инфаркта кровью,
различают три вида инфаркта: 1) белый, 2) белый с геморрагическим венчи-
ком и 3) красный.
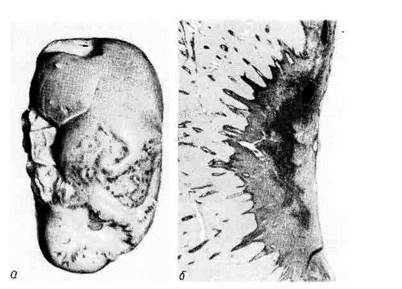
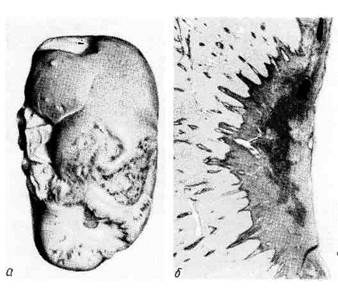
Рис. 44. Инфаркт селезенки.
а — ишемический инфаркт в виде свет-
лого треугольного участка, обращенного
основанием к капсуле; б — ангиорент-
генограмма той же селезенки; отсут-
ствие сосудов в области инфаркта.
1. Белый (ишемиче-
ский) инфаркт представ-
ляет собой участок бело-
желтого цвета, хорошо от-
граниченный от окружающей
ткани (рис. 44). Обычно он
возникает в участках с недо-
статочным коллатеральным
кровообращением, что иск-
лючает поступление крови
в область некроза; особенно
часто встречается в селезен-
ке, реже в почках.
2. Белый инфаркт с
геморрагическим
венчиком также представ-
лен участком бело-желтого
цвета, но этот участок ок-
ружен зоной кровоизлияний (рис. 45). Она образуется в результате того,
что спазм сосудов по периферии инфаркта сменяется паретическим их
расширением и развитием диапедезных кровоизлияний. Такой инфаркт на-
ходят в почках, миокарде.
3. При красном (геморрагическом) инфаркте участок омерт-
вения пропитан кровью, он темно-красный и хорошо отграничен (рис. 46,
47). Благоприятным условием для такого геморрагического пропитывания
является венозный застой. Определенное значение для развития красного ин-
фаркта имеют и особенности ангиоархитектоники органа. Встречается гемор-
рагический инфаркт, как правило, в легких, редко в кишечнике, селезенке,
почках.
Наибольшее клиническое значение имеют инфаркты сердца (миокарда), го-
ловного мозга, легких, почек, селезенки, кишечника.
В сердце инфаркт обычно белый с геморрагическим венчиком, имеет
неправильную форму, встречается чаще в левом желудочке и межжелудоч-
ковой перегородке (рис. 48), крайне редко — в правом желудочке и пред-
сердиях. Омертвение может локализоваться под эндокардом (с у б э н д о-
кардиальный инфаркт), эпикардом (субэпикардиальный ин-
фаркт) или охватывать всю толщу миокарда (трансмуральный
инфаркт). В области инфаркта на эндокарде нередко образуются тромбо-
тические, а на перикарде — фибринозные наложения, что связано с развитием
реактивного воспаления вокруг участков некроза (см. «Некроз»). Очаги
омертвения могут подвергаться размягчению (миамаляция), ведущему
к разрыву сердца и кровоизлиянию в полость сердечной сорочки. В благо-
приятных случаях инфаркт миокарда замещается соединительной тканью
(организация инфаркта), на месте его образуется рубец.
Чаще всего инфаркт миокарда встречается при атеросклерозе и гипертони-
ческой болезни, являясь причиной острой и хронической сердечной недоста-
точности (подробнее см. «Ишемическая болезнь сердца»).
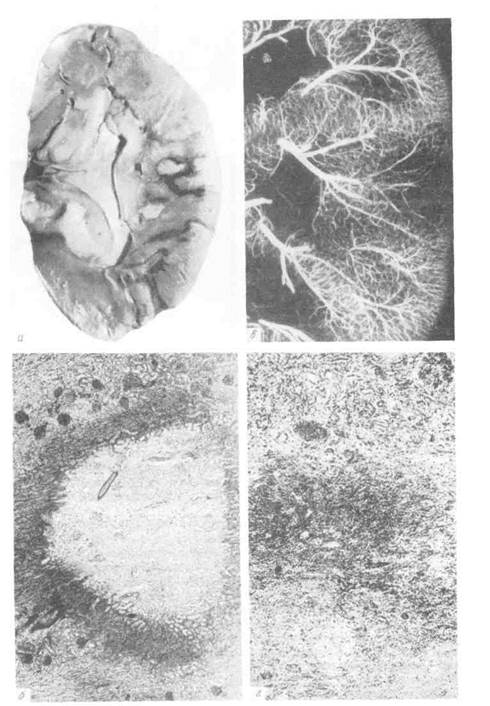
Рис. 45. Инфаркт почки.
а - ишемический инфаркт почки (вид на разрезе); в - то же при увеличении лупой
(вокруг инфаркта — геморрагии); в — ангиорентгенограмма той же почки; отсутствие сосудов
в области инфаркта; г — зона геморрагии (в центре) вокруг инфаркта (внизу).
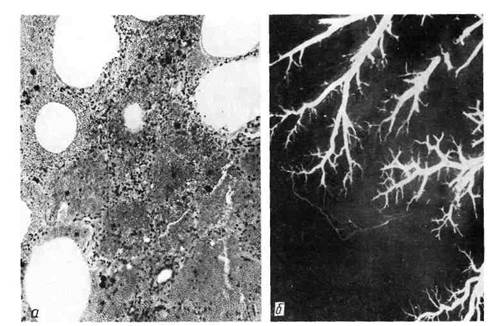
Рис. 47. Геморрагический инфаркт легкого.
а — альвеолы заполнены кровью; б — ангиорентгенограмма легкого.
В головном мозге чаще возникает белый инфаркт, который быстро
размягчается (очаг белого размягчения мозга, ем. рис. 40). Если инфаркт
образуется на фоне значительных расстройств кровообращения, венозного за-
стоя, то очаг омертвения мозга пропитывается кровью и становится
красным (очаг красного размягчения мозга). Такой инфаркт локализуется
обычно в подкорковых узлах, разрушая проводящие пути мозга, что про-
является параличами (плегии). Инфаркт мозга, как и инфаркт миокарда, чаще
всего встречается при атеросклерозе и гипертонической болезни.
Влегкихв подавляющем большинстве случаев образуется геморрагиче-
ский инфаркт (см. рис. 46, 47). Он хорошо отграничен, имеет форму конуса,
основание которого обращено к плевре.
На плевре в области инфаркта видны наложения фибрина (реактивный
плеврит). У острия конуса, обращенного к корню легкого, нередко обнаружи-
вается тромб или эмбол в ветви легочной артерии. Омертвевшая ткань
плотна, зерниста, темно-красного цвета.
Геморрагический инфаркт обычно возникает на фоне венозного застоя
в легких, причем развитие его в значительной мере определяется особенностя-
ми ангиоархитектоники легких, наличием анастомозов между системами ле-
гочной и бронхиальных артерий. В условиях застойного полнокровия и за-
крытия просвета ветви легочной артерии в область омертвения ткани легкого
из бронхиальной артерии поступает кровь, которая разрывает капилляры
и изливается в просвет альвеол. Вокруг инфаркта нередко развивается воспа-
ление легочной ткани (периинфарктная пневмония). Массивный ге-
моррагический инфаркт легкого может быть причиной надпеченочной желту-
хи. Наиболее частый исход красного инфаркта легкого — его организа-
ция, причем в постинфарктном рубце может развиться раковая опухоль.
Иногда наблюдается нагноение инфаркта, на его месте образуется абс-
цесс.

|
|
Рис. 48. Инфаркт миокарда,
а — ангиорентгенограмма сердца кролика,
у которого был воспроизведен инфаркт
миокарда (перевязка нисходящей ветви левой
венечной артерии); сосуды зоны ишемии
не инъецированы; б — фокусы ишемического
инфаркта, окруженные зоной геморрагии;
в — участок некроза миокарда, окруженный
грануляционной тканью.
Геморрагический инфаркт легкого — частая находка при ревматическом
митральном пороке и тромбоэмболии ветвей легочной артерии. Очень редко
в легких встречаются белые инфаркты. Основное условие их возникнове-
ния — склероз и облитерация просветов бронхиальных артерий. Белые ин-
фаркты легких не достигают больших размеров, они легко нагнаиваются.
В п о ч к а х инфаркт, как правило, белый с геморрагическим венчиком, ко-
нусовидный участок некроза охватывает либо корковое вещество, либо всю
толщу паренхимы (см. рис. 45). При закрытии основного артериального ство-
ла развивается тотальный или субтотальный инфаркт почки.
Своеобразной разновидностью инфарктов являются симметричные не-
крозы коркового вещества почек, ведущие к острой почечной недо-
статочности. Развитие ишемических инфарктов почек связано обычно с тром-
боэмболией, реже — с тромбозом ветвей почечной артерии, осложняющим
ревматизм, затяжной септический эндокардит, гипертоническую болезнь, ише-
мическую болезнь сердца. Редко при тромбозе почечных вен возникает ве-
нозный инфаркт почек.
В селезенке встречаются белые клиновидные инфаркты (см. рис. 44),
нередко с реактивным фибринозным воспалением капсулы и последующим-
образованием спаек с диафрагмой, париетальным листком брюшины, петля-
ми кишечника. Обычно инфаркты организуются, нагнаиваются редко.
Ишемические инфаркты селезенки связаны с тромбозом и эмболией.
При тромбозе селезеночной вены иногда образуются венозные ин-
фаркты.
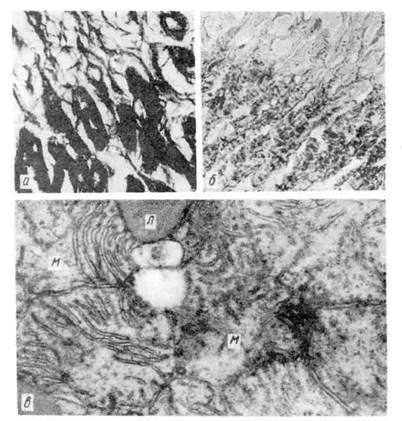
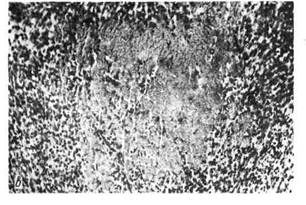
Рис. 49. Морфологические признаки ишемической стадии инфаркта.
а — исчезновение гликогена из зоны ишемии миокарда (светлый участок); ШИК-реакция; б — резкое
снижение активности дыхательных ферментов в зоне ишемии миокарда (светлый участок); реакция на
сукцинатдегидрогеназу; в — зона ишемии миокарда: набухание и деструкция митохондрий {М) вплоть
до полного их разрушения, образование включений линидов (Л), исчезновение гранул глико-
гена, х 21000.
В кишечнике инфаркты имеют геморрагический характер и нередко
подвергаются гангренозному распаду, что ведет к прободению стенки кишки
и развитию перитонита.
Редко инфаркты встречаются в сетчатке глаза, печени, мышцах,
костях.
Развитие инфаркта складывается из двух последовательных стадий —
ишемической (донекротической) и некротической, поэтому
макроскопические признаки инфаркта появляются лишь спустя определенный
период времени после начала действия факторов, вызывающих инфаркт. Этот
период для разных органов различен: он меньше для печени и селезенки
и больше для миокарда, почек, головного мозга.
Ишемическая стадия характеризуется прогрессирующими дистро-
фическими и некробиотическими изменениями ткани, которые имеют ряд био-
химических, гистохимических и электронно-микроскопических признаков (рис.
49), позволяющих понять динамику развития деструктивных процессов в оча-
ге ишемии.
В зоне ишемии отмечаются активация анаэробного гликолиза, нарушение
дыхания и его разобщение с окислительным фосфорилированием. Поэтому
очень рано в ткани на этой стадии исчезает гликоген, возникает нарушение
ионного состава клеток (выход ионов магния и калия и поступление в клетку
ионов кальция и натрия), снижается активность дыхательных ферментов, про-
исходит набухание и деструкция митохондрий. Эти изменения способствуют
закислению среды, денатурации белков и гидратации ткани. Возникает мест-
ная смерть.
Диагностика ишемической стадии инфарктов возможна на основании как
микроскопических, так и макроскопических критериев.
Для микроскопической диагностики используют гистохимические методы (исчез-
новение гликогена, снижение активности большинства дегидрогеназ), электронную микроскопию
(исчезновение гликогена, деструкция митохондрий) и люминесцентную микроскопию с исполь-
зованием ряда флюорохромов (изменение цвета свечения зоны ишемии). Для макроскопи-
ческойдиагностики применяют различные соли тетразолия, теллурит калия, которые вне
участков ишемии (где активность дегидрогеназ высокая) восстанавливаются и окрашивают
ткань в серый или черный цвет, а участки ишемии (где активность ферментов снижена или от-
сутствует) остаются неокрашенными.
Морфологическая характеристика ишемической стадии инфаркта имеет
большое практическое значение, особенно при инфарктах миокарда и голов-
ного мозга.
Некротическая стадия инфаркта — это стадия аутолиза мертвой
ткани. Поэтому для нее характерны все морфологические признаки некроза.
Непосредственной причиной развития инфаркта являются: длительный
спазм, тромбоз или эмболия артерии, а также функциональ-
ное напряжение органа в условиях н е достаточного его к р о -
во с н а б жен и я.
Огромное значение для возникновения инфаркта имеет недостаточ-
ность анастомозов и коллатералей, которая зависит от степени
поражения стенок артерий и сужения их просветов (атеросклероз, облитери-
рующий эндартериит), от степени нарушения кровообращения (например, ве-
нозного застоя) и от уровня выключения артерии тромбом или эмболом. По-
этому инфаркты и возникают обычно при тех заболеваниях, для которых
характерны тяжелые изменения артерий и общие расстройства кровообраще-
ния (ревматизм, пороки сердца, атеросклероз, гипертоническая болезнь, за-
тяжной септический эндокардит). Острой недостаточностью коллатерального
кровообращения обусловлено и развитие инфаркта при функциональном отя-
гощении органа, обычно сердца, кровоснабжение которого нарушено.
С недостаточностью анастомозов и коллатералей связано развитие
венозных инфарктов при тромбозе вен в условиях застойного полно-
кровия.
Для возникновения инфаркта большое значение имеет также состояние
тканевого обмена, т.е. метаболический фон, на котором развивается
ишемический инфаркт. Обмен веществ в органах и тканях, в которых возни-
кает инфаркт, как правило, нарушен; причиной нарушения является гипоксия,
обусловленная общими расстройствами кровообращения. Лишь закупорка
крупных магистральных артерий может привести к омертвению без предше-
ствующих расстройств кровообращения и метаболических нарушений в ткани.
Исход инфаркта зависит от особенностей причинного фактора и заболева-
ния, которое осложняет инфаркт, от состояния организма и органа, в кото-
ром он развивается, и от размеров инфаркта.
Небольшие фокусы ишемического некроза могут подвергаться а у т о л и -
з у с последующей полной регенерацией. Наиболее частый благоприятный ис-
ход инфаркта, развивающегося по типу сухого некроза, — его о рганиза-
ния и образование рубца (рис. 50). Организация инфаркта может
завершиться его п е т р и ф и к ацией ил и г ем о сидероз ом, если речь
Рис. 50. Исход инфаркта.
а — втянутые рубцы на поверх-
ности почки после заживления
инфаркта; б — рубец на месте ин-
фаркта в селезенке (лупа).
идет об организации геморрагического инфаркта. На месте инфаркта, разви-
вающегося по типу колликвационного некроза, например в мозге, образуется
киста.
Неблагоприятный исход инфаркта — его гнойноерасплавление, ко-
торое обычно связано с тромбобактериальной эмболией при сепсисе. Такие
инфаркты называются септическими.
Значение инфаркта для организма чрезвычайно велико и прежде всего по-
тому, что инфаркт — это ишемический некроз. Все, что было сказано о значе-
нии некроза, относится и к инфаркту. Однако важно отметить, что инфаркт
является одним из самых частых и грозных осл.ожнений ряда сердечно-сосу-
дистых заболеваний. Это прежде всего атеросклероз и гипертоническая бо-
лезнь. Необходимо отметить также, что инфаркты при атеросклерозе и гипер-
тонической болезни наиболее часто развиваются в жизненно важных
органах — сердце и головном мозге, и это определяет высокий процент слу-
чаев скоропостижной смерти и инвалидизации. Медико-социальное значение
инфаркта миокарда и его последствий позволило выделить его как проявле-
ние самостоятельного заболевания — и шеми ческой болезни сердца.
Стаз
Стаз (от лат. stasis — остановка) — остановка тока крови в сосудах ми-
кроциркуляхорнохо русла, главным образом в капиллярах.
Остановке тока крови обычно предшествует резкое его замедление, что
обозначается как предстатическое состояние, или предстаз.
В механизме стаза основное значение имеют изменения реологиче-
ских свойств крови, представленные усиленной внутрикапил-
лярной агрегацией эритроцитов, что ведет к увеличению сопроти-
вления току крови по капиллярам, замедлению его и остановке.
Гемолиз и свертывание крови при стазе не наступают.
Состояние крови, в основе которого лежит агрегация эритроцитов, получило название
слалжа (от англ. sludge — густая кровь, тина). Основными особенностями крови при сладже
считают прилипание друг к другу эритроцитов, лейкоцитов или тромбоцитов и нарастание вяз-
кости плазмы, что приводит к затруднению перфузии крови через сосуды микроциркуляторного
русла.
очень рано в ткани на этой стадии исчезает гликоген, возникает нарушение
ионного состава клеток (выход ионов магния и калия и поступление в клетку
ионов кальция и натрия), снижается активность дыхательных ферментов, про-
исходит набухание и деструкция митохондрий. Эти изменения способствуют
закислению среды, денатурации белков и гидратации ткани. Возникает мест-
ная смерть.
Диагностика ишемической стадии инфарктов возможна на основании как
микроскопических, так и макроскопических критериев.
Для микроскопической диагностики используют гистохимические методы (исчез-
новение гликогена, снижение активности большинства дегидрогеназ), электронную микроскопию
(исчезновение гликогена, деструкция митохондрий) и люминесцентную микроскопию с исполь-
зованием ряда флюорохромов (изменение цвета свечения зоны ишемии). Для макроскопи-
ческойдиагностики применяют различные соли тетразолия, теллурит калия, которые вне
участков ишемии (где активность дегидрогеназ высокая) восстанавливаются и окрашивают
ткань в серый или черный цвет, а участки ишемии (где активность ферментов снижена или от-
сутствует) остаются неокрашенными.
Морфологическая характеристика ишемической стадии инфаркта имеет
большое практическое значение, особенно при инфарктах миокарда и голов-
ного мозга.
Некротическая стадия инфаркта — это стадия аутолиза мертвой
ткани. Поэтому для нее характерны все морфологические признаки некроза.
Непосредственной причиной развития инфаркта являются: длительный
спазм, тромбоз или эмболия артерии, а также функциональ-
ное напряжение органа в условиях недостаточного его кро-
воснабжения.
Огромное значение для возникновения инфаркта имеет недостаточ-
ность анастомозов и коллатералей, которая зависит от степени
поражения стенок артерий и сужения их просветов (атеросклероз, облитери-
рующий эндартериит), от степени нарушения кровообращения (например, ве-
нозного застоя) и от уровня выключения артерии тромбом или эмболом. По-
этому инфаркты и возникают обычно при тех заболеваниях, для которых
характерны тяжелые изменения артерий и общие расстройства кровообраще-
ния (ревматизм, пороки сердца, атеросклероз, гипертоническая болезнь, за-
тяжной септический эндокардит). Острой недостаточностью коллатерального
кровообращения обусловлено и развитие инфаркта при функциональном отя-
гощении органа, обычно сердца, кровоснабжение которого нарушено.
С недостаточностью анастомозов и коллатералей связано развитие
венозных инфарктов при тромбозе вен в условиях застойного полно-
кровия.
Для возникновения инфаркта большое значение имеет также состояние
тканевого обмена, т. е. метаболический фон, на котором развивается
ишемический инфаркт. Обмен веществ в органах и тканях, в которых возни-
кает инфаркт, как правило, нарушен; причиной нарушения является гипоксия,
обусловленная общими расстройствами кровообращения. Лишь закупорка
крупных магистральных артерий может привести к омертвению без предше-
ствующих расстройств кровообращения и метаболических нарушений в ткани.
Исход инфаркта зависит от особенностей причинного фактора и заболева-
ния, которое осложняет инфаркт, от состояния организма и органа, в кото-
ром он развивается, и от размеров инфаркта.
Небольшие фокусы ишемического некроза могут подвергаться а у т о л и -
з у с последующей полной регенерацией. Наиболее частый благоприятный ис-
ход инфаркта, развивающегося по типу сухого некроза, — его организа-
ция и образование рубца (рис. 50). Организация инфаркта может
завершиться его петрификацией или гемосидерозом, если речь
Рис. 50. Исход инфаркта.
а — втянутые рубцы на поверх-
ности почки после заживления
инфаркта; б - рубец на месте ин-
фаркта в селезенке (лупа).
идет об организации геморрагического инфаркта. На месте инфаркта, разви-
вающегося по типу колликвационного некроза, например в мозге, образуется
киста.
Неблагоприятный исход инфаркта — его гнойное расплавление, ко-
торое обычно связано с тромбобактериальной эмболией при сепсисе. Такие
инфаркты называются септическими.
Значение инфаркта для организма чрезвычайно велико и прежде всего по-
тому, что инфаркт — это ишемический некроз. Все, что было сказано о значе-
нии некроза, относится и к инфаркту. Однако важно отметить, что инфаркт
является одним из самых частых и грозных осложнений ряда сердечно-сосу-
дистых заболеваний. Это прежде всего атеросклероз и гипертоническая бо-
лезнь. Необходимо отметить также, что инфаркты при атеросклерозе и гипер-
тонической болезни наиболее часто развиваются в жизненно важных
органах — сердце и головном мозге, и это определяет высокий процент слу-
чаев скоропостижной смерти и инвалидизации. Медико-социальное значение
инфаркта миокарда и его последствий позволило выделить его как проявле-
ние самостоятельного заболевания — ишемической болезни сердца.
Стаз
Стаз (от лат. stasis — остановка) — остановка тока крови в сосудах ми-
кроциркулятарного русла, главным образом в капиллярах.
Остановке тока крови обычно предшествует резкое его замедление, что
обозначается как предстатическое состояние, или предстаз.
В механизме стаза основное значение имеют изменения реологиче-
ских свойств крови, представленные усиленной внутрикапил-
лярной агрегацией эритроцитов, что ведет к увеличению сопроти-
вления току крови по капиллярам, замедлению его и остановке.
Гемолиз и свертывание крови при стазе не наступают.
Состояние крови, в основе которого лежит агрегация эритроцитов, получило название
с л а д ж а (от англ. sludge — густая кровь, тина). Основными особенностями крови при сладже
считают прилипание друг к другу эритроцитов, лейкоцитов или тромбоцитов и нарастание вяз-
кости плазмы, что приводит к затруднению перфузии крови через сосуды микроциркуляторного
русла.
Развитию внутрикапиллярной агрегации эритроцитов
способствуют: изменения капилляров, ведущие к повышению проницаемости
их стенок; нарушения физико-химических свойств эритроцитов, выражающие-
ся в снижении их поверхностного потенциала; изменения состава белков крови
за счет увеличения грубодисперсных фракций; дисциркуляторные расстрой-
ства — венозное полнокровие (застойный стаз) или ишемия (ишеми-
ческий стаз), нарушения иннервации микроциркуляторного русла.
Причиной развития стаза являются дисциркуляторные нарушения, они мо-
гут быть связаны с действием физических (высокая температура, холод) и хи-
мических (кислоты, щелочи) факторов, развиваются при инфекционных (на-
пример, малярия, сыпной тиф) и неинфекционных (например, пороки сердца,
ишемическая болезнь сердца) заболеваниях.
Последствия и значение стаза определяются не только его длительностью,
но и чувствительностью органа или ткани к кислородному голоданию (маля-
рийная кома на почве стаза в капиллярах головного мозга). Стаз — явление
обратимое. Состояние после разрешения стаза называется постстати-
ческим. Необратимый стаз ведет к некробиозу и некрозу.
Тромбоз
Тромбоз (от греч. thrombosis — свертывание) — прижизненное свертыва-
ние крови в просвете сосуда или в полостях сердца. Образующийся при этом
сверток крови называют тромбом.
При свертывании лимфы также говорят о тромбозе и внутрисосудистый
сверток лимфы называют тромбом, однако закономерности лимфотромбоза
и гемогромбоза различны.
Тромбоз — патологический процесс, в основе которого лежит физиологиче-
ское свойство крови подвергаться свертыванию.
Свертывание крови — ферментативный аутокаталитический процесс, описанный отече-
ственным физиологом А. А. Шмидтом в 1864 г. Согласно современному представлению, схема
свертывания крови включает четыре стадии:
I — протромбокиназа+ активаторы-> тромбокиназа (активный тромбопластин);
II — протромбин + Са2++тромбокиназа->тромбин;
III — фибриноген + тромбин-> фибрин-мономер;
IV — фибрин-мономер+ фибринстимулирующий фактор->фибрин-полимер.
Установлено, что процесс свертывания крови совершается в виде каскадной реакции (теория
«каскада») при последовательной активации белков-предшественников, или факторов
свертывания, находящихся в крови или тканях. На этом основании различают внутреннюю
(кровь) и внешнюю (ткань) свертывающие системы. Взаимоотношения внутренней и внешней
систем представлены на схеме V [по Б. А. Кудряшову, 1975].
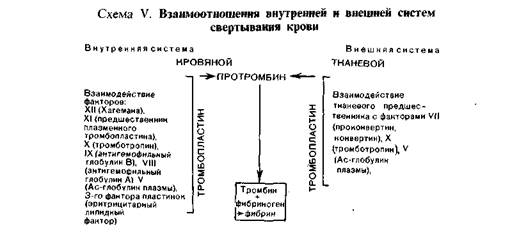
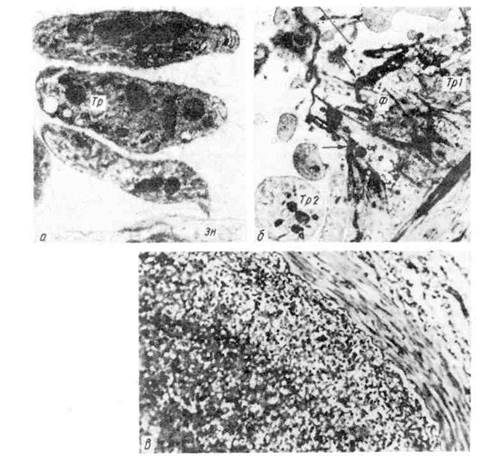
Рис. 51. Морфогенез громбообразования.
а — первая стадия образования тромба. Небольшие скопления тромбоцитов (Тр) около поврежденной
эндотелиальной клетки (Эн). Тромбоциты расположены на некотором расстоянии друг от дру-
га, х 14000 (по Ашфорду и Фримену); б - вторая стадия образования тромба. В участке разрушенного
эндотелия видны скопления тромбоцитов (Тр1) и фибрина (Ф); Тр2 - неизменённые тромбо-
циты, х 7750 (по Ашфорду и Фримену); в — тромботические массы, состоящие из фибрина, лейкоцитов
и агглютинирующихся эритроцитов.
Большим достижением было доказательство наличия, помимо свертывающей, п р о т и в о-
свертывающей системы крови; причем в последнее время находят возможным говорить
о двух противосвертывающих системах (Б. А. Кудряшов). Первая из них представлена есте-
ственными антикоагулянтами, такими, как антитромбин, гепарин, система фибрино-
лизина (профибринолизин, или плазминоген; фибринолизин, или плазмин; их активаторы и ин-
гибиторы). Вторая система — рефлекторн о-гуморальной регуляции гемостаза.
Она включается в том случае, когда первая оказывается несостоятельной. Действие этой (вто-
рой) противосвертывающей системы заключается в том, что при достижении в крови пороговой
концентрации тромбина происходит рефлекторное возбуждение хеморецепторов кровеносного
русла. Это ведет к выбросу в кровь гепарина и активаторов фибринолизина. В результате отно-
сительного избытка гепарина блокируется активность тромбина, выброс активаторов плазмино-
гена приводит к относительному избытку плазмина и лизису фибрина.
Можно считать доказанным, что свертывающая и противосвертывающая системы
являются взаимосвязанными частями единой системы гемостаза.
Таким образом, тромбоз представляет собой проявление
нарушенной регуляции единой системы гемостаза жид-
кого состояния крови в сосудистом русле.
Механизм тромбообразования складывается из четырех последовательных
стадий: агглютинации тромбоцитов, коагуляции фибриногена и образования
фибрина, агглютинации эритроцитов, преципитации белков плазмы.
Агглютинации тромбоцитов предшествует выпадение их из тока
крови, направленное движение и прилипание (адгезия) к месту повреждения
эндотелиальной выстилки (рис. 51). По-видимому, «травма» тромбоцитов
способствует высвобождению липопротеидного комплекса периферической
зоны пластинок (гиаломер), который обладает агглютинирующими свойства-
ми. Агглютинация тромбоцитов завершается их дегрануляцией, высвобожде-
нием серотонина и тромбопластического фактора пластинок, что ведет
к образованию активного тромбопластина и включению последующих фаз
свертывания крови.
Коагуляция фибриногена и образование фибрина (см.
рис. 51) связаны с ферментативной реакцией (тромбопластина тромбин->
-> фибриноген-> фибрин), причем матрицей для фибрина становится «оголен-
ная» центральная зона пластинок (грануломер), которая содержит фермент
с ретрактильными свойствами ретрактозим пластинок).
Активность ретрактозима, как и серотонина, высвобождающегося при рас-
паде пластинок и обладающего сосудосуживающими свойствами, позволяет
«отжать» фибринный сверток, который захватывает лейкоциты, агглю-
тинирующиеся эритроциты и преципитирующие белки
плазмы крови (см. рис. 51).
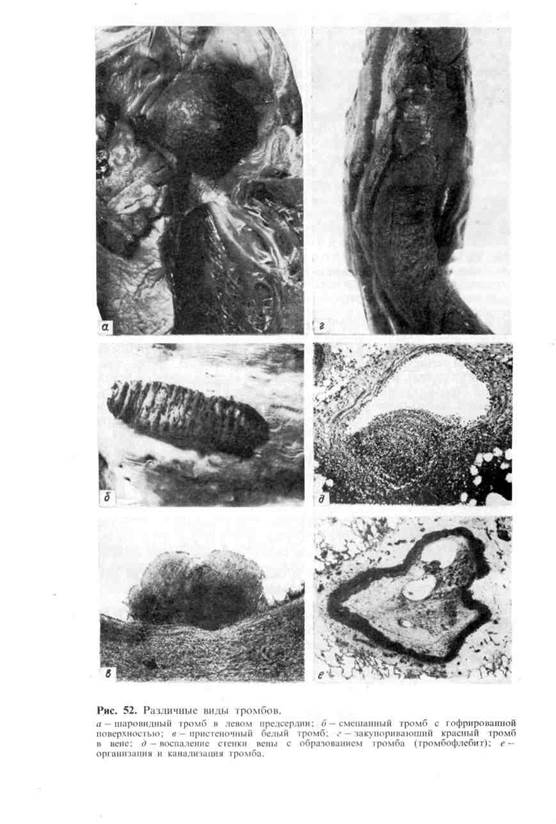
Морфология тромба. Тромб обычно прикреплен к стенке сосуда в месте ее
повреждения, где начался процесс тромбообразования. Поверхность его го-
фрированная (рис. 52), что отражает ритмичное выпадение склеивающихся
тромбоцитов и следующее за их распадом отложение нитей фибрина при про-
должающемся кровотоке. Тромб, как правило, плотной консистенции, сухой.
Размеры тромба различны — от определяемых лишь при микроскопическом
исследовании до выполняющих полости сердца или просвет крупного сосуда
на значительном протяжении. Тромб обычно построен из ветвящихся балок
склеившихся тромбоцитов и находящихся между ними пучков фибрина с эри-
троцитами и лейкоцитами (см. рис. 51).
В зависимости от строения и внешнего вида, что опре-
деляется особенностями и темпами тромбообразования, различают белые,
красные, смешанные (слоистые) и гиалиновые тромбы.
Белый тромб состоит из тромбоцитов, фибрина и лейкоцитов (см.
рис. 52), образуется медленно при быстром токе крови (чаще в
артериях).
Красный тромб, помимо тромбоцитов и фибрина, содержит большое
число эритроцитов (см. рис. 52), образуется быстро при медленном токе кро-
ви (обычно в венах). В наиболее часто встречающемся смешанном тром-
бе (см. рис. 52), который имеет слоистое строение (слоистый тромб)
и пестрый вид, содержатся элементы как белого, так и красного тромба.
В смешанном тромбе различают головку (имеет строение белого тромба),
тело (собственно смешанный тромб) и хвост (имеет строение красного
тромба). Головка прикреплена к эндотелиальной выстилке сосуда, что отли-
чает тромб от посмертного сгустка крови. Слоистые тромбы образуются ча-
ще в венах, в полости аневризмы аорты и сердца. Гиалиновый тромб-
особый вид тромбов. Он редко содержит фибрин, состоит из разрушенных
эритроцитов, тромбоцитов и преципитирующих белков плазмы; при этом
тромботические массы напоминают гиалин (рис. 53). Такие тромбы встре-
чаются в сосудах микроциркуляторного русла.
Тромб может быть п р и стен о ч н ы м, т. е. оставлять часть просвета сво-
бодным (см. рис. 52), или закупоривающим, т. е. обтурировать просвет
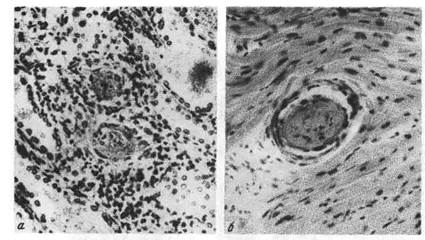
Рис. 53. Гиалиновый тромб.
а —в артериолах почки; б —в мелкой ветви венечной артерии сердца.
(обтурирующий тромб — см. рис. 52). Пристеночный тромб обнаружи-
вается часто в сердце на клапанном или париетальном эндокарде при его во-
спалении (тромбоэндокардит), в ушках и между траОекулами при хро-
нической сердечной недостаточности (порок сердца, хроническая ишемическая
болезнь сердца), в крупных артериях при атеросклерозе, в венах при их воспа-
лении (тромбофлебит, см. рис. 52), в аневризмах сердца и сосудов. Закупори-
вающий тромб образуется чаще в мелких артериях и венах при росте присте-
ночного. Нередко он заполняет просвет аорты, крупной артерии или вены.
Увеличение размеров тромба происходит путем наслоения тромботических
масс на первичный тромб, причем рост тромба может происходить как по то-
ку, так и против тока крови. Иногда тромб, который начал образовываться
в венах, например голени, быстро растет по току крови, достигая собира-
тельных венозных сосудов, например нижней полой вены. Такой тромбоз на-
зывают прогрессирующим. Растущий тромб левого предсердия может
отрываться от эндокарда. Находясь свободно в полости предсердия, он «от-
шлифовывается» движениями крови и принимает шаровидную форму — ша-
ровидны йтромб (см. рис. 52). Тромб в аневризмах называют д и л а т а -
ционным.
Патогенез тромбоза сложен и складывается из участия как местных, так
и общих факторов, которые, взаимодействуя друг с другом, ведут к образова-
нию тромба.
К местным факторам относят изменения сосудистой сшнси, замена
ление и нарушение тока крови; к общим факторам — нарушение
регуляции свертывающей и противосвертывающей системами жидкого состоя-
ния крови в сосудистом русле и изменение состава крови.
Среди местных факторов развития тромбоза велика роль изменений
сосудистой стенки. Особенно важны повреждения внутренней оболочки
сосуда, его эндбтелия, которые способствуют прилипанию к месту поврежде-
ния тромбоцитов, их дегрануляции и высвобождению тромбопластина, т. е.
.началу тромбообразования. Природа изменений стенок артерий и вен, способ-
ствующих развитию тромбоза, различна. Нередко это воспалительные
изменения— васкулиты (артерииты и флебиты) при многих инфек-
ционных (сыпной тиф, туберкулез, сепсис) и инфекционно-аллергический
(ревматизм, узелковый периартериит) заболеваниях. При развитии тромбоза на
почве васкулита говорят о тромбоваскулите (тромбоартериите
или тромбофлебите). К этой же категории относится тромбоэндо-
кардит, т. е. эндокардит, осложненный тромбозом.
Дата добавления: 2015-11-26 | Просмотры: 903 | Нарушение авторских прав
|