Регенерация отдельных тканей и органов
Регенерация крови происходит таким образом, что вначале возме-
щается плазма за счет поступления в кровеносное русло тканевой жидкости,
а затем — форменные элементы крови за счет поступления в кровоток ново-
образованных клеток из кроветворной ткани.
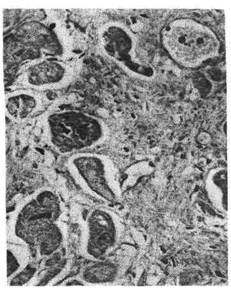
Рис. 100. Внекостномозговое кроветворение. Периваскулярное скопление молодых клеток
крови.
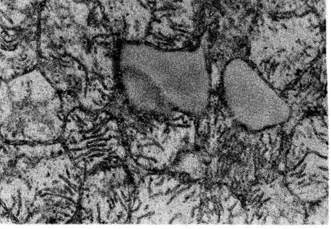
Рис. 101. Регенерация сосудов путем почкования.
Гемопоэз в постэмбриональном периоде осуществляется в миелоидной и лимфоидной тка-
нях, причем эритроциты, зернистые лейкоциты и тромбоциты образуются в красном костном
мозге, лимфоциты — в лимфатических узлах, селезенке и лимфатических фолликулах ряда орга-
нов, а моноциты, по-видимому, во всех кроветворных тканях. Источником образования фор-
менных элементов крови служит единая полипотентная стволовая клетка, которая является об-
щим предшественником всех трех ростков кроветворения и всех клеток иммунокомпетентной
системы.
Репаративная регенерация крови отличается от физиологиче-
ской не только большей интенсивностью, но и тем, что кроветворение может
происходить вне красного костного мозга — внекостномозговое, или
экстрамедуллярное, кроветворение (рис. 100). При этом ак-
тивный красный мозг появляется в длинных трубчатых костях на месте жиро-
вого костного мозга (миелоидное превращение жирового костного
мозга). Жировые клетки вытесняются растущими островками кроветворной
ткани, которая заполняет костномозговой канал и выглядит сочной, темно-
красной. В результате выселения из костного мозга стволовых клеток крове-
творной ткани очаги экстрамедуллярного (гетеротопического) кроветворения
появляются во многих органах и тканях — селезенке, печени, лим-
фатических узлах, слизистых оболочках, жировой клетчатке и т. д.
При больших кровопотерях репаративная регенерация крови оказывается недостаточной,
поэтому широко пользуются переливанием (трансплантацией) донорской крови от живых людей
или трупов.
Регенерация крови может быть резко угнетена (например, при луче-
вой болезни, апластической анемии, алейкии, агранулоцитозе) или извра-
щена (например, при злокачественной анемии, полицитемии, лейкозе).
В кровь при этом поступают незрелые, функционально неполноценные и бы-
стро разрушающиеся форменные элементы. В таких случаях говорят о пато-
логической регенерации крови.
Костный мозг обладает очень высокими пластическими свойствами
и может восстанавливаться даже при значительных повреждениях. Лимфа-
тические узлы хорошо регенерируют только в тех случаях, когда сохра-
няются связи приносящих и выносящих лимфатических сосудов с окружающей
их соединительной тканью. Регенерация ткани селезенки при повреждении
бывает, как правило, неполной, погибшая ткань замещается рубцом.
Возможности и формы регенерации к р о в ен о с н ы х и лимфатиче-
ских сосудов в значительной мере зависят от их калибра. Микросо-
суды обладают большей способностью регенерировать, чем крупные сосуды.
Новообразование микрососудов может происходить путем почкования или
аутогенно.
При регенерации сосудов путем почкования (рис. 101) в их стенке
появляются боковые выпячивания за счет усиленно делящихся эндоте-
лиальных клеток (ангиобласты), которые образуют клеточные тяжи. В тяжах
из эндотелия возникают просветы, тяжи превращаются в выстланные эндоте-
лием трубки, в которые поступает кровь или лимфа из материнского сосуда.
Другие элементы сосудистой стенки образуются за счет дифференцировки эн-
дотелия и окружающих сосуд соединительнотканных клеток. В сосудистую
стенку врастают нервные волокна, ответвляющиеся от предсуществующих не-
рвов. Аутогенное новообразование сосудов состоит в том, что в соедини-
тельной ткани появляются скопления недифференцированных клеток, между
которыми возникают щели. В эти щели открываются предсуществующие ка-
пилляры и изливается кровь. Клетки соединительной ткани, окружающие ще-
ли, образуют эндотелиальную выстилку и другие элементы стенки сосуда.
Крупные сосуды не обладают достаточными пластичными свойства-
ми. Поэтому при повреждении их стенки (атеросклероз, артериит, аортит,
аневризма, травма) восстанавливаются лишь структуры внутренней оболочки,
ее эндотелиальная выстилка; элементы средней и наружной оболочек обычно
замещаются соединительной тканью, что ведет нередко к сужению или обли-
терации просвета сосуда.
В связи с этим в настоящее время широкое распространение получила замена пораженного
участка сосуда трансплантатом. Такой трансплантат представляет собой сосуд, взятый от трупа
или изготовленный из синтетических материалов. С помощью сосудистых трансплантатов мож-
но заменить большие участки пораженных сосудов (артерий, аорты) или создать новые крове-
носные пути в обход пораженных сосудов (рис. 102).
Регенерация соединительной ткани начинается с пролифера-
ции молодых мезенхимальных элементов и новообразования микрососудов.
Образуется молодая, богатая клетками и тонкостенными сосудами соедини-
тельная ткань, которая имеет характерный вид. Это — сочная темно-красная
ткань с зернистой, как бы усыпанной крупными гранулами поверхностью, что
явилось поводом назвать ее грануляционной тканью. Гранулы пред-
ставляют собой выступающие над поверхностью петли новообразованных
тонкостенных сосудов, которые составляют основу грануляционной ткани.
Между сосудами много недифференцированных лимфоцитоподобных клеток
соединительной ткани, лейкоцитов, плазматических клеток и лаброцитов (рис.
103).
В дальнейшем происходит созревание грануляционной тка-
ни, в основе которого лежит дифференцировка клеточных элементов, волок-
нистых структур, а также сосудов. Число гематогенных элементов уменьшает-
ся, а фибробластов — увеличивается. С фибробластами связано образо-
вание тропоколлагена и гликозаминогликанов соединительной ткани. В связи
с синтезом фибробластами тропоколлагена в межклеточных пространствах
образуются нежные аргирофильные волокна (см. рис. 103), а за-
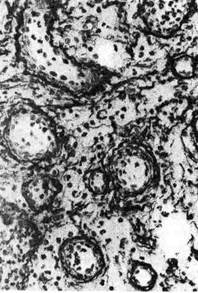
Рис. 102. Сосудистый протез из пласт-
массы, заменяющий часть брюшной
аорты, и отходящие от нее крупные
ветви, пораженные атеросклерозом и
непроходимые для крови (по Д. С. Сар-
кисову).
Рис. 103. Грануляционная ткань. Меж-
ду тонкостенными сосудами много
недифференцированных клеток соеди-
нительной ткани и аргирофильных
волокон. Импрегнация серебром.
тем и коллагеновые. Синтез фибробластами гликозаминогликанов при-
водит к накоплению последних, особенно хондроитинсульфатов, в основном
веществе соединительной ткани, которые расходуются на построение волок-
нистых структур. По мере превращения (созревания) фибробластов в фи-
броциты количество коллагеновых волокон увеличивается, они группи-
руются в пучки. Одновременно уменьшается количество сосудов, они
дифференцируются в артерии и вены. Созревание грануляционной ткани за-
вершается образованием грубоволокнистой рубцовой ткани.
Новообразование соединительной ткани происходит не только при ее по-
вреждении, но и при неполной регенерации других тканей, а также при орга-
низации (инкапсуляции), заживлении ран, продуктивном воспалении.
Созревание грануляционной ткани может иметь те или иные отклоне-
ния. Воспаление, развивающееся в грануляционной ткани, приводит к за-
держке ее созревания, а чрезмерная синтетическая активность фибробла-
стов — к избыточному образованию коллагеновых волокон с последующим
резко выраженным их гиалинозом. В таких случаях возникает рубцовая ткань
в виде опухолевидного образования синюшно-красного цвета, которая возвы-
шается над поверхностью кожи в виде келоида. Келоидные рубцы обра-
Рис. 104. Первичное костное
сращение. Интермедиарная
костная мозоль (показана
стрелкой), спаивающая от-
ломки кости (по Г. И. Лав-
рищевой).
зуются после различных травматических поражений кожи, особенно после
ожогов.
Регенерация жировой ткани происходит за счет новообразова-
ния соединительнотканных клеток, которые затем превращаются в жировые
путем накопления в цитоплазме липидов. Жировые клетки складываются
в дольки, между которыми располагаются соединительнотканные прослойки
с сосудами и нервами. Регенерация жировой, ткани может происходить также
из ядросодержащих остатков цитоплазмы жировых клеток, которые путем на-
копления капель липидов превращаются в зрелые жировые клетки.
Регенерация костной ткани при переломе костей в значительной
мере зависит от степени разрушения кости, правильной репозиции костных
отломков, местных условий (состояние кровообращения, воспаление и т. д.).
При неосложненном костном переломе, когда костные отломки непо-
движны, может происходить первичное костное сращение (рис.
104). Оно начинается с врастания в область дефекта и гематомы между от-
ломками кости молодых мезенхимальных элементов и сосудов. Возникает так
называемая предварительная соединительнотканная мо-
золь, в которой сразу же начинается образование кости. Оно связано с акти-
вацией и пролиферацией остеобластов в зоне повреждения, но прежде
всего в периосте и эндосте. В остеогенной фиброретикулярной ткани по-
являются малообызвествленные костные балочки, число которых нарастает.
Образуется предварительная костная мозоль. В дальней-
шем она созревает и превращается в зрелую пластинчатую кость: так обра-
зуется окончательная костная мозоль, которая по своему строе-
нию отличается от костной ткани лишь беспорядочным расположением
костных перекладин. После того как кость начинает выполнять свою функ-
цию и появляется статическая нагрузка, вновь образованная ткань с помощью
остеокластов и остеобластов подвергается перестрой -
к е, появляется костный мозг, восстанавливаются васкуляризация и иннерва-
ция. При нарушении местных условий регенерации кости (расстройство кро-
вообращения), подвижности отломков, обширных диафизарных переломах
происходит вторичное костное сращение (рис. 105). Для этого ви-
да костного сращения характерно образование между костными отломками
сначала хрящевой ткани, на основе которой строится костная ткань. Поэтому
при вторичном костном сращении говорят о предварительной костно-хря-
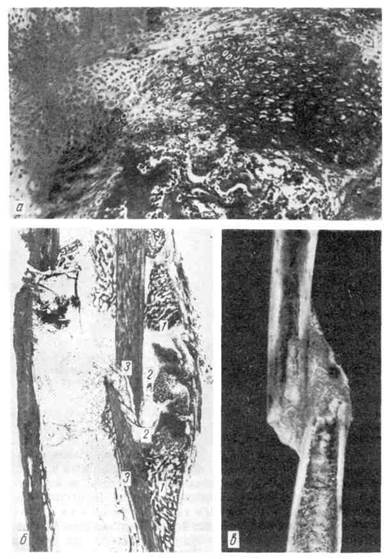
Рис. 105. Вторичное костное сращение (по Г. И. Лаврищевой).
а — микроскопическая картина костно-хрящевой периостальной мозоли: участок костной ткани среди
хрящевой; б — периостальная костно-хряшевая мозоль (гистотопограмма через 2 мес после операции):
1 — костная часть; 2 — хрящевая часть; 3 — отломки кости; в — периостальная мозоль, спаивающая
смещенные отломки кости.
щевой мозоли, которая со временем превращается в зрелую кость. Вто-
ричное костное сращение по сравнению с первичным встречается значительно
чаще и занимает больше времени.
При неблагоприятных условиях регенерация костной ткани мо-
жет быть нарушена. Так, при инфицировании раны регенерация кости задер-
живается. Костные осколки, которые при нормальном течении регенераторно-
го процесса выполняют функцию каркаса для новообразованной костной
ткани, в условиях нагноения раны поддерживают воспаление, что тормозит
регенерацию. Иногда первичная костно-хрящевая мозоль не дифференцирует-
ся в костную. В этих случаях концы сломанной кости остаются подвижными,
образуется ложный сустав.
Избыточная продукция костной ткани в ходе регенерации приводит к по-
явлению костных выростов — экзостозов.
Регенерация хрящевой ткани в отличие от костной происходит
обычно неполно. Лишь небольшие дефекты ее могут замещаться новообразо-
ванной тканью за счет камбиальных элементов надхрящницы — х о н д р о -
б л а с т о в. Эти клетки создают основное вещество хряща, а затем превра-
щаются в хрящевые клетки. Крупные дефекты хрящевой ткани замещаются
рубцовой.
Регенерация мышечной ткани, ее возможности и формы раз-
личны в зависимости от вида этой ткани. Гладкие мышцы, клетки ко-
торых обладают способностью к митозу и амитозу, при незначительных де-
фектах могут регенерировать достаточно полно. Значительные участки
повреждения гладких мышц замещаются рубцом. При этом в сохранившихся
участках гладкие мышечные волокна подвергаются гипертрофии. Новообра-
зование гладких мышечных волокон может происходить путем превращения
(метаплазии) элементов соединительной ткани. Так образуются пучки гладких
мышечных волокон в плевральных спайках, в подвергающихся организации
тромбах, при дифференцировке сосудов.
Регенерация поперечнополосатой мускулатуры проис-
ходит лишь при сохранении сарколеммы. Внутри трубок из сарколеммы
осуществляется регенерация саркоплазмы и ее органелл, в результате чего по-
являются клетки, называемые миобласгами. Они вытягиваются, число
ядер в них увеличивается, в саркоплазме постепенно дифференцируются мио-
фибриллы, и трубки сарколеммы вновь превращаются в поперечнополосатые
мышечные волокна.
В последнее время регенерацию скелетных мышц связывают с клетка-
ми-сателлитами, которые располагаются под сарколеммой, т. е. внутри
мышечного волокна, и являются камбиальными. В случае травмы клет-
ки-сателлиты начинают усиленно делиться, затем подвергаются дифференци-
ровке и обеспечивают восстановление мышечных волокон.
Если при повреждении мышцы целость сарколеммы нарушается, то на ме-
сте травмы обычно образуется рубец. На концах разрывов волокон возни-
кают колбообразные выбухания, которые содержат большое число ядер и на-
зываются мышечными почками.
Соединения мышечных почек с обоих концов разрыва и восстановления
непрерывности волокна не происходит. Место разрыва заполняется грануля-
ционной тканью, превращающейся в рубец (мышечная мозоль). Лишь
при заполнении места травмы размельченной мышцей возможно полноценное
восстановление мышечных волокон (А. Н. Студитский).
Регенерация мышцы сердца человека, как и поперечнополосатой
мускулатуры, заканчивается рубцеванием дефекта. Однако в сохранившихся
мышечных волокнах происходит интенсивная гиперплазия ультраструктур,
что ведет к гипертрофии волокон и восстановлению функции органа (рис.
106).
Регенерация эпителия осуществляется в большинстве случаев до-
статочно полно, так как он обладает высокой регенераторной способностью.
Особенно хорошо регенерирует покровный эпителий. Восстановление
многослойного плоского ороговевающего эпителия воз-
можно даже при довольно крупных дефектах кожи. При регенерации эпидер-
миса в краях дефекта происходит усиленное размножение клеток зародышево-
го (камбиального) мальпигиева слоя. Образующиеся эпителиальные клетки
сначала покрывают дефект одним слоем. В дальнейшем пласт эпителия ста-
Рис. 106. Регенерационная гипертрофия миокарда. По периферии рубца гипертрофиро-
ванные мышечные волокна.
Рис. 107. Регенерация эпителия в дне хронической язвы желудка.
новится многослойным, клетки его дифференцируются, и он приобретает все
признаки эпидермиса, включающего в себя ростковый, зернистый, блестящий
(на подошвах и ладонной поверхности кистей) и роговой слои. Созревание
клеток сопровождается синтезом в их цитоплазме специфического для орого-
вевающего эпителия белка — кератогиалина, превращающегося в элеи-
дин и кератин.
Однако регенераторные возможности покровного эпителия не безграничны. Большие де-
фекты кожных покровов, например после ожогов, долго не эпителизируются. Для закрытия де-
фекта в таких случаях используют как аутопластику, покрывая дефект слоем кожи, взятым у то-
го же больного со здоровых участков, так и гомопластику.
При нарушении регенерации эпителия кожи образуются незаживающие
язвы, нередко с разрастанием в их краях атипичного эпителия, что может по-
служить основой для развития рака кожи.
Аналогичным образом регенерирует покровный эпителий сли-
зистых оболочек (многослойный плоский неороговевающий, пере-
ходный, однослойный призматический и многорядный мерцательный). Дефект
слизистой оболочки восстанавливается за счет пролиферации клеток, высти-
лающих крипты и выводные протоки желез. Недифференцированные упло-
щенные клетки эпителия сначала покрывают дефект тонким слоем (рис. 107),
затем эти клетки увеличиваются в объеме и принимают форму, свойственную
клеточным структурам соответствующей эпителиальной выстилки. Парал-
лельно частично или полностью восстанавливаются и железы слизистой обо-
лочки (например, трубчатые железы кишки, железы эндометрия).
Регенерация мезотелия брюшины, плевры и околосердечной сум-
ки характеризуется делением сохранившихся клеток. На поверхности дефекта
появляются сравнительно крупные кубические клетки, которые затем упло-
Рис. 108. Регенерационная гипер-
трофия гепатоцитов.
щаются. При небольших
дефектах мезотелиальная
выстилка восстанавлива-
ется быстро и полно.
Важное значение для
восстановления покровно-
го эпителия и мезогелия
имеет состояние подлежа-
щей соединительной тка-
ни, так как эпителизация
любого дефекта возможна
лишь после запол-
нения его грануля-
ционной тканью.
Регенерация специфического эпителия печени, поджелудочной
железы, почек, желез внутренней секреции, легочных альвеол осуществляется
по типу регенерационной гипертрофии в участках повреждения
ткань замещается рубцом, а по периферии его происходят гиперплазия и ги-
пертрофия клеток паренхимы. В печени участок некроза всегда подвергает-
ся рубцеванию, однако в остальной части органа происходит интенсивное но-
вообразование клеток, а также гиперплазия субклеточных структур
в предсуществующих клетках, что сопровождается их гипертрофией (рис. 108).
В результате этого исходная масса и функция органа быстро восстанавли-
ваются. Регенераторные возможности печени почти безграничны. После уда-
ления 4/5 органа исходная масса его восстанавливается в течение 11/2-2 мес
(Д. С. Саркисов). Такие высокие регенераторные способности печени позво-
ляют в клинике осуществлять обширные резекции этого органа по поводу
опухолей, пороков развития, эхинококкоза и других болезней.
В поджелудочной железе регенераторные процессы хорошо выра-
жены как в экзокринных отделах, так и панкреатических островках, причем
эпителий экзокринных отделов становится источником восстановления
островков. В почках некротические изменения эпителия канальцев заканчи-
ваются размножением сохранившихся клеток и восстановлением канальцев,
однако лишь при сохранении тубулярной базальной мембраны. При ее разру-
шении (тубулорексис) эпителий не восстанавливается и каналец заме-
щается соединительной тканью. Не восстанавливается погибший канальцевый
эпителий и в том случае, когда одновременно с канальцем погибает сосу-
дистый клубочек. При этом на месте погибшего нефрона разрастается рубцо-
вая соединительная ткань, а окружающие нефроны подвергаются регенера-
ционной гипертрофии. Если степень нефросклероза невелика, функция органа
восстанавливается.
После удаления одной почки оставшаяся подвергается гипертрофии (ви-
карная гипертрофия) и со временем обеспечивает нормальную почеч-
ную функцию.
В железах внутренней секреции восстановительные процессы
также выражаются в форме неполной регенерации. В легком после удале-
ния отдельных долей в оставшейся части происходит гипертрофия и гипер-
плазия тканевых элементов, обеспечивающие восстановление функции органа.
Однако удаление больших участков легочной ткани, особенно целого легкого,
может сопровождаться развитием функциональной недостаточности оставше-
гося органа.
Регенерация специализированного эпителия может протекать атипично,
что ведет к разрастанию соединительной ткани, структурной перестройке
и деформации органов. В таких случаях говорят о циррозе (цирроз
печени, нефроцирроз, пневмоцирроз).
Регенерация разных отделов нервной системы происходит неоднозначно.
В головном и спинном мозге новообразования ганглиозных клеток
не происходит и при разрушении их восстановление функции возможно лишь
за счет внутриклеточной регенерации сохранившихся клеток. Невроглии, осо-
бенно микроглии, свойственна клеточная форма регенерации, поэтому дефекты
ткани головного и спинного мозга обычно заполняются пролиферирующими
клетками невроглии — возникают так называемые глиальные (г л и -
озные) рубцы.
При повреждении вегетативных узлов наряду с гиперплазией уль-
траструктур клеток происходит и их новообразование.
При нарушении целости периферического нерва регенерация про-
исходит за счет центрального отрезка, сохранившего связь с клеткой, в то
время как периферический отрезок погибает. Размножающиеся клетки шван-
новской оболочки погибшего периферического отрезка нерва располагаются
вдоль него и образуют футляр (так называемый бюнгнеровский тяж), в ко-
торый врастают регенерирующие осевые цилиндры из проксимального от-
резка. Регенерация нервных волокон завершается их миелинизацией и восста-
новлением нервных окончаний. Регенерационная гиперплазия рецепто-
ров, перицеллюлярных синаптических приборов и эффекторов иногда
сопровождается гипертрофией их концевых аппаратов.
Если регенерация нерва в силу тех или иных причин нарушается (значи-
тельное расхождение частей нерва, развитие воспалительного процесса), то
в месте его перерыва образуется рубец, в котором беспорядочно распола-
гаются регенерировавшие осевые цилиндры проксимального отрезка нерва.
Аналогичные разрастания возникают на концах перерезанных нервов
в культе конечности после ее ампутации. Такие разрастания, образованные
нервными волокнами и фиброзной тканью, называются ампутационны-
ми невромами.
ГИПЕРТРОФИЯ И ГИПЕРПЛАЗИЯ
Гипертрофия (от греч. hyper — чрезмерно, trophe — питание) и гиперплазия
(от греч. plaseo — образую) играют исключительно важную роль в компенса-
торно-приспособительных процессах, обеспечивая сохранение гомеостаза при
многих болезнях. Эти процессы по своей сущности близки регенерации. Одна-
ко они направлены не только на возмещение дефекта в клетках, тканях, орга-
нах, но и на усиление их функции в связи с возникающей повышенной функ-
циональной активностью.
Гипертрофия — увеличение объема органа, ткани, клеток, г и п е р -
п л а з и я — увеличение числа структурных элементов тканей и клеток. Со-
временные методы исследования (электронная микроскопия) позволили выяс-
нить, что при гипертрофии клеток (увеличение объема) происходит увеличе-
ние числа (гиперплазия) внутриклеточных ультраструктур (ядер, ядрышек,
митохондрий, рибосом, лизосом, эндоплазматической сети). В то же время
при гиперплазии тканей могут появляться гипертрофированные (гигантские)
многоядерные клетки.
В одних тканях и органах встречаются преимущественно процессы г и -
пертрофии с внутриклеточной гиперплазией (например, мы-
шечные клетки сердца, скелетная мускулатура, нейроны головного мозга),
Рис. 109. Ложная гипертрофия
мышцы.
в других (например, соеди-
нительная ткань, кости, сли-
зистые оболочки, костный
мозг, лимфатические узлы и
селезенка) — гиперпла-
зия клеток. В последующем
изложении мы будем пользо-
ваться тем и другим терми-
ном, не проводя между ними
резкой границы.
Гипертрофию, которая
представлена увеличением
деятельной массы органа
(ткани), обеспечивающей его
специализированную функ-
цию, называют истинной гипертрофией. В тех случаях, когда объем
(масса) органа увеличивается за счет соединительной или жировой ткани,
говорят о ложной гипертрофии (рис. 109).
К гипертрофиям и гиперплазиям не имеет отношения увеличение органов,
возникшее в результате порока развития: общий гигантский рост
или гигантизм отдельных органов и тканей, конечности, кишечника (бо-
лезнь Гиршпрунга), рогового слоя эпидермиса (ихтиоз), ногтей (они-
хо г ри фо з).
Морфологические проявления: органы увеличиваются в размере, но сохра-
няют свою конфигурацию и очертания. В сердце при гипертрофии утолщают-
ся стенки желудочков, трабекулярные и сосочковые мышцы. Стенки таких по-
лых органов, как мочевой пузырь, желудок, кишечник, при истинной
гипертрофии утолщены за счет гипертрофии и гиперплазии гладкой мускула-
туры. Полость органа или расширяется (эксцентрическая гипер-
трофия), или уменьшается (концентрическая гипертрофия). Не-
которые железистые органы (печень, щитовидная железа, предстательная
железа, молочные железы и др.) приобретают при гипертрофии и гиперплазии
узловатое строение.
В клетках гипертрофированного органа наблюдаются структурно-функцио-
нальные изменения, свидетельствующие 6 повышении интенсивности обмена.
Так, в клетках гипертрофированного миокарда с увеличением числа миофиламентов
и митохондрий (см. рис. 99) происходит интенсивный синтез белка, повышается содержание
РНК. В ядрышках наблюдается усиленное накопление РНК, возрастает средняя концентрация
ДНК и ее содержание в ядрах, усиливается активность окислительно-восстановительных фер-
ментов. При гипертрофии нейронов ядро и ядрышко становятся крупными, число их увели-
чивается до 2 — 3, возрастает число митохондрий и других органелл, а также нейрофибрилл.
В гипертрофированных клетках печени, экзокринной части поджелудочной железы
становится более развитой эндоплазматическая сеть, возрастает число расположенных на ней
рибосом, что обеспечивает усиленный синтез белка.
Таким образом, усиленная функция гипертрофированного органа
происходит за счет увеличения числа его специфических вну-
триклеточных образований, причем в одних случаях этот процесс
развертывается на базе предсуществующих клеток и приводит к увеличе-
нию их объема, в других он сопровождается образованием новых
клеток.
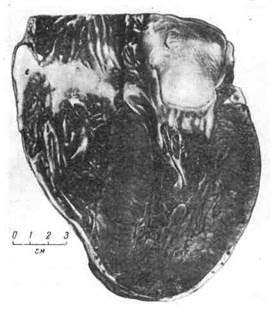
Рис. 110. Рабочая гипертрофия левого желудочка сердца.
Рис. 111. Гиперплазия митохондрий при гипертрофии сердца.
Классификация. В зависимости от механизма возникновения вы-
деляют несколько видов гипертрофии (гиперплазии): 1) рабочая (компенса-
торная), 2) викарная, 3) нейрогуморальная, 4) гипертрофические разрастания.
1. Рабочая (компенсаторная) гипертрофия (гиперпла-
зия) развивается при усиленной работе органа, когда наблюдается увеличе-
ние объема (числа) клеток, определяющих его специализированную функцию.
Рабочая гипертрофия может наблюдаться при усиленной нагрузке и в физио-
логических условиях (например, гипертрофия сердца и выраженная гипертро-
фия скелетной мускулатуры у спортсменов и лиц физического труда). С осла-
блением физической нагрузки или с ее прекращением гипертрофия исчезает.
При болезнях усиленная работа органа необходима в случаях наличия в нем
дефектов, которые компенсируются усиленной работой сохранивших свою
структуру и функцию частей органа.
Рабочая гипертрофия возникает в сердце, желудочно-кишечном тракте, мо-
чевыводящих путях и других органах.
Гипертрофия сердца представляет собой наиболее яркий пример
компенсаторной гипертрофии и достигает наибольших степеней при вро-
жденных и приобретенных пороках клапанов, сопровождающихся стенозом
атриовентрикулярных отверстий и выносящих сосудистых трактов желудоч-
ков, при гипертонической болезни (рис. 110), врожденном сужении аорты,
склерозе сосудов легких и т. д. Гипертрофии подвергается преимущественно
отдел миокарда, который выполняет основную работу при данных условиях
нарушенного кровообращения (левый желудочек при пороках аортальных
клапанов, правый — при пороке митрального и т. д.). Масса сердца при этом
может в 3 — 4 раза превышать массу нормального, достигая иногда 900— 1000 г.
Увеличиваются и размеры сердца. В основе гипертрофии миокарда лежит
увеличение массы саркоплазмы мышечных клеток, размеров ядра,
Рис. 112. Распад митохонд-
рий и появление жировых
включений в клетке сокра-
тительного миокарда при де-
компенсации сердца.
числа миофиламентов, величины и числа митохондрий (рис. 111), т. е. ги-
перплазия внутриклеточных ультраструктур. При этом объем
мышечных волокон увеличивается.
Одновременно с гипертрофией миокарда происходит содружественная ги-
перплазия волокнистых структур стромы, что следует рассматривать как
укрепление соединительнотканного каркаса напряженно работающего сердца.
Одновременно с гипертрофией мышечных клеток увеличивается число интра-
муральных сосудистых ветвей, гипертрофируются элементы нервного аппара-
та сердца.
Следовательно, в основе гипертрофии миокарда лежат процессы, содруже-
ственно протекающие в мышечных волокнах, строме миокарда, его сосуди-
стой системе и интрамуральном нервном аппарате. Каждый из них предста-
вляет собой составную часть комплексного понятия «гипертрофиро-
ванное сердце» и обеспечивает свое участие в развертывании и под-
держании усиленной работы сердца в течение длительного, иногда много-
летнего, периода.
При компенсированной рабочей гипертрофии миокарда длинник сердца
увеличивается за счет выносящего тракта (линии, соединяющей основание
Полулунных клапанов аорты с наиболее отдаленной точкой верхушки
сердца, длина которой в норме равна 8 — 9 см); приносящий тракт (ли-
ния, соединяющая верхушку сердца с местом прикрепления заднего паруса
двустворчатого клапана) не изменяется. Такое расширение полостей сердца
обозначают как активное, компенсаторное, или тоногенное.
Развитию компенсаторной гипертрофии сердца способствуют не только
механические факторы, препятствующие току крови, но и н е й р о -
гуморальные влияния. Полноценное осуществление компенсаторной
гипертрофии требует определенного уровня иннервации органа и гормональ-
ного баланса. В этом глубокий биологический смысл компенсаторной гипер-
трофии сердца, обеспечивающей необходимый функциональный уровень об-
щего кровообращения и близкую к нормальной функцию органа. Однако это
благополучие только кажущееся: в фазе компенсации морфологические изме-
нения миокарда могут нарастать, если не устранена вызывающая их причина.
В гипертрофированных кардиомиоцитах возникают дистрофические измене-
ния (рис. 112), в строме миокарда — склеротические процессы, сократительная
деятельность миокарда постепенно ослабевает и развивается сердечная
Рис. 113. Гипертрофия стенки
мочевого пузыря.
декомпенсация, т.е.
состояние, при котором
мышца сердца не в со-
стоянии продолжать на-
пряженную работу. При
декомпенсации гипертро-
фированного миокарда
происходит попереч-
ное, пассивное, или
миогенное расшире-
ние полости желудочков
сердца.
Если причину, привед-
шую к гипертрофии мио-
карда, устранить до раз-
вития декомпенсации серд-
ца, размеры и масса его
могут постепенно умень-
шиться до нормальных
или почти нормальных.
Это означает, что гипертрофия миокарда представляет собой процесс
обратимый. При этом мышечные клетки сердца вновь приобретают
обычные размеры. Из этого следует, что колебание числа внутриклеточных
ультраструктур, происходящее в результате непрерывной смены гипер-
пластических и атрофических процессов, определяется и ре-
гулируется степенью функциональной активности, которая тре-
буется от органа в каждый данный момент. Чем дальше зашли вторичные
склеротические изменения миокарда, часто сопровождающие его гипертро-
фию, тем труднее и медленнее последняя подвергается восстановлению
после устранения вызвавшей ее причины. Этим в значительной мере
объясняются более благоприятные результаты ранних оперативных вмеша-
тельств на сердце при заболеваниях, сопровождающихся его гипертрофией.
Гипертрофия стенки желудка или кишки возникает выше
участка сужения их просвета. Гладкомышечный слой их стенки гипертрофи-
руется, функциональная способность сохраняется. Просвет полости выше су-
жения обычно расширен. Спустя определенный период времени фаза компен-
сации сменяется декомпенсацией в результате несостоятельности гипертрофи-
рованного мышечного слоя.
Гипертрофия стенки мочевого пузыря встречается при г и -
перплазии предстательной железы, суживающей мочеиспуска-
тельный канал (рис. 113). Стенка мочевого пузыря утолщается, со стороны
слизистой оболочки видны мышечные трабекулы (трабекулярная гипертро-
фия). Функциональная несостоятельность гипертрофированных мышц ведет
к декомпенсации гипертрофии стенки пузыря, расширению его просвета.
2. Викарная (заместительная) гипертрофия наблюдается
при гибели в связи с болезнью или после оперативного удаления одного из
парных органов (легкие, почки и др.). Компенсация нарушенной функции обес-
печивается усиленной работой оставшегося органа, который подвергается ги-
пертрофии. По патогенетической сущности и значению для организма викар-
Рис. 114. Железисто-кис-
тозная гиперплазия эндо-
метрия.
ная гипертрофия близка регенерационной гипертрофии. В ее
возникновении большую роль играет комплекс рефлекторных и гуморальных
влияний, как и при компенсаторной гипертрофии.
3. Нейрогуморальная гипертрофия и гиперплазия воз-
никают на почве нарушений функции эндокринных желез (гормональные
или коррелятивные гипертрофия и гиперплазия). Физиологи-
ческим прототипом таких гипертрофии и гиперплазии, имеющим несомненно
приспособительное значение, может служить гипертрофия матки и
молочных желез при беременности и лактации. В беременной матке
гладкие мышечные волокна становятся во много раз длиннее и шире; мо-
лочные железы резко увеличиваются. В условиях, когда возникает дисфункция
яичников, в слизистой оболочке матки развивается гиперплазия желез, иногда
с кистозным расширением их просвета — так называемая железисто-ки-
стозная гиперплазия эндометрия (рис. 114), сопровождающаяся
нерегулярными маточными кровотечениями. При атрофических процессах
в яичках у мужчин в их грудной железе развивается гиперплазия желе-
зистых долек, что приводит к увеличению размеров всей железы — отмечается
гинекомастия (от греч. gyne — женщина, matos — грудь). Гиперфункция
передней доли гипофиза, возникающая обычно на почве аденомы, сопро-
вождается увеличением органов и выступающих частей скелета — развивается
акромегалия (от греч. akros — крайний, выступающий, megalos —
крупный).
Коррелятивные гипертрофии и гиперплазии представляют собой проявле-
ния реакции на те или иные гормонально обусловленные стимулы. Эти реак-
ции имеют для организма относительно приспособительное значение и неред-
ко являются почвой для опухолевого процесса.
4. Гипертрофические разрастания, ведущие к увеличению раз-
меров тканей и органов, возникают в результате различных причин. Они ча-
сто встречаются при хроническом воспалении, например, на слизистых обо-
лочках с образованием полипов, кондилом, гиперплазией желез; при
нарушениях лимфообращения в нижних конечностях и застое лимфы, что ве-
дет к разрастанию соединительной ткани, развитию слоновости (см. рис. 60).
Гипертрофическое разрастание жировой и соединительной ткани возникает
при частичной или полной атрофии органа (ложная гипертрофия). Так, при
атрофии мышц между волокнами разрастается жировая ткань, при атрофии
почки жировой ткани вокруг нее становится больше. При снижении давления
в сосудах разрастается интима, при атрофии мозга утолщаются кости черепа.
Все перечисленные процессы гипертрофического разрастания опорной тка-
ни, заполняющей место, занятое ранее органом или тканью, носят название
вакатной (от лат. vacuum — пустой) гипертрофии. Роль гипертрофиче-
ских разрастаний в компенсаторно-приспособительных процессах мала.
Значение гипертрофии и гиперплазии для организма очень велико. За их
счет осуществляется компенсация нарушенных функций органов и тканей.
В то же время разрастания тканей, возникающие при воспалении и нейрогу-
моральных влияниях, могут причинить организму значительный ущерб и при-
вести к развитию опухолей.
АТРОФИЯ
Атрофия — прижизненное уменьшение объема органов, тканей, клеток,
сопровождающееся ослаблением или прекращением их функции. Она может
рассматриваться как выражение приспособительных процессов, возникающих
в новых условиях существования организма. В известной мере атрофия может
быть противопоставлена гипертрофии.
Не всякое уменьшение органа относится к атрофии. В связи с нарушениями в ходе онтогене-
за орган может полностью отсутствовать — агенезия, сохранять вид раннего зачатка —
аплазия, не достигать полного развития — гипоплазия. Если наблюдается гармоничное
уменьшение всех органов и общее недоразвитие всех систем организма, говорят о карлико-
вом росте.
Классификация. Атрофию делят на физиологическую и патологическую.
Физиологическая атрофия наблюдается на протяжении жизни че-
ловека — от момента рождения до глубокой старости. Так, после рождения
атрофируются и облитерируются пупочные артерии, артериальный (боталлов)
проток; у пожилых людей атрофируются половые железы, у стариков — ко-
сти, межпозвоночные хрящи и т. п. Старческая атрофия сопровождается сни-
жением интенсивности метаболических процессов в тканях и органах.
Патологическая атрофия наблюдается в любом возрасте и вызы-
вается различными причинами, среди которых наибольшее значение имеют
недостаточное питание, нарушение деятельности эндокринных желез, цен-
тральной и периферической нервной системы, интоксикации. Патологическая
атрофия — обратимый процесс. После устранения причин, вызывающих
атрофию, если она не достигла высокой степени, возможно полное восстано-
вление структуры и функции органа. Патологическая атрофия может иметь
общий характер или же возникает в какой-либо системе тканей или органе.
Общая атрофия, или истощение, встречается в следующих фор-
мах: 1) алиментарное истощение; 2) истощение при раковой кахексии1;
3) истощение при гипофизарной кахексии; 4) истощение при церебральной ка-
хексии; 5) истощение при других заболеваниях.
1. Алиментарное истощение отмечается при недостаточном по-
ступлении питательных веществ или при нарушении их усвоения. Постепенно
в организме происходит уменьшение запасов жира, атрофируется произволь-
ная мускулатура. Атрофичная жировая клетчатка принимает охряно-желтый
цвет в связи с накоплением пигмента — липохрома. Жировая клетчатка
эпикарда и жировой костный мозг пропитываются серозной жидкостью и ста-
новятся отечными (серозная атрофия жира клетчатки). В коже
1 Понятия «истощение» и «кахексия» не однозначны. Кахексия (от греч. kakos — плохой,
hexis — состояние) может в начальной стадии не сопровождаться истощением, а выражаться
в прогрессирующих дистрофических изменениях органов и в нарастающем остеопорозе.
Рис. 115. Бурая атрофия печени.
голодающих людей происходит
усиленное образование пигмен-
та меланина, и поэтому она
приобретает серо-коричневую
окраску, эпидермис истончает-
ся. Развивается остеопороз.
Сердце и печень уменьшаются,
венечные сосуды становятся из-
вилистыми. В мышечных клет-
ках миокарда (около полюсов
ядер), в клетках печени, в во-
локнах скелетной мускулатуры,
в клетках центральной и веге-
тативной нервной системы на-
капливается пигмент липо-
фусцин, вследствие чего органы приобретают буровато-коричневую окраску.
В этих случаях говорят о бурой атрофии органов (рис. 115).
Процесс атрофии при голодании идет неравномерно. Раньше всего атро-
фия развивается в подкожной клетчатке, позднее в сердце и в головном мозге.
Изменения органов при других формах истощения сходны с теми, которые
описаны при голодании.
2. Истощение при раковой кахексии наблюдается при любой
локализации опухоли. Особенно резко оно выражено при раке пищевода, же-
лудка, кишечника вследствие нарушения пищеварения, а также общего дей-
ствия опухоли на организм.
3. Истощение при г и по фи з арной кахексии (болезни Сим-
мондса) развивается при атрофических процессах в гипофизе, например от
образования рубцов после кровоизлияний, эмболии. В связи с тем что функ-
ция гипофиза тесно связана с гипоталамусом, полагают, что в основе гипофи-
зарной кахексии лежит нарушение усвоения питательных веществ.
Гормональная атрофия вплоть до полного истощения наблюдается при
понижении функции щитовидной железы (микседема).
4. Истощение при церебральной кахексии возникает при
поражениях гипоталамуса на почве воспаления или опухоли и развивается
в связи с нарушением усвоения питательных веществ.
5. Истощение при других з а б о л е в а н и я х наблюдается обыч-
но при хронических затяжных инфекциях (туберкулез, бруцеллез, хроническая
дизентерия) и связано с глубокими нарушениями обмена веществ и всасыва-
ния питательных веществ в кишечнике.
Внешний вид больных при истощении характерен. Отмечается резкое исху-
дание (уменьшение массы тела), подкожная жировая клетчатка отсутствует,
глаза запавшие, кожа сухая, дряблая, живот втянут. При вскрытии трупов об-
наруживают уменьшение размеров органов. Жировая клетчатка там, где она
сохранилась, имеет буроватую окраску, в печени и миокарде находят явления
бурой атрофии. В эндокринных железах наблюдаются атрофические и дистро-
фические изменения, выраженные в неодинаковой степени в зависимости от
причины истощения. В нервных клетках находят признаки дистрофии. В коре
головного мозга обнаруживаются участки погибших нервных клеток, сосу-
дистые изменения как проявления гипоксии.
Местная атрофия возникает от разнообразных причин. Различают
следующие виды местной атрофии: 1) дисфункциональная; 2) от недостаточ-
Рис. 116. Атрофия позвонков от давления аневризмы.
117 «18
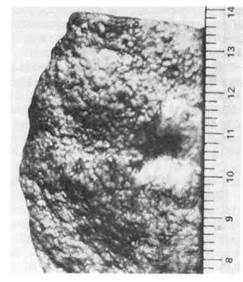
Рис. 117. Гидроцефалия
Рис. 118. Зернистая атрофия почки.
ности кровоснабжения; 3) от давления; 4) нейротическая; 5) под воздей-
ствием физических и химических факторов.
1. Дисфункциональная атрофия, или атрофия от без-
действия, развивается в результате снижения функции органа. К этому ви-
ду относятся атрофии: мышц при переломе костей, заболеваниях суставов,
ограничивающих движения; зрительного нерва после удаления глаза; краев
зубной ячейки, лишенной зуба. Интенсивность обмена веществ в тканях пони-
жена, к ним притекает недостаточное количество крови, питательных веществ.
Однако при стимуляции деятельности клеток, например скелетной мускула-
туры с помощью гимнастики, массажа и других мероприятий, можно поддер-
живать жизнедеятельность ткани на нормальном уровне.
2. Атрофия от недостаточности кровоснабжения разви-
вается вследствие сужения артерий, питающих данный орган. Недостаточный
приток крови вызывает гипоксию, вследствие чего деятельность паренхима-
тозных элементов снижается, размер клеток уменьшается. Гипоксия стимули-
рует пролиферацию фибробластов, в органе с недостаточным кровообраще-
нием развивается склероз. Такой процесс наблюдается в миокарде, когда на
почве постепенно прогрессирующего склероза венечных артерий развивается
диффузный кардиосклероз; при склерозе сосудов почек развиваются атрофия
и сморщивание почек. Склероз сосудов головного мозга вызывает атрофию
и глиозные разрастания в коре головного мозга (старческое слабоумие).
3. Атрофия от давления развивается в органе, если на него оказы-
вается давление (опухоль, аневризма). Даже в органах, состоящих из плотной
ткани, при длительном давлении возникают нарушения целости (узуры). Та-
кие дефекты могут появиться в телах позвонков, в грудине при давлении на
них аневризмы (рис. 116). Атрофия от давления возникает в почках при за-
труднении оттока мочи. Моча растягивает просвет лоханки, сдавливает ткань
почки, в которой постепенно ослабляется и прекращается мочеобразование.
С течением времени почка превращается в мешок с тонкими стенками, что
обозначают как гидронефроз. При затруднении оттока спинномозговой
жидкости происходят расширение желудочков и атрофия ткани мозга — ги-
дроцефалия (рис. 117). В основе атрофии от давления лежат по существу
недостаточный приток крови к клеткам и возникающая в связи с этим
гипоксия.
4. Нейротическая атрофия обусловлена нарушениями связи орга-
на с нервной системой, что происходит при разрушении нервных проводни-
ков, вызываемом травмой, воспалением, опухолью, а также при повреждении
нервных клеток. Чаще всего этот вид атрофии развивается в поперечнополо-
сатых мышцах в результате гибели моторных нейронов передних рогов спин-
ного мозга или нервных стволов, относящихся к данным мышцам, при полио-
миелите, при воспалении лицевого нерва. Поперечнополосатые мышцы
атрофируются неравномерно, поэтому на поперечном разрезе- одни пучки
толстые, другие тонкие или совсем исчезают; остаются только ядра, число
которых увеличено за счет почкования. При атрофии мышечных волокон уси-
ленно развиваются межмышечная соединительная и жировая ткани.
5. Атрофия под воздействием физических и химиче-
ских факторов — нередкое явление. Под действием лучевой энергии
атрофия бывает особенно выражена в костном мозге, половых органах. Йод
и тиоурацил подавляют функцию щитовидной железы, что ведет к ее атро-
фии. Некоторые гормональные препараты также вызывают атрофические из-
менения в эндокринных железах. Так, при длительном применении АКТГ,
кортикостероидов может возникнуть атрофия коры надпочечников и развить-
ся надпочечниковая недостаточность. Продолжительное употребление инсу-
лина приводит к атрофии панкреатических островков.
Внешний вид органа при атрофии различен. В большинстве случаев раз-
меры органа уменьшаются, поверхность его гладкая (гладкая атро-
фия). Реже органы, например почки (рис. 118), печень, принимают зернистый
или бугристый вид (зернистая атрофия). При гидронефрозе, гидроце-
фалии, ложной гипертрофии органы увеличены, но не за счет паренхима-
тозных элементов, а вследствие скопления жидкости или разрастания жиро-
вой клетчатки. Иногда эта клетчатка разрастается вокруг атрофированного
органа, например почки.
Значение атрофии для организма определяется степенью уменьшения орга-
на и понижения его функции. Если атрофия и склероз не достигли большой
степени, то после устранения причины, вызвавшей атрофию, возможно вос-
становление структуры и функции, о чем уже говорилось выше. При опреде-
ленных условиях атрофированный орган впоследствии может подвергаться
даже гипертрофии.
В экспериментах на крысах, например, установлено (А. X. Коган, В. В. Серов), что при сте-
нозе артерии одной из почек происходит атрофия соответствующей почки, но если после этого
еще более сузить просвет артерии контралатеральной почки, то почка, ранее подвергшаяся атро-
фии, гипертрофируется.
Далеко зашедшие атрофические изменения необратимы.
ПЕРЕСТРОЙКА ТКАНЕЙ И МЕТАПЛАЗИЯ
Перестройка тканей в большинстве случаев является морфологиче-
ским выражением приспособления. В основе ее лежат гиперплазия и регенера-
ция. Примером перестройки может служить коллатеральное крово-
обращение, возникающее при затруднении тока крови в магистральных
сосудах. При нем происходит расширение просвета вен и артерий, отходящих
от пораженного магистрального сосуда, утолщение стенок за счет гипертро-
фии мышечных и новообразования эластических волокон. Структура мелких
сосудов обретает характер более крупных. Перестройка в костях губчатого
вещества наблюдается при изменении направления нагрузки на кость (напри-
мер, после перелома, при рахите, заболеваниях суставов).
Перестройка ткани встречается в некоторых тканях при изменившихся ус-
ловиях их существования. Например, в легких, в участках ателектаза, упло-
щенный альвеолярный эпителий принимает кубическую форму в связи с пре-
кращением доступа воздуха. Нефротелий, выстилающий полость капсулы
Шумлянского — Боумена, при выключении почечного клубочка становится куби-
ческим. Такие изменения эпителия называют гистологической акко-
модацией (А. И. Абрикосов).
Метаплазия (от греч. metaplasso — превращать) — переход одного вида
ткани в другой, родственный ей вид. Метаплазия чаще встречается в эпителии
или соединительной ткани, реже — в других тканях. Переход одной ткани
в другую наблюдается строго в пределах одного зародышевого листка и раз-
вивается при пролиферации молодых клеток (например, при регенерации, но-
вообразованиях). Метаплазия всегда возникает в связи с предшествующей
пролиферацией недифференцированных клеток, т. е. является непрямой.
Не следует принимать за метаплазию гетеротопию или г е т е р о -
п л а з и ю, когда эпителий появляется не на обычном месте вследствие порока
развития.
Метаплазия эпителия чаще всего проявляется в виде перехода призма-
тического эпителия в ороговевающий плоский (эпидермальная метаплазия).
Она наблюдается, например, в
дыхательных путях при хрони-
ческом бронхите, бронхоэкта-
зах, у курильщиков, при недос-
татке витамина А (рис. 119);
в выводных протоках слюнных
желез, поджелудочной и пред-
стательной железах, в придат-
ке яичка. Метаплазия начина-
ется с размножения камбиаль-
ных клеток, дифференцирую-
щихся в направлении не приз-
матического, а многослойного
плоского эпителия. Переход в
обратном направлении, т. е.
многослойного неороговеваю-
щего плоского эпителия в ци-
линдрический, носит название
прозоплазии (этим терми- Рис. 119. Метаплазия призматического эпителия
ном подчеркивается повышение в плоский
уровня дифференцировки по
сравнению с исходной тканью).
Наблюдается метаплазия эпи-
телия желудка в кишечный, метаплазия эпителия слизистой оболочки кишеч-
ника в эпителий слизистой оболочки желудка.
На почве метаплазии эпителия может развиться раковая опухоль.
Метаплазия соединительной ткани с образованием хряща и кости
встречается в рубцах (особенно часто в послеоперационных рубцах передней
стенки живота), в стенке аорты при атеросклерозе, в сороме мышц, в строме
опухолей, в капсуле заживших очагов первичного туберкулеза. Во всех этих
случаях образованию хрящевой и костной ткани предшествует выраженная
в разной степени пролиферация молодых клеток соединительной ткани, диф-
ференцирующихся в направлении хондро- и остеобластов.
Своеобразный процесс костной метаплазии соединительной ткани наблю-
дается в эпителии мочевыводящих путей: вокруг пласта такого эпителия,
пересаженного в подкожную клетчатку или в мышцу, образуется костная
ткань, что связывают с фосфатазной активностью эпителия.
Метаплазия может возникать в ходе физиологической перестройки тканей
без предшествующей потери ткани. Так происходит миелоидная мета-
плазия селезенки, лимфатических узлов, возникновение очагов внекостно-
мозгового кроветворения при инфекционных болезнях.
ОРГАНИЗАЦИЯ
Организацией называют замещение участка некроза, дефекта ткани
или тромба соединительной тканью.
Процессы организации отличаются большим разнообразием и носят выра-
женный приспособительный характер. Основными из них являются: 1) зажи-
вление ран; 2) замещение участка омертвения или тромботических масс со-
единительной тканью; 3) инкапсуляция.
1.Заживление ран в коже и других органах протекает по одному ти-
пу, причем темпы заживления, его исходы зависят от степени и глубины ране-
вого повреждения, структурных особенностей органа, общего состояния орга-
низма, применяемых методов лечения. По И. В. Давыдовскому, выделяют
следующие виды заживления ран: 1) непосредственное закрытие дефекта эпи-
телиального покрова; 2) заживление под струпом; 3) заживление раны пер-
вичным натяжением; 4) заживление раны вторичным натяжением, или зажи-
вление раны через нагноение.
Первый вид — это простейшее заживление, наблюдаемое на роговице,
слизистых оболочках. Оно проявляется как бы наползанием эпителия на по-
верхностный дефект и закрытием его сплошным слоем.
Второй вид заживления касается мелких дефектов, на поверхности ко-
торых быстро возникает подсыхающая корочка (струп) из свернувшейся кро-
ви и лимфы. Эпидермис восстанавливается под корочкой, которая отпадает
через 3 — 5 сут после ранения.
Третий в и д — заживление первичным натяжением (per pri-
mamm intentionem). Наблюдается в ранах с повреждением не только кожи, но
и подлежащей ткани. Встречается обычно при заживлении ран, нанесенных
острым ножом, например при хирургических разрезах. В этих случаях края
раны ровные; сама рана заполняется свертками фибрина излившейся крови,
что предохраняет края раны от дегидратации и инфекции. Края раны в тече-
ние первых суток несколько отечны, инфильтрированы нейтрофилами и незер-
нистыми лейкоцитами, эритроцитами. Под влиянием протеолитических фер-
ментов нейтрофилов происходит частичный лизис свертка крови, тканевого
детрита. Нейтрофилы быстро погибают, на смену им приходят макрофаги,
которые фагоцитируют эритроциты, остатки нелизированной ткани; в краях
раны обнаруживается гемосидерин. Часть содержимого раны удаляется само-
стоятельно в первый день ранения вместе с экссудатом или при обработке
раны (первичное очищение). На 2 — 3-й сутки в краях раны появляют-
ся растущие навстречу друг другу фибробласты и новообразованные капил-
ляры, возникают аргирофильные и коллагеновые волокна. Так в ране по-
является грануляционная ткань, пласт которой при первичном
натяжении не достигает больших размеров. К 10— 15-м суткам она полностью
созревает, раневой дефект эпителизируется и рана заживает нежным рубчи-
ком. В хирургической ране заживление первичным натяжением ускоряется
в связи с тем, что ее края стягиваются нитями шелка или кетгута, вокруг ко-
торых скапливаются рассасывающие их гигантские клетки инородных тел, не
мешающие заживлению.
Четвертый вид — заживление вторичным натяжением (per se-
cundam intentionem), заживление через нагноение (или заживление по-
средством гранулирования — per granulationem). Наблюдается обычно при об-
ширных ранениях, сопровождающихся размозжением и омертвением тканей,
проникновении в рану инородных тел, разнообразных микробов. На месте
раны возникают кровоизлияния, травматический отек краев раны,
быстро появляются признаки демаркационного гнойного воспа-
ления на границе с омертвевшей тканью, расплавление некротических масс.
В течение некоторого времени (5 — 6 сут) происходит отторжение некротиче-
ских масс (вторичное очищение раны), и в краях раны начинает раз-
виваться грануляционная ткань. Грануляционная ткань, выполняю-
щая рану, состоит из шести переходящих друг в друга слоев (Н. Н. Аничков):
1) поверхностный лейкоцитарно-некротический слой; 2) поверхностный слой
сосудистых петель; 3) слой вертикальных сосудов; 4) созревающий слой;
5) слой горизонтально расположенных фибробластов; 6) фиброзный слой.
Созревание грануляционной ткани при заживлении раны вторичным натя-
жением сопровождается синтезом фибробластами коллагена, который на-
чинается с 5 —7-х суток после нанесения раны в исходе вторичного очищения.
По мере созревания грануляций в них уменьшается число клеток, нарастает
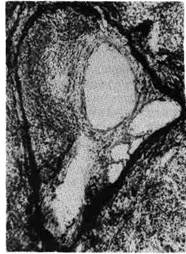
Рис. 120. Рубец в стенке левого желудочка сердца после инфаркта.
Рис. 121. Организация и канализация тромба вены.
количество коллагеновых волокон, уменьшается число сосудов. С поверхно-
сти грануляции покрываются пластом регенерирующего эпидермиса. При за-
живлении раны путем вторичного натяжения всегда образуется плотный
рубец.
2. Замещение участка омертвения или тромботиче-
ских масс соединительной тканью (собственно организация)
происходит в том случае, когда массы подвергаются рассасыванию и одно-
временно в них врастает молодая соединительная ткань, превращающаяся за-
тем в рубцовую (рис. 120, 121).
3. Об инкапсуляции говорят в тех случаях, когда омертвевшие массы,
животные паразиты, инородные тела не рассасываются, а обрастают соедини-
тельной тканью и отграничиваются от остальной части органа капсулой.
Массы некроза пропитываются известью, возникают петрификаты. Иног-
да во внутренних слоях капсулы путем
метаплазии происходит образование
кости (рис. 122). Вокруг инородных
тел и животных паразитов в грануля-
ционной ткани могут образовываться
многоядерные гигантские клетки (г и-
гантские клетки инородных
тел), которые способны фагоцитиро-
вать инородные тела и постепенно
рассасывать их (см. «Продуктивное
воспаление»).
Рис. 122. Инкапсуляция очага казеозного некро-
за с образованием кости.
ОПУХОЛИ
ОБЩИЕ СВЕДЕНИЯ
Опухоль, новообразование, бластома (от греч. blasto — ро-
сток) — патологический процесс, характеризующийся безудержным размноже-
нием клеток. По своей сущности размножение клеток опухоли резко отли-
чается от всех видов роста и размножения клеток, которые наблюдаются при
других патологических процессах. Так, например, размножение клеток встре-
чается при продуктивном воспалении, регенерации, гиперплазии, заживлении
ран, организации, инкапсуляции и других процессах. Во всех этих случаях раз-
множение клеток происходит под влиянием разнообразных регуляторных си-
стем организма. Оно заканчивается созреванием и дифференцировкой клеток
и имеет компенсаторно-приспособительный характер. Размножение клеток
при опухоли не подчиняется регуляторным влияниям организма. Авто-
номный, или бесконтрольный, рост — первое из основных
свойств опухоли.
Клетки опухоли под влиянием ряда факторов, еще полностью не выяс-
ненных, приобретают особые свойства, которые отличают их от нормальных
клеток. Атипизм клетки, который касается ее структуры, обмена, функ-
ции, размножения и дифференцировки,— второе важное свойство опухоли.
Приобретение опухолевой клеткой новых, не присущих нормальной клетке,
свойств получило название анаплазии (от греч. ana — обратно и plasis —
образование) или катаплазии (от греч. kata — вниз и plasis — образование).
Термины «анаплазия» и «катаплазия» неоднозначны. При анаплазии происходит дедиффе-
ренцировка клеток, приобретение ими эмбриональных свойств. В последние годы это понятие
подвергается критике, так как установлены достаточно высокая ультраструктурная организация
опухолевых клеток и способность их к специфической дифференцировке. Термин «катаплазия»
отражает приобретение опухолевой клеткой лишь особых свойств, он более принят в современ-
ной литературе.
Принято выделять морфологический, биохимический, ги-
стохимический и антигенный атипизм опухолевой клетки.
Опухоль может возникать в любой ткани и органе, наблюдается не только
у человека, но и у многих животных и растений.
Данные эпидемиологии онкологических заболеваний свидетель-
ствуют о различной частоте заболеваемости и смертности от злокачественных
опухолей в разных странах. Показана зависимость возникновения опухолей от
природных, биологических факторов, условий социальной среды, уклада жиз-
ни, бытовых привычек определенных групп населения. По данным ВОЗ, до
90% опухолей связано с воздействием внешних факторов.
По данным статистики, число больных раком и умерших от него рас-
тет во всех странах мира. Это объясняют улучшением диагностики заболева-
ний, налаженной системой регистрации больных злокачественными новообра-
зованиями, относительным увеличением в составе населения лиц пожилого
и старческого возраста.
Дата добавления: 2015-11-26 | Просмотры: 908 | Нарушение авторских прав
|