 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Преимущества сочетания ЭА с общимобезболиванием включают: • снижение стрессорного метаболического отве • большая стабильность сердечно-сосудистой • уменьшение кровопотери во время операций; • снижение вероятности ТГВГ и ТЭЛА; • меньшая выраженность сдвигов водного балан • эпидуральный компонент позволяет достичь
_> анестезиология и реаниматология ловиях поверхностной общей анестезии со значительным снижением дозы гипнотиков, наркотических анальгетиков и релаксантов. Это приводит к более быстрой реабилитации в ближайшем послеоперационном периоде; • ПЭА обеспечивает адекватную послеопераци • обеспечивая преобладание парасимпатической • сокращение времени пребывания пациентов в Накопленный клинический опыт и данные доказательных исследований позволяют полагать, что в настоящее время вопрос о выборе метода обезболивания при обширных и травматичных хирургических вмешательствах на органах грудной и брюшной полостей должен носить не альтернативный характер - общая или эпидуральная анестезия, а решаться в пользу сочетанного использования общей и регионарной анестезии. Высокая ЭА может быть успешно применена в качестве компонента общего обезболивания и при торакальных операциях (на легких, пищеводе), в том числе и при операциях на открытом сердце при врожденных и приобретенных пороках серд- ца. У пациентов с сопутствующей ИБС высокая блокада (Тщ-Ту) способствует увеличению диаметра стенозированных артерий, улучшает кровообращение в зоне ишемии (без синдрома обкрадывания), снижает потребность миокарда в кислороде. Для того чтобы использовать положительные эффекты центральной нейроаксиальной блокады и снизить вероятность ее побочных эффектов, необходимо ограничить область предполагаемого соматического и вегетативного блока в пределах области планируемого хирургического вмешательства, так как ограничение зоны денервации является важным фактором оптимизации гемодинамичес-ких эффектов ЭА. Селективное положение конца катетера дает возможность использовать гораздо меньшие дозы местного анестетика, особенно когда ЭА выполняется в комбинации с общей анестезией (Прис-Робертс С, 1994). Сравнительная характеристика центральных сегментарных блокад - СА и ЭА - представлена в табл. 2. Комбинация СА и ЭА (КСЭА) делает возможным совместить преимущества обоих методов центральных блокад: короткий латентный период, небольшие дозы анестетика, надежная интраопера-ционная аналгезия (СА) с возможностью послеоперационного обезболивания (ПЭА) при нивелировании их недостатков. КСЭА предложена в 1981 г. (а описана еще раньше - в 1937 г.), но ее внедрение в практику осуществляется очень медленно. Опытом применения этого метода анестезии располагает лишь небольшое число клиницистов, хотя технически методика вполне выполнима, а ее надежность и управляемость существенно расширяют возможности РА (Галлингер Э.Ю. и соавт., 1999).
Сегментарные границы Уровень катетера Объем бупивакаина (мл)
5 6 5 5 4 4 4
Эпидуральная анестезия
• Простота техники выполнения • Высокая надежность анестезии • Короткий латентный период • Минимальные дозы анестетика Недостатки • Меньшая управляемость • Ограничения эффекта по времени Управляемость Возможность селективного обезболивания Возможность продления анестезии Возможность послеоперационного обезболивания •Относительная сложность методики •Длительный латентный период • Надежность анестезии вариабельна, иногда • Большие дозы анестетика
анестезиология и реаниматология Показанием к применению КСЭА являются все вмешательства, при которых нужный уровень блокады для адекватного интраоперационного обезболивания можно обеспечить спинальной пункцией на уровне Ljj -Ьщ, а длительность операции и необходимость послеоперационного обезболивания требуют постановки эпидурального катетера. К таким операциям можно отнести ряд ортопедических, травматологических операций, реконструктивных сосудистых операций на нижних конечностях и брюшной аорте, гинекологические, акушерские и урологические вмешательства. Местные анестетики, используемые для регионарной анестезии. Следует отметить, что, несмотря на значительные успехи фармакологии, достигнутые за последние десятилетия, идеальный препарат для выполнения регионарных блокад (короткий латентный период, прогнозируемая и контролируемая продолжительность действия, отсутствие токсичности) еще не синтезирован. Из всего многочисленного арсенала местных анестетиков коротко остановимся на характеристике лишь тех, которые на сегодняшний день могут быть рекомендованы для клинического применения. Первый амино-амидный анестетик - лидокаин (лигнокаин, ксилокаин), синтезированный еще в 1943 г., по-прежнему удерживает свои позиции в регионарном обезболивании и является своего рода стандартом, с которым сравнивают остальные анестетики. Лидокаин обладает относительно непродолжительным обезболивающим эффектом, средней силой действия и токсичностью. Он широко применяется для периферических блоков и ЭА. Короткая продолжительность действия при ЭА нивелируется возможностью повторных инъекций, а при периферических блокадах делает его препаратом выбора в хирургии стационара одного дня. Лидокаин не может быть рекомендован для выполнения СА (хотя это практикуется довольно часто). Дело в том, что коммерческий препарат лидо-каина (5% раствор на 7,5% декстрозе), интенсивно применявшийя долгие годы, обладает прямым ней-ротоксическим эффектом, вызывая развитие синдрома «конского хвоста». Рекомендации разведения его до 2,5-3% концентрации - не оправданы с точки зрения возможности контаминации раствора, а официнальный 2% лидокаин обладает кратковременным эффектом и не предназначен для интрате-кального введения Бупивакаин (маркаин, анекаин, карбостезин) -амино-амидный препарат— является мощным анестетиком длительного действия. Со времени появления лидокаина именно бупивакаин оказал наибольшее влияние на развитие регионарной анестезии. Он явился первым местным анестетиком, в котором сочетается быстрое начало, сила и продолжительность действия. Бупивакаин используют для всех видов регионарной анестезии - периферических и центральных сегментарных блоков. Уникальным свойством бупивакаина является его способность вызывать различный нервный блок в зависимости от концентрации при выполнении ЭА и проводниковой блокады. Бупивакаин в несколько раз токсичнее лидокаина, но его сила и большая продолжительность действия снижают потребность в повторных дозах, так что риск кумулятивной токсичности не велик. Опасность представляет случайное внутрисосудистое введение препарата вследствие его кардиотоксичности. При выполнении СА маркаин, используемый в виде изо- и гипербарического растворов, обладает минимальной локальной токсичностью и на сегодняшний день является препаратом выбора. Ультракаин (артикаин), основу которого составляет тиофеновое кольцо, относится к новому классу местных анестетиков. Он является препаратом с коротким, как у лидокаина, латентным периодом, достаточно продолжительным действием, сравнимым с бупивакаином. Так же как и бупивакаин, ультракаин может быть применен для всех видов регионарной анестезии. Синтез и внедрение в клиническую практику нового амино-амидного местного анестетика ропи-вакаина (наропина) представляют значительное достижение в регионарном обезболивании. Ропи-вакаин обладает рядом уникальных свойств. Основное преимущество ропивакаина по сравнению с бупивакаином - значительно меньшая кардио- и нейротоксичность при той же силе действия. Ропи-вакаин применяют для проводниковой (блокада стволов и сплетений) и эпидуральной анестезии. В сравнении с бупивакаином он вызывает более быстрый и глубокий сенсорный блок периферических нервов и меньшую степень моторной блокады. При ЭА ропивакаин обладает еще большей дифференциацией в отношении моторного и сенсорного блоков, чем бупивакаин. В высоких дозах и концентрациях анестетик обеспечивает продолжительную глубину и моторного и сенсорного блоков, в низких концентрациях вызывает преимущественно сенсорную блокаду при минимальной степени или полном отсутствии моторного блока. Сочетание большой анестезирующей активности, низкой системной токсичности и способности вызывать дифференцированную блокаду делают ропивакаин препаратом выбора в акушерской практике и для ПЭА в хирургии. Сообщения об интратекальном введении наропина в клинических условиях единичны. Опыт применения наропина для субарахноидальной анестезии при флебохирургических вмешательствах позволяет дать этому препарату высокую оценку. Наропин вызывает эффективный спинальный блок с преобладанием сенсорного компонента. Длительность блока и степень его дифференциро-ванности зависят от концентрации препарата. Таким образом, современный арсенал местных анестетиков позволяет анестезиологу решать разнообразные клинические задачи, связанные с обеспечением всех видов регионарной анестезии. Противопоказания к выполнению центральных сегментарных блокад могут носить абсолютный и относительный характер. К абсолютным противопоказаниям следует отнести: отказ больного; сепсис; инфекция кожи и мягких тканей в непосредственной близости от места пункции; коагулопатия с развитием геморрагического сидрома; лечение прямыми или непрямыми антикоагулянтами; аллергия к местным анестетикам амидной группы; A-V блокады III степени; повышенное внутричерепное давление; некорригированная выраженная гиповолемия (по- анестезиология и реаниматология
Относительные противопоказания включают: периферические нейропатии; демиелини-зирующие заболевания ЦНС; отсутствие контакта с больным (психоз или деменция); предшествующие операции на позвоночнике, боковой спондилез, выражений деформирующий остеохондроз позвоночника, дискогенные травмы (для СА и ЭА); некоторые заболевания сердца с фиксированным сердечным выбросом (идиопатический гипертрофический субаортальный стеноз, тяжелый аортальный стеноз). В этих случаях нарушены кардиаль-ные механизмы компенсации вазодилатации (для СА и ЭА). Применение профилактических доз низкомолекулярных (НМГ) и нефракционирован-ных (НФГ) гепаринов. Выполнение регионарной блокады (особенно это касается СА и ЭА, так как существует вероятность развития спинальной гематомы) допустимо через 10—12 ч после начальной профилактической дозы НМГ и через 3-4 чпосле НФГ; эпидуральный катетер необходимо удалять за 2—3 ч до введения следующей дозы; если катетер остается для послеоперационного обезболивания, его последующее удаление производят через 10-12 ч после последней дозы НМГ, через 3-4 ч после НФГ и за 2 ч до следующей инъекции этих препаратов. При сложной и травматичной пункции спинального или эпидурального пространства применение антикоагулянтов следует отложить. Осложнения регионарной анестезии Не существует полностью безопасных методов анестезии, и регионарная не является исключением. Многие из осложнений (особенно тяжелых, наблюдаемых при выполнении центральных блокад) относятся к периоду освоения и внедрения РА в клиническую практику. Эти осложнения были связаны с недостаточной технической оснащенностью, недостаточной квалификацией анестезиологов, использованием токсичных анестетиков. Тем не менее риск осложнений существует. Остановимся на наиболее значимых из них. 1. В силу механизма действия центральной сегментарной блокады артериальная гипотензия является ее неотъемлемым и предвиденным компонентом. Степень выраженности гипотонии определяется уровнем анестезии и выполнением ряда профилактических мероприяний. Блокада преган-глионарных симпатических волокон, проходящих в составе передних корешков, при СА приводит к расширению артериол и венул, небольшому снижению ОПС, венозного возврата и соответственно сердечного выброса. Чем выше блок, тем нарушения гемодинамики более выражены. Верхняя граница спинального блока определяется рядом факторов: объемом анестетика, его концентрацией, относительной плотностью, скоростью введения, положением пациента и его ростом, уровнем внутри-брюшного давления и уровнем пункции. Неконтролируемое распространение симпатического блока выше Tjy сопряжено с более выраженными гемодинамическими нарушениями. Такое осложнение возникает при попытке расширить зону сегментарного блока, используя технику барботажа, большие дозы изобарического раствора, придав больному положение Фовлера, или гипербаричес- кого - в положении Тренделенбурга. Наш клинический опыт позволяет считать неоправданным стремление достичь высокого уровня СА при операциях на верхнем этаже брюшной полости изменением положения тела пациента и увеличением объемов анестетика. Наше мнение полностью совпадает с позицией других специалистов (Светлов В А и соавт., 1999). Медленное введение местного анестетика в минимальных или средних дозах на фоне адекватной превентивной волемической нагрузки не вызывает существенных изменений гемодинамики при СА. Развитие гипотензии (снижение артериального давления больше чем на 30%) встречается у 9 % оперированных в условиях ЭА Она чаще возникает у пациентов со сниженными компенсаторными возможностями сердечно-сосудистой системы (пожилой и старческий возраст, интоксикация, исходная гиповолемия, некоторые заболевания сердца с фиксированным минутным объемом), обусловлена недооценкой клинической ситуации и относительной передозировкой местного анестетика, в результате чего наступает блокада более 10 сегментов. Коррекция гипотензии как при СА, так и ЭА заключается в адекватной инфузионной терапии и рациональном использовании симпатомиметиков. 2. Весьма опасным осложнением центральной РА 3. Послеоперационные неврологические анестезиология и реаниматология При длительной моторной блокаде после ЭА уместно выполнение компьютерной томографии для исключения эпидуральной гематомы; при ее выявлении необходима хирургическая декомпрессия. Синдром "конского хвоста" связан с травмой элементов "конского хвоста" или корешков спинного мозга во время спинальной пункции. При появлении парестезии во время введения иглы небхо-димо изменить ее положение и добиться их исчезновения. Межостистый лигаментоз связан с травматичными повторными пункциями и проявляется болями по ходу позвоночного столба; специального лечения не требует, самостоятельно разрешается к 5-7-му дню. Назначение нестероидных противовоспалительных препаратов ускоряет процесс реабилитации. Менее серьезным неврологическим осложнением может быть задержка мочи, связанная с атонией мочевого пузыря и угнетением рефлекса мочеиспускания. Она возникает чаще у мужчин и может сопровождаться изменениями гемодинамики как следствие раздражения брюшины. Головная боль после спинальной анестезии, описанная еще A. Bier, возникает, по данным разных авторов, с частотой от 1 до 1 5%. Она встречается у молодых чаще, чем у пожилых, а у женщин чаще, чем у мужчин. Это не опасное, но субъективно чрезвычайно неприятное осложнение. Головная боль возникает через 6-48 ч (иногда отсроченно через 3-5 дней) после субарахноидальной пункции и продолжается без лечения 3-7 дней. Это осложнение связано с медленной «утечкой» спинальной жидкости через пункционное отверстие в твердой мозговой оболочке, что ведет к уменьшению объема спинальной жидкости и смещению вниз структур ЦНС. Цефалгия носит постуральный характер, она возникает (или усиливается) в вертикальном положении, имеет пульсирующий характер, локализуется в лобной области и может сопровождаться тошнотой и рвотой. Лечение заключается в инфузионной терапии кристаллоидами с кофеином и энтеральной гидратации. Введение жидкости необходимо для увеличения продукции спинальной жидкости, а кофеин устраняет рефлекторную дилатацию сосудов головного мозга, обусловленную потерей жидкости. При неэффективности этого лечения и выраженном болевом синдроме рекомендуют экстрадуральное пломбирование ау-токровью; к счастью, необходимость в этом возникает крайне редко. Основным фактором, который влияет на развитие постпункционных головных болей, является размер пункционной иглы и характер заточки. Использование тонких игл специальной заточки типа «pencil-point» снижает остроту проблемы и сводит к минимуму «столетнюю проблему постпункционных головных болей» (Шифман Е.М., 1999). Головная боль после ЭА связана с техническими погрешностями - непреднамеренной пункцией твердой мозговой оболочки иглой Туохи, которая значительно толще по диаметру, чем иглы для СА. Тактика лечения идентична с ведением больных после СА. Не исключены (хотя встречаются достаточно редко) и осложнения и при выполнении стволовой анестезии и блокады сплетений. К ним относятся аллергические реакции, токсическое действие местного анестетика, связанное с его передозировкой или случайным внутрисосудистым введением, возникновение гематомы, травма нервного ствола с последующим развитием невропатий, пневмоторакс - при анестезии плечевого сплетения надключичным доступом и даже тотальный спинальный блок — при глубокой блокаде шейного сплетения. Необходимо подчеркнуть, что основным условием минимизации осложнений РА является высокая квалификация специалиста и строжайшее соблюдение всех правил выполнения РА. Эти правила включают: • строгое соблюдение хирургического принципа • неуклонное соблюдение правил асептики и ан • использование только одноразовых наборов; • введение спинальной иглы только через интро- • использование местных анестетиков с мини • использование только официнальных раство • строгое следование разработанным протоко Разумеется, выполнение любого метода РА допустимо лишь в операционных с обязательным мони-торным контролем функционального состояния пациента и соблюдением всех правил безопасности, принятых в современной клинической анестезиологии. Только соблюдение этих принципов дает возможность подтвердить оценку РА, высказанную одним из ее апологетов приват-доцентом Л.А. Андреевым еще в 1928 г.: «Наиболее совершенным методом анестезии, несомненно, является регионарная анестезия. Ей принадлежит будущее». Литература 1. Галлингер Э.Ю., Селезнев М.Н.,Бабалян Г.В.Золичева Н.Ю., Крю 2. Гилева М.Н. Проводниковая анестезия. Харьков: РИП «Ориги 3. Козлов СП., Светлов В.А., Лукьянов М.В. Фармакология местных 4. Корниенко А.Н., Иванченко В.И., Киртаев А.Г., Кузнецов И.В. Кли 5. Корячкин В.А., Страшнов В.И. Спинномозговая и эпидуральная 6. Морган Д.Э., Михаил М.С Клиническая анестезиология. Перевод 7. Овечкин А.М. Станет ли XXI век эрой регионарной анестезии? 8. Пащук А.Ю. Регионарное обезболивание,- М.: Медицина, 1987.— 9. Прис-Робертс С. Комбинированная общая и эпидуральная ане анестезиология и реаниматология гельск, 1994- С.96-103. 10. Савельев B.C., Гологорский В.А., Кириенко А.И., Гельфанд Б.Р. 11. Светлов В А, Козлов СП. Регионарная (проводниковая) анесте 12. Светлов В.А., Козлов СП., Ващинская Т.В. Субарахноидальная анестезия: пределы возможностей // Анестезиология и реаниматология.- 1999.- №5.- С. 38-44. 13- Шаак В.А., Андреев Л.А. Местное обезболивание в хирургии.-СПб, 1928,- 303 с. 14. Шифман Е.М. Сто лет головной боли // Учебное пособие для врачей курсантов.- Петрозаводск, 1999.- 66 с.
П.А. Кириенко, А.Н. Мартынов, Б.Р. Гельфанд
АбуАли ибн Сына «Канон врачебной науки».
наши дни существенно возрос интерес к проблеме послеоперационной боли и обезболивания. Связано это не только с появлением новых эффективных средств и методов аналгезии, но и с расширением наших знаний о механизмах боли и роли полноценного обезболивания в послеоперационной реабилитации больных. Боль является чрезвычайно сложным ощущением, которое трудно с точностью и объективностью определить, а тем более измерить. Она определяется как сенсорное восприятие стимуляции афферентных но-цицептивных рецепторов, которое вовлекает аффективный компонент. Эмоциональный компонент может варьировать в зависимости от психологического состояния пациента. Международная ассоциация изучения боли определяет боль как «неприятное ощущение и эмоциональное переживание, сочетанное с имеющимся или возможным повреждением ткани или же описываемое в терминах такого повреждения». Хирургическое вмешательство приводит к двухфазной болевой стимуляции. Во-первых, во время операции возникает травма тканей, а следовательно, генерируется большое количество болевых входящих ноци-цептивных импульсов. Во-вторых, после операции воспалительный процесс в поврежденных тканях также приводит к возникновению входящих болевых импульсов. Оба этих процесса, которые происходят во время операции и после нее, приводят к сенситизации путей проведения боли. Это происходит как на периферическом уровне, где сопровождается снижением порога чувствительности ноцицепторов под действием воспалительных медиаторов, таких как калий, серо-тонин, брадикинин, субстанция Р, гистамин, продукты циклооксигеназного и липоксигеназного путей метаболизма арахидоновой кислоты, так и на центральном уровне, где приводит к увеличению возбудимости спи-нальных нейронов, участвующих в проведении болевых импульсов. Центральная сенситизация приводит к нарастанию активности нейронов спинного мозга. Отмечается расширение размеров обслуживаемого рецепторного поля таким образом, что спинальный нейрон начинает отвечать на ноцицептивные стимулы, которые в обычных условиях находились бы вне зоны его компетенции. Наблюдается увеличение интенсивности и продолжительности ответа на раздражители, превышающие по силе пороговые величины. Отмечается снижение порога возбудимости. Это приводит к тому, что раздражители, которые в нормальных условиях не воспринимаются как болевые, активируют нейроны, проводящие обычно ноцицептивную информацию. Указанные изменения проявляются гипералгезией и увеличением размера зоны чувствительности вокруг раны или места повреждения. Сами по себе болевые ощущения после операции составляют лишь часть проблемы, в то же время являясь первопричиной развития патологического послеоперационного синдромокомплекса, способствующего развитию осложнений. Острая боль повышает ригидность дыхательных мышц грудной клетки и брюшной стенки, что приводит к уменьшению дыхательного объема, жизненной емкости легких, функциональной остаточной емкости и альвеолярной вентиляции. Следствием этого являются коллапс альвеол, гипоксе-мия и снижение оксигенации крови. Болевой синдром затрудняет откашливание, нарушает эвакуацию бронхиального секрета, что способствует ателектазирова-нию и готовит условия для развития легочной инфекции. Боль сопровождается гиперактивностью симпатической нервной системы, что проявляется такими клиническими симптомами, как тахикардия, артериальная гипертензия, повышение сосудистого сопротивления. У лиц без сопутствующей патологии сердечный выброс обычно увеличивается, но при дисфункции левого желудочка может снижаться. Кроме того, симпатическая активация является одним из факторов, вызывающих послеоперационную гиперкоагуляцию за счет повышения адгезивности тромбоцитов и угнетения фибринолиза, и, следовательно, повышает риск тромбообразования. На этом фоне у пациентов с высоким риском кардиальных осложнений, особенно страдающих недостаточностью коронарного кровообращения, высока вероятность резкого увеличения потребности миокарда в кислороде с развитием острого инфаркта миокарда. По мере развития ишемии дальнейшее увеличение частоты сердечных сокращений и повышение артериального давления увеличивают несоответствие между доставкой кислорода к миокарду и потребностью в нем, что расширяет зону ишемии. анестезиология и реаниматология
Интенсивная боль является одним из факторов реализации катаболического гормонального ответа на травму: концентрация катехоламинов, кортизола, глюкагона повышается, а инсулина и тестостерона снижается. Развиваются отрицательный азотистый баланс, гипергликемия и повышенный липолиз. Повышение концентрации кортизола в сочетании с увеличением уровня ренина, альдостерона, ангиотензи-на и антидиуретического гормона вызывает задержку натрия, воды и вторичное увеличение объема внеклеточного пространства. Отрицательный азотистый баланс в послеоперационном периоде нарастает за счет гиподинамии, отсутствия аппетита и нарушения нормального режима питания. Невозможность ранней мобилизации пациентов на фоне неадекватной аналгезии повышает риск развития венозных тромбозов и тромбоэмболии легочной артерии. Операционный стресс приводит к лейкоцитозу и лимфопении, угнетает ретикулоэндотелиаль-ную систему. Отмечается также существенное ухудшение иммунного статуса и повышение частоты септических осложнений послеоперационного периода при неадекватном купировании болевого синдрома, особенно у пациентов группы повышенного риска. Ноцицептивная стимуляция модулирующих систем спинного мозга может привести к расширению ре-цепторных полей и повышению чувствительности больвоспринимающих нейрональных структур спинного мозга. Результатом неадекватного купирования послеоперационной боли может стать формирование хронических послеоперационных нейропатичес-ких болевых синдромов. В частности, от одной до двух третей пациентов, перенесших операции на грудной клетке, в течение длительного времени страдают от постторакотомических болей. Частота развития хронических болевых синдромов зависит от интенсивности боли в раннем посленаркозном периоде и адекватности аналгезии в течение первой неделе после операции. Стойкие болевые синдромы после операций развиваются чаще, чем это принято считать. В ходе проведенного в 1990 г. в Великобритании масштабного мультицентрового исследования выявлено следующее: адекватность аналгезии, по субъективным оценкам пациентов, не превышала 50%. Эти неутешительные данные способствовали появлению в последние годы большого количества работ, посвященных изучению механизмов послеоперационной боли и сенситизации, разработке новых методик аналгезии, оптимизации организационных подходов к ведению больных в послеоперационном периоде, поиску новых эффективных аналгетиков, изучению влияния адекватности обезболивания на исход. Рис. 1. Шкалы оценки интенсивности боли. шво 0 12 3
ВАШ
Наиболее часто применяют визуально-аналоговую шкалу интенсивности боли (ВАШ) от 0 до 10 баллов в виде линии длиной 10 см, над которой графически отражена степень болевых ощущений. Эту шкалу предъявляют пациенту, и он сам отмечает на ней степень своих болевых ощущений. Подобные шкалы необходимы для количественной характеристики динамики интенсивности болевого синдрома в процессе лечения. Данные ВАШ в покое не позволяют судить о том, насколько хорошо пациент благодаря проводимой аналгезии может двигаться и откашливать мокроту. Поэтому ряд исследователей признают более важным тестировать пациентов с помощью ВАШ при движении и откашливании. Эффективным обезболивание можно считать при наличии оценки по ВАШ при откашливании 3 балла и ниже. При таких значениях ВАШ пациенты в состоянии двигаться, довольно глубоко дышать и эффективно откашливаться, что снижает риск развития легочных и тромботических осложнений. У пациентов отделений реанимации и интенсивной терапии, которым проводится искусственная вентиляция легких и седация, оценка интенсивности болевого синдрома с помощью визуально-аналоговых шкал затруднена. По данным SUPPORT (the Study to Understand Prognoses and Preferences for Outcomes and Risks of Treatment), боль испытывают около 50% пациентов в критическом состоянии, и 1 5% описывают ее как очень интенсивную. В то же время изменения физиологических показателей (частота сердечных сокращений, артериальное давление, частота дыхания, потоотделение, размер зрачка) в ответ на боль в условиях блока интенсивной терапии не являются специфичными. Оценивать интенсивность боли у этих больных необходимо для назначения адекватных доз анальгетиков, так как известно, что оптимальное обезболивание может положительно влиять на исход заболевания. Рядом исследователей предложена поведенческая шкала боли (Behavioral Pain Scale, BPS), оценка по которой может быть произведена в ходе наблюдения за больными. Интенсивность болевого синдрома у пациентов на искусственной вентиляции легких, кото- анестезиология и реаниматология рым проводится седация, оценивается по состоянию мимической мускулатуры, движениям верхних конечностей, синхронности с аппаратом ИВЛ. Исследования показали, что, используя BPS, можно достоверно оценить выраженность боли даже у этого контингента больных. Невозможно в краткой лекции описать все способы послеоперационной аналгезии, однако их можно сгруппировать следующим образом для удобства восприятия и последующего изложения: 1. Использование опиоидов для послеопераци • традиционное внутримышечное введение; • внутривенное введение (болюс, инфузия, кон • непарентеральное введение опиоидов (щеч 2. Методы регионарной аналгезии (с использова • эпидуральная; • другие (внутриплевральная, паравертебраль- 3. Применение нестероидных противовоспали • внутримышечное; • внутривенное; • пероральное; • ректальное. 4. Применение о^-адренергических агонистов: • системное; • эпидуральное.
5. Использование ингибиторов протеаз. 6. Вспомогательные лекарственные средства:
• бензодиазепины; • кофеин; • декстроамфетамин; • дифенин; • карбамазепин; • фенотиазины; • бутирофеноны. 7. Нефармакологические методы: • криотерапия; • чрескожная электростимуляция нервов; • психологические методы. Исторически сложилось так, что очень широко, вплоть до настоящего времени, для послеоперационной аналгезии использовали опиоиды. Ниже приведены наркотические аналгетики, применяемые в настоящее время для послеоперационного обезболивания (табл. 1). Морфин применяется обычно в дозе 10 мг внутримышечно, действие его продолжается 3-5 ч. Высшая доза для взрослых: разовая 0,02 г, суточная 0,05 г. Наиболее важными побочными эффектами являются угнетение дыхания, тошнота и рвота. Хотя морфин имеет ряд нежелательных побочных эффектов, он является отличным аналгетиком и принят в качестве "золотого стандарта", в сравнении с которым оценивается действие всех остальных опиоидов. Промедол (тримеперидин) применяется обычно в дозе 20 мг, что вызывает 3-4-часовую аналгезию. По аналгетической активности он несколько слабее морфина, но значительно менее токсичен, в меньшей степени угнетает дыхательный центр, реже вызывает рвоту. Омнопон (пантопон) представляет собой смесь гидрохлоридов алкалоидов опия, где на долю морфина приходится около 50%, применяется в дозе 20 мг. Высшая доза для взрослых: разовая - 0,03 г, суточная - 0,1 г. Обладает меньшей аналгетической активностью, чем морфин и промедол, что обусловливает его меньшую популярность. Бупренорфина гидрохлорид - один из популярных препаратов для послеоперационного обезболивания за рубежом. Относится к частичным агонистам ц-опиоидных рецепторов, одновременно являясь антагонистом к-опиоидных рецепторов. Бупренорфин по аналгетической активности превосходит морфин в 30-40 раз, его разовая доза составляет при внутримышечном и внутривенном введении 0,3-0,6 мг, при сублингвальном - 0,2-0,4 мг. Важное преимущество препарата - возможность его применения в различных формах - внутримышечное, внутривенное, суб-лингвальное, а также в форме назального спрея. Длительность действия препарата 6-8 ч. Отличительная особенность бупренорфина - его высокое сродство к ц-опиоидным рецепторам, вследствие чего депрессия дыхания, вызванная бупренорфином, лишь частично устраняется высокими дозами конкурентного антагониста налоксона. Трамадола гидрохлорид (тралюл) - аналгетик, опосредующий обезболивающий эффект как через ц-опиоидные рецепторы, так и путем ингибирования норадренергического и серотонинергического механизма передачи болевой импульсации. Большое преимущество препарата - наличие значительного количества лекарственных форм (ампулированная, таблетированная, капсулы, капли, свечи). Внутривенно и внутримышечно трамадол применяется обычно в дозе 100 мг. Буторфанола тартрат (стадол) - агонист-антагонист - синтетический аналгетик класса налор-фин-циклазоцина. Для внутривенного и внутримышечного введения применяется в дозе 2 мг; продолжительность действия 3-4 ч. Аналгетическая активность препарата в 5-7 раз выше морфина. Аналгети-ческий эффект буторфанола опосредуется путем взаимодействия с к-опиоидными рецепторами, поэтому препарат оказывает незначительное депрессивное влияние на функцию дыхания. К положительным сторонам препарата относятся: низкий наркогенный потенциал, отсутствие влияния на моторику желудочно-кишечного тракта и тонус сфинктеров, к отрицательным - неблагоприятное воздействие на гемодинамику (увеличение СИ, ДЛА, ЛСС) и вероятность развития дисфории.
Гидроморфон Метадон Леворфанол Фентанил Оксиморфон Меперидин Бупренорфин Буторфанол
анестезиология и реаниматология Налбуфина гидрохлорид (нубаин) - агонист-ан-тагонист опиоидных рецепторов. Агонистическая активность препарата опосредуется через к-опиоид-ные рецепторы. Аналгетическая активность налбуфина, по сравнению с морфином составляет 0,5-1, т.е. 10 мг налбуфина эквивалентны такой же дозе морфина. Налбуфин обладает крайне низкой степенью развития привыкания и минимальным влиянием на гемодинамику. Препарат вызывает незначительное угнетение дыхания, не имеющее клинического значения. Для налбуфина характерно наличие эффекта «потолка» в отношении аналгетической активности и влияния на дыхание - повышение дозы налбуфина не усиливает аналгезию и депрессию дыхания («потолок» составляет около 30 мг/70 кг). Считаем необходимым остановиться более подробно на путях использования этого метода обезболивания. Традиционным является внутримышечное введение опиоидов в послеоперационном периоде. Как правило, для этого используют морфин, промедол (тримеперидин) и омнопон (пантопон). К достоинствам традиционной аналгезии относятся: легкость применения, дешевизна метода, а также постепенное развитие побочных эффектов, что дает больше возможностей борьбы с ними. Вместе с тем эта методика часто приводит к неадекватному обезболиванию (более 60% пациентов отмечают неудовлетворительное качество послеоперационной аналгезии). Причины данного факта кроются в том, что вводятся фиксированные дозы, без учета фармакологической вариабельности; часто инъекции опиоидов производятся с большими перерывами, т.е. тогда, когда уже произошел «прорыв» боли. Немаловажным моментом является также и то, что при внутримышечном пути введения начало обезболивания замедлено. Внутривенное введение опиоидов (болюс, продолжительная инфузия, контролируемое пациентом обезболивание - КПО). Болюсное введение - наиболее быстрый способ достижения аналгезии. Быстрее действуют те препараты, которые более липофильны. Этот метод применяется для аналгезии пациентов, находящихся на ИВЛ в условиях ОИТ. Угнетение дыхания в такой ситуации является не недостатком, а преимуществом. КПО - метод, использующий быстрый аналгети-ческий эффект болюсного введения. Пациент сам определяет скорость внутривенного введения препарата, обеспечивая тем самым контроль с обратной связью. Прибор для КПО включает точный источник инфузии и контролируемое устройство пациент - прибор. Для ограничения устанавливаемой дозы, числа доз, которые могут быть введены, а также интервала между дозами предусмотрено специальное устройство безопасности. Ниже приведены параметры КПО (табл. 2). При КПО устранение боли обеспечивается лучше, чем при обычном методе периодического внутримышечного введении аналгетика. Трансдермальное применение - фентанил, будучи высоколипофильным веществом, легко проникает через кожу. Наклейки с фентанилом позволяют поддерживать постоянную концентрацию препарата в крови с помощью системы, которую заменяют каждые 3 сут. Трансдермальная система высвобождает препарат со скоростью 25 мкг/ч. Максимальный болеутоляющий эффект после наложения наклейки развивается в течение 24-72 ч. Ввиду широкой фармакологической вариабельности такого пути у разных пациентов этот метод малопригоден для контроля острой боли. Метод более применим для устранения хронической боли при злокачественных заболеваниях в терминальной стадии. Ректальное введение опиоидов - этот путь введения широко не применяется. Из прямой кишки опиоиды быстро всасываются и попадают в систему нижней полой вены, а затем, минуя печень, в системный кровоток. Однако при этом отмечается значительная вариабельность достигаемой плазменной концентрации препарата. Считается, что лучшим показанием к ректальному введению опиоидов служит трудно контролируемая хроническая боль, сопровождающаяся дисфагией. Сублингвальное применение бупренорфина позволяет достичь хорошего уровня аналгезии. Сочетание этого метода с введением агонистов опиоидных рецепторов может привести к развитию дисфории и возобновлению болевого синдрома; так что при выборе этого способа аналгезии важно использование бупренорфина в качестве единственного опиоида в период подготовки и проведения операции, а также в послеоперационном периоде. В последнее время уделяется большое внимание использованию регионарного обезболивания, не
Препарат
гидроморфон меперидин
Доза по требованию, мл Интервал блокировки, мин Скорость постоянной инфузии, мл/ч днем ночью Предельная доза за 1 ч, мл Нагрузочная доза (каждые 5 мин до состояния комфорта), мг Максимальная нагрузочная доза, мг 1 1 6 0,5 < 12 10-15 0,5 0,5 10 0,5 <6 0,5 2-4 10 1 6 0,5 < 10 75-150
анестезиология и реаниматология только как метода интраоперационной защиты пациента, но и как способа адекватной аналгезии в послеоперационном периоде. Самый распространенный метод послеоперационной регионарной аналгезии — эпидуральная блокада. Длительная эпидуральная аналгезия является эффективным методом купирования послеоперационной острой боли с низким риском развития побочных эффектов и высокой степенью удовлетворенности пациентов качеством обезболивания. Эта методика абсолютно показана у пациентов с высоким риском развития сердечно-легочных осложнений после торакальных, ортопедических, абдоминальных операций. В проведении ДЭА нуждаются от 5 до 1 5% хирургических больных. С появлением местных анестетиков длительного действия стало возможным проведение продленной эпидуральной инфузии, которая обладает определенными преимуществами перед перемежающимися болюсными введениями. К сожалению, продленной эпидуральной инфузии свойственны и недостатки. Если очаги болевой импульсации значительно удалены друг от друга, невозможно провести полноценное обезболивание. Возможно обеспечение аналгезии на протяжении 5—7 дерматомов, в проекции которых находится кончик эпидурального катетера. В зависимости от характера операции предлагаются следующие уровни установки катетеров для эпидуральной аналгезии: • торакальная хирургия Тпц_ущ; • «верхняя» абдоминальная хирургия Thjy-Lj; • «нижняя» абдоминальная хирургия Th^—Ljjj; • хирургия нижних конечностей ТЬ^и—Ljjj. Thy и выше может оказывать существенное влияние на функционирование жизненно важных систем органов (дыхательная и сердечно-сосудистая). В настоящее время в клинических условиях для эпидурального обезболивания используются следующие группы препаратов: 1) местные анестетики (угнетают аксональную и 2) адренергические агонисты (тормозят переда 3) опиоидные агонисты, действуя на пресинапти- Местные анестетики, такие как лидокаин и бупи-вакаин высокоэффективны для достижения и поддержания адекватной аналгезии. Применение лидо-каина ограничено коротким периодом действия, высокой вероятностью развития тахифилаксии и появления симптомов общей интоксикации, выраженным моторным блоком. Отличительными особенностями бупивакаина при эпидуральном введении являются большая продолжительность действия и относительно дифференцированное выключение сенсорных волокон при сохранении моторной функции. Это связано с тем, что бупивакаин в малых концентрациях (0,25% и ниже) быстрее блокирует неми- елинизированные С-волокна и лишь в последующем миелинизированные А-волокна. Это специфическое отличие бупивакаина от короткодействующих амидов: лидокаина, прилокаина, мепивакаина, делает его почти идеальным средством для эпидуральной аналгезии в послеоперационном периоде. Тем не менее при инфузионном введении бупивакаина возможно развитие тахифилаксии, которая может проявляться в виде снижения ранее стабильного уровня сегментарной аналгезии, несмотря на постоянную скорость инфузии. Часто повышенный уровень анестетика в плазме наблюдается у пожилых и ослабленных больных. По некоторым данным, постоянная инфузия бупивакаина в концентрации 0,25% и выше может вызвать гипотен-зию, мышечную слабость, сенсорную блокаду, вероятно, связанные с накоплением системного токсического уровня препарата. Постоянная инфузия более низких концентраций бупивакаина обеспечивает достаточно хорошее обезболивание и снижает частоту возникновения побочных эффектов. До недавнего времени бупивакаин считался препаратом выбора для проведения длительной эпидуральной аналгезии в послеоперационном периоде. Между тем была установлена высокая кардиотоксичность бупивакаина, связанная с его высокой липофильностью и высоким сродством к натриевым каналам миокарда. Была также выявлена отрицательная инотропная активность вследствие вмешательства бупивакаина во внутриклеточные токи кальция и негативное действие на синтез АТФ в митохондриях. Бупивакаин угнетает потенциал действия миокардиоцитов, что проявляется удлинением интервала PR и расширением комплекса QRS на ЭКГ. На этом фоне проявляется феномен повторного входа (re - entry) и развивается желудочковая аритмия. Блокада №+-каналов очень стойкая, что существенно снижает эффективность реанимационных мероприятий при желудочковой фибрилляции. Все это послужило стимулом для разработки местного анестетика с меньшей кардио- и нейротоксичностью. К таким препаратам относится ропивакаина гидрохлорид, который является чистым S-энантомером пропилового гомолога бупивакаина, обладает меньшей токсичностью и большей продолжительностью действия, чем правовращающие энантомеры и рацемические смеси, такие как бупивакаин и мепивакаин. Относительная жирорастворимость ропивакаина примерно в 2 раза меньше, чем бупивакаина. В сравнении с бупивакаином ропивакаин вызывает более быстрый и глубокий сенсорный блок периферических нервов, особенно их А-дельта- и С-волокон. В ряде исследований на взрослых пациентах было показано, что при использовании равных концентраций и доз ропивакаин вызывает меньшую моторную блокаду, чем бупивакаин, при одинаковой эффективности аналгезии. Способность ропивакаина вызывать дифференцированный блок определила его клиническое преимущество над бупивакаином для эпидуральной инфузии в послеоперационном периоде. Как и у других анестетиков амидного ряда, у ропивакаина существует прямая зависимость между введенной дозой и величиной пика его концентрации в крови, причем пик концентрации анестетика зависит от общей дозы введенного препарата, но не от объема инъецированного раствора или его концентрации. Согласно исследованиям, ропивакаин в дозе от 675 до 800 мг в течение 72 ч хорошо переносится все- анестезиология и реаниматология ми пациентами без явлений кумуляции и токсических эффектов. В сравнительном экспериментальном исследовании было выявлено, что судорожные дозировки и плазменные концентрации ропивакаина и бупивакаина были схожи. При 2-кратном превышении судорожных дозировок ропивакаин был менее аритмогенен, чем бупивакаин. В рандомизированном двойном слепом исследовании было также проведено сравнение токсичности ропивакаина и бупивакаина у людей: с ропивакаином связано меньше симптомов со стороны ЦНС, чем с бупивакаином, причем пациенты были устойчивы к дозам ропивакаина на 25% больше, чем бупивакаина. Следует сказать, что пока не зарегистрировано ни одного случая аллергической реакции на ропивакаин. Ропивакаин является первым местным анестетиком, который с момента создания рассматривался как препарат выбора для длительной эпидуральной ин-фузии в послеоперационном периоде. Профиль блока, достигаемого при длительной инфузии ропивакаина, отличается четким дифференцированием сенсорной и моторной блокады, а более высокий по сравнению с бупивакаином клиренс делает его безопасным. Проводились сравнительные исследования эффективности ропивакаина 1 мг/мл, 2 мг/мл, 3 мг/мл для непрерывной эпидуральной инфузии после обширных абдоминальных операций со скоростью 10 мл/ч. Ропивакаин в концентрации 2 мг/мл, вводимый со скоростью 8-12 мл/ч, позволяет обеспечить оптимальный баланс между адекватной ана-лгезией и минимальным моторным блоком. Процент пациентов с моторной блокадой > I степени по Bromage в различных исследованиях варьирует от 11 до 50 и значительно возрастает с увеличением скорости инфузии до 12-14 мл/ч, в связи с чем оптимальным считают эпидуральное введение 10 мл 0,2% ропивакаина в час. Интенсивность моторной блокады существенно снижается на протяжении эпидуральной инфузии, и к 21-му часу число пациентов с блокадой > I степени уменьшается до 5% даже при скорости 12 мл/ч. Частота развития моторного блока зависит от уровня размещения эпидурального катетера. Так, она выше при поясничной ЭА (около 50%) и ниже (около 10%) при грудной. С целью улучшения качества послеоперационного обезболивания без увеличения частоты побочных эффектов к местным анестетикам добавляют опиоидные аналгетики. Методики, основанные на введении опиоидов в эпидуральное пространство, широко применяются в США и Австралии и представляют собой либо бо-люсное введение таких препаратов, как морфин, диаморфин, петидин, или продолжающуюся инфу-зию липофильных опиоидов, таких как фентанил и суфентанил (табл. 3). Гидрофильные опиоиды (морфин) при эпиду-ральном введении характеризуются медленным развитием анальгетического эффекта (20—90 мин), но значительной его продолжительностью (до 24 ч). Это обусловлено медленной диффузией опиоидов через твердую мозговую оболочку в спинномозговую жидкость с последующим распространением в краниальном направлении. Таким образом, эпидуральное введение морфина на поясничном уровне способно обеспечить адекватную аналгезию даже после операций на органах грудной клетки. При этом эффективная анальгети-ческая доза составляет 1/5 соответствующей дозы при внутривенном введении. Доказано, что период послеоперационного восстановления (активизация пациента, нормализация аппетита, перевод на амбулаторный режим) существенно короче у больных с послеоперационной ЭА по сравнению с теми, кому внутримышечно вводился морфин "по требованию". Использование липофильных опиоидов (фентанил) требует установки эпидурального катетера соответственно сегментарному уровню повреждения. Хотя болюсное введение опиоидов эпидурально может обеспечить длительную по времени аналгезию со снижением дозы препарата по сравнению с внутримышечным введением опиоидов, качество
в жирах Начало дейст- Продолжитель- Замечания
6-24 В связи с широким распространением в ЦСЖ рекомендован при травматичных операциях, при инъекции в отдаленном сегменте
анестезиология и реаниматология обезболивания значительно не отличается от ана-лгезии в результате контролируемой пациентом внутривенной инфузии анальгетика. Менее чем у 6% пациентов при эпидуральном введении опиоидов наблюдаются тошнота и кожный зуд. Дата добавления: 2015-12-15 | Просмотры: 698 | Нарушение авторских прав |
 Таблица 1. Уровни расположения катетера, сегментарные границы блокады и минимальные объемы бупивакаина при различных оперативных вмешательствах (по С.Прис-Робертс)
Таблица 1. Уровни расположения катетера, сегментарные границы блокады и минимальные объемы бупивакаина при различных оперативных вмешательствах (по С.Прис-Робертс) Вид операции
Вид операции Операции на нижних конечностях Операции на нижних отделах живота Операции на толстом кишечнике, прямой кишке, мочевом пузыре Операции на почках Операции на брюшной аорте Операции в верхних отделах живота Операции на пищеводе Операции на грудной клетке
Операции на нижних конечностях Операции на нижних отделах живота Операции на толстом кишечнике, прямой кишке, мочевом пузыре Операции на почках Операции на брюшной аорте Операции в верхних отделах живота Операции на пищеводе Операции на грудной клетке
 Таблица 2. Сравнительная характеристика центральных блокад
Таблица 2. Сравнительная характеристика центральных блокад Субарахноидальная анестезия
Субарахноидальная анестезия 385
385 следние два противопоказания относятся к центральным сегментарным блокадам).
следние два противопоказания относятся к центральным сегментарным блокадам). Современная идеология и методология послеоперационной аналгезии
Современная идеология и методология послеоперационной аналгезии "Боль растворяет силу и не дает органам совершать их особые действия, так что даже мешает дышащему дышать".
"Боль растворяет силу и не дает органам совершать их особые действия, так что даже мешает дышащему дышать".
 Повышение активности симпатической нервной системы на фоне болевого синдрома приводит к увеличению тонуса сфинктеров и снижению перистальтической активности кишечника и моторики моче-выводящих путей, что вызывает соответственно послеоперационный парез и задержку мочи. Гиперсекреция желудочного сока опасна образованием стрессовых язв, а ее сочетание с угнетением моторики предрасполагает к развитию тяжелых послеоперационных пневмоний. Послеоперационный парез кишечника может замедлить выздоровление и пролонгировать госпитализацию.
Повышение активности симпатической нервной системы на фоне болевого синдрома приводит к увеличению тонуса сфинктеров и снижению перистальтической активности кишечника и моторики моче-выводящих путей, что вызывает соответственно послеоперационный парез и задержку мочи. Гиперсекреция желудочного сока опасна образованием стрессовых язв, а ее сочетание с угнетением моторики предрасполагает к развитию тяжелых послеоперационных пневмоний. Послеоперационный парез кишечника может замедлить выздоровление и пролонгировать госпитализацию.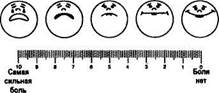
 Оценка интенсивности боли необходима для контроля эффективности обезболивания. В качестве меры эффективности обезболивания применяются шкалы оценки выраженности боли у пациентов в покое (рис.1), а также данные состояния гемодинамики и спирометрических тестов.
Оценка интенсивности боли необходима для контроля эффективности обезболивания. В качестве меры эффективности обезболивания применяются шкалы оценки выраженности боли у пациентов в покое (рис.1), а также данные состояния гемодинамики и спирометрических тестов. Таблица 1. Эквианалгетические дозы опиоидов для парентерального введения
Таблица 1. Эквианалгетические дозы опиоидов для парентерального введения Препарат
Препарат Морфин
Морфин 391
391 Параметры режима*
Параметры режима* морфин
морфин Концентрация, мг/мл
Концентрация, мг/мл *Указанные дозы рассчитаны на пациентов с массой тела 55-70 кг, не принимающих опиоиды; следует корригировать дозы в соответствии с состоянием пациента, опытом приема.
*Указанные дозы рассчитаны на пациентов с массой тела 55-70 кг, не принимающих опиоиды; следует корригировать дозы в соответствии с состоянием пациента, опытом приема. 392
392 Таблица 3. Опиоиды, используемые для эпидурального введения *
Таблица 3. Опиоиды, используемые для эпидурального введения *