 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ГЛАВА 14. ФУНКЦИОНАЛЬНАЯ НЕЙРОХИРУРГИЯК функциональным относят нейрохирургические вмешательства, основная цель которых - нормализовать нарушенную функцию ЦНС, либо прервав пути патологической импульсации, либо стимулируя структуры, тормозящие патологические импульсы. Подробнее вопросы клиники, диагностики и консервативного лечения данной патологии освещены в гл. 23 тома 1. Предметом функциональной нейрохирургии в основном является хирургическое лечение: • насильственных движений (гиперкинезов) и нарушений тонуса мышц - болезни Паркинсона, торсионной дистонии и др.; • хронической боли; • эпилепсии. Методы функциональной нейрохирургии делят на разрушающие и стимулирующие. Исторически первыми были деструктивные методы, применявшиеся для лечения болевых синдромов, экстрапирамидных расстройств и тяжелых форм эпилепсии. Деструктивные стереотаксические методики широко применялись в 1940-1960-е годы у больных с экстрапирамидными формами тремора и торсионной дистонией. Сутью метода было введение в заданную точку мозга - мишень - специальной канюли, кончик которой термически (замораживанием или нагреванием с помощью электрического тока) обеспечивал разрушение ткани мозга в радиусе нескольких миллиметров. Обычно мишенью при экстрапирамидных нарушениях были ядра зрительного бугра и бледный шар. Для точного попадания в мишень использовалась стереотаксическая технология. На голове больного в стандартных точках
фиксировалась специальная рама (стереотаксический аппарат) - рис. 14.1, а; для определения внутренних ориентиров проводилась вентрикулография, и на модели - «фантоме» (рис. 14.1, б) с использованием специального анатомического атласа осуществлялся расчет траектории доступа к мишени. Потом через фрезевое отверстие на заданную глубину по заданной траектории вводилась канюля, осуществлялась электрофизиологическая верификация правильности ее положения (по торможению тремора при динамической поляризации слабым анодным током) и затем - необратимая деструкция. С появлением КТ и МРТ точность метода повысилась, а число осложнений снизилось. Стереотаксические аппараты стали более точными и удобными (рис. 14.2). Однако функциональные результаты деструктивных стереотаксических операций были недостаточно удовлетворительными, в связи с чем появились методы электронейростимуляции. Электронейростимуляция предусматривает введение в структуры-мишени электродов, подсоединенных к расположенному обычно под кожей генератору импульсов с источником питания. Внешние программирующие устройства позволяют изменять ха- рактеристику импульсов с целью обеспечения максимального эффекта (рис. 14.3). Установка стимулирующих электродов в структуры головного мозга осуществляется с помощью стереотаксического метода. К методам функциональной нейрохи-
рургии относят также установку специальных программируемых помп, доставляющих необходимый лекарственный препарат к заданной области ЦНС. Паркинсонизм Болезнь Паркинсона, или идиопатический дрожательньй паралич, поражает около 1% жителей развитых стран в возрасте старше 50 лет. Встречается чаще у мужчин (соотношение - 3/2). Классическая триада симптомов включает в себя тремор, ригидность и брадикинезию. Тремор с частотой 4-7 в секунду наблюдается в покое. Под ригидностью понимают повышение тонуса мышц экстрапирамидного характера с феноменом «зубчатого колеса». Брадикинезия (акинезия), или замедленность движений, состоит в характерных изменениях походки (которая становится «шаркающей», мелкими шажками, с пропульсиями и латеропульсиями, т.е. больной не может остановиться при движении вперед или при поворотах) и скудности мимических реакций - «маскообразное лицо». В зависимости от преобладания в клинической картине тех или иных симптомов выделяют дрожательную, дрожательно-ригидную, брадикинетическую (акинетическую) и акинетико-ригидную формы болезни Паркинсона. Болезнь Паркинсона развивается постепенно-прогредиентно, в течение ряда лет; первыми симптомами обычно бывают брадикинезия и асимметричный тремор. Этиология болезни Паркинсона пока окончательно не установлена. В основе некоторых ее форм лежит генетический дефект (например, в хромосомах 6 или 4), но для четко генетически детерминированных форм болезни Паркинсона характерно раннее начало - в возрасте 40-45 лет или даже в юношеском. В отношении классической болезни Паркинсона выявлена только наследственная предрасположенность - повреждение хромосомы 2 в локусе 2p13. Для развития болезни у носителей данного патологического гена имеют значение особенности питания и образа жизни. Так, болезнь Паркинсона реже развивается у курильщиков (предположительно за счет ингибирования моноаминооксидазы компонентами табачного дыма). Паркинсонизм - синдромологический диагноз, означающий появление симптомов болезни Паркинсона вследствие травматического, ишемического, лекарственного, токсического, инфекционного, опухолевого и других поражений ЦНС. В основе как болезни Паркинсона, так и любой формы паркинсонизма лежит гибель не менее 80% дофаминергических нейронов головного мозга (расположенных преимущественно в области черной субстанции). Снижение содержания дофамина в подкорковых структурах до уровня ниже некоего критического приводит к патологической активации одних и торможению других подкорковых ядер, что проявляется указанными симптомами дисфункции экстрапирамидной системы. Поэтому лечение экстрапирамидных нарушений не зависит от их этиологии, т.е. все формы болезни Паркинсона и паркинсонизма лечатся одинаково. Соответственно в нейрохирургической литературе обычно употребляется 1 термин - паркинсонизм - для всех форм болезни (но у каждого больного при возможности устанавливается этиологический диагноз). Основными в консервативном лечении паркинсонизма являются препараты леводопы - предшественника дофамина, который сам по себе не проникает через гематоэнцефалический барьер. Леводопа в наибольшей степени влияет на брадикинезию, поэтому может сочетаться с М-холиноблокаторами и другими препаратами, а также с агонистами дофаминовых рецепторов - бромокриптином и др. Подробно принципы консервативного лечения паркинсонизма изложены в курсе неврологии. К сожалению, через несколько лет лечения препаратами леводопы их эффективность снижается, дозу и частоту приема препарата приходится увеличивать, при этом могут развиваться достаточно тяжелые медикаментозные дискинезии (неконтролируемые размашистые движения в конечностях, гримасничанье), болезненные мышечные спазмы, галлюцинации, кошмарные сновидения, повышение артериального давления; примерно у 50% больных развивается тяжело переносимый «on-off» феномен (феномен «включениявыключения», когда эффект препарата резко начинается и также резко и не всегда предсказуемо заканчивается). В таких ситуациях необходима консультация нейрохирурга для решения вопроса о возможности оперативного лечения. Показаниями к операции являются: • неэффективность медикаментозного лечения; • выраженные медикаментозные дискинезии; • on-off феномен. Сегодня методом выбора в нейрохирургическом лечении паркинсонизма являются стимуляционные имплантационные методики. Их преимущества перед классическими деструктивными методами заключаются в возможности осуществления двусторонних вмешательств, обратимом характере изменений и меньшей частоте осложнений. Кроме того, со временем клинический эффект как деструктивных, так и стимуляционных методов снижается; современные имплантируемые устройства позволяют путем изменения параметров стимуляции продлить этот период. Недостатком имплантируемых электронейростимуляторов является их высокая стоимость. Механизм действия электростимуляции до конца неясен. Предполагается, что она в определенной степени подавляет патологическую активность нейронов, возникающую при устранении тормозного влияния дофаминергических структур. Наряду с этим под влиянием электростимуляции происходят изменения нейромедиаторного обмена в подкорковых структурах, о чем свидетель-
ствует сохранение клинического эффекта в течение иногда значительного периода после прекращения подачи импульсов. Операция заключается во введении посредством стереотаксического метода в соответствующие подкорковые структуры (субталамическое ядро, бледный шар, вентролатеральное ядро зрительного бугра) специального изолированного (с 1-4 точками контакта) электрода для хронической стимуляции. Электрод фиксируется к черепу, затем соединяется с временным коннектором, который проводится в туннеле под кожей и выводится наружу в стороне от места операции (рис. 14.4). Затем в течение нескольких дней (в среднем - 4-7) проводят электронейростимуляцию с помощью наружного генератора, при этом определяют оптимальные параметры импульсов. В случае достижения стабильного клинического эффекта и соответственно убежденности в корректной установке электрода проводят 2-й этап операции - удаление коннектора, имплантацию стимулятора (обычно - под кожу передней поверхности грудной клетки) и соединение стимулятора с мозговым электродом с помощью постоянного коннектора. Иногда, при использовании комплекса современных методов электрофизиологического контроля, операция проводится в 1 этап. Обычно операцию выполняют на стороне, противоположной стороне максимальных клинических проявлений паркинсонизма. При необходимости следующим этапом может быть произведено аналогичное вмешательство на другой стороне; при двусторонних операциях наиболее безопасной мишенью считается бледный шар. Современные имплантируемые устройства позволяют больному самостоятельно, с помощью внешнего программирующего устройства, изменять параметры стимуляции для обеспечения максимального эффекта. Однако пользование такими устройствами требует сохранности интеллекта; у больных с выраженной деменцией имплантация нейростимулятора не оправдана. Электронейростимуляция приводит к прекращению или значительному уменьшению медикаментозных дискинезий у 90-95% больных и к полному или частичному регрессу других симптомов паркинсонизма в 75-90% случаев. Становится возможным уменьшение дозы леводопы и других препаратов, хотя полная отмена противопаркинсонических средств обычно невозможна. Операция, как правило, позволяет продлить на несколько лет срок относительно удовлетворительного качества жизни больного. Деструкция соответствующих подкорковых структур в настоящее время применяется редко. Мишенями вмешательства являются те же структуры, что и при электронейростимуляции, но чаще всего выполняют вентролатеральную таламотомию. Деструктивные вмешательства обеспечивают практически тот же клинический эффект, что и стимуляционные методы. Производятся они, как правило, на стороне, противоположной наиболее выраженным клиническим проявлениям болезни. Двусторонние вмешательства из-за высокого риска осложнений - нарушений речи, зрения, спутанности сознания и др. - выполняются редко. Следует отметить, что при деструктивных операциях риск осложнений и даже летального исхода существенно выше, чем при использовании метода электронейростимуляции. Нейротрансплантация. Теоретически трансплантация в область черной субстанции вырабатывающих дофамин клеток могла бы стать способом патогенетического лечения паркинсонизма. Изучалась возможность трансплантации фетальных дофаминергических нейронов (экспериментальные работы в Европе и США практически прекращены по этическим соображениям) и собственных клеток мозгового слоя надпочечника больного. Никаких преимуществ перед деструктивными методами при использовании этих технологий при независимом анализе результатов получено не было, специфический эффект нейротрансплантации не зарегистрирован. В клинической практике нейротрансплантация в настоящее время не используется. Ведутся экспериментальные исследования по стимуляции выработки дофамина в подкорковых структурах с помощью генноинженерных технологий. Дата добавления: 2015-12-16 | Просмотры: 1107 | Нарушение авторских прав |
 Рис. 14.1. Стереотаксический аппарат Рихерта-Мундингера; а - рабочая часть, фиксировавшаяся к голове больного; б - фантом, на котором моделировалось оперативное вмешательство
Рис. 14.1. Стереотаксический аппарат Рихерта-Мундингера; а - рабочая часть, фиксировавшаяся к голове больного; б - фантом, на котором моделировалось оперативное вмешательство Рис. 14.2. Современные стереотаксические аппараты (а, б)
Рис. 14.2. Современные стереотаксические аппараты (а, б)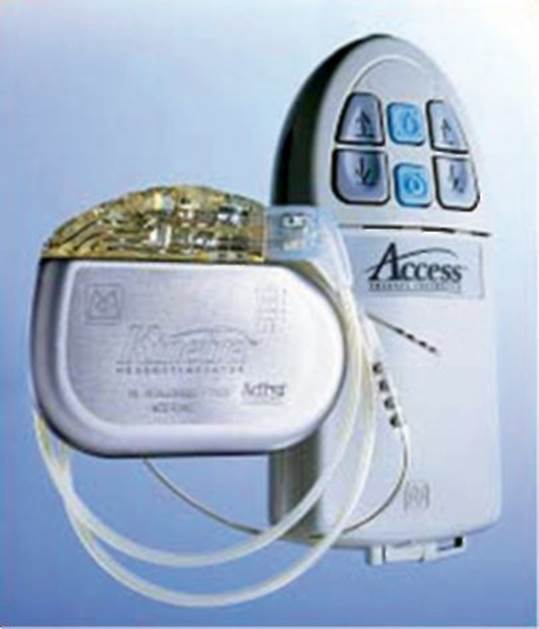 Рис. 14.3. Система для хронической нейростимуляции структур головного мозга; слева - имплантируемый генератор Kinetra, соединенный с внутримозговым электродом; справа - наружный пульт управления генератором
Рис. 14.3. Система для хронической нейростимуляции структур головного мозга; слева - имплантируемый генератор Kinetra, соединенный с внутримозговым электродом; справа - наружный пульт управления генератором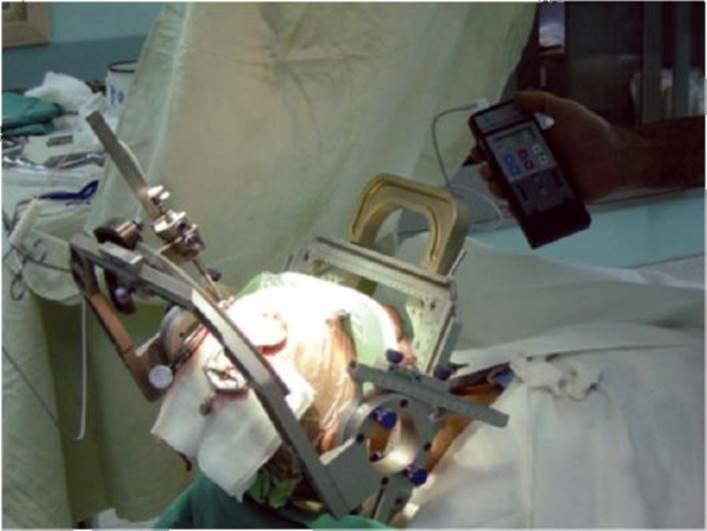 Рис. 14.4. Интраоперационная диагностическая электростимуляция через имплантированный в субталамическое ядро хронический электрод
Рис. 14.4. Интраоперационная диагностическая электростимуляция через имплантированный в субталамическое ядро хронический электрод