 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Механізми захисту організму ссавців від ураження вірусами
Не пошкоджена, нормальна, шкіра і слизові оболонки активно виконують бар'єрну функцію. Слизові оболонки носа і верхніх дихальних шляхів непроникні для багатьох вірусів, за винятком вірусу грипу. Зміна стану організму (стрес, голодування, переохолодження і ін.) знімає опірність слизових оболонок і збільшує їх проникність для мікроорганізмів. Важливу роль грає фіксація мікробів на поверхні слизової оболонки і подальше їх механічне видалення. Мікроби і пилові частинки при вдиху придавлюються до поверхні слизової оболонки, а потім видаляються за допомогою чхальних і кашльових рефлексів, руху миготливого епітелію, злущування епітеліальних клітин з поверхні слизової оболонки, перістальтічних скорочень бронхів. Змивання мікробів зі слизової оболонки дихальних шляхів викликається рясним відділенням слизу та інших секретів, що володіють бактерицидною дією. При попаданні в організм збудників через шлунково-кишковий тракт (кишкові інфекції) першим бар'єром на їх шляху стають слизові оболонки ротової порожнини і слина. Слина містить фактори бактерицидної і бактеріостатичної дії (лізоцим, бактеріолізін, IgA). Взаємодіючи з секреторним IgA, лізоцим викликає лізис резистентних до нього бактерій, але противірусної активністю не володіє. Крім лізоциму в слині, відокремлюємому носоглотки і в сироватці крові містяться інгібітори гемаглютинації, перешкоджаючі взаємодії вірусів з чутливими клітинами. Сильним бар'єром є шлунок. Лімфатичні вузли - наступний бар'єр на шляху збудника інфекційної хвороби. У новонароджених лімфатичні вузли не диференційовані. Бактерії погано затримуються в синусах і слабо захвачуються макрофагами, що пояснює легкість розвитку в цьому віці генералізованих і септичних форм інфекціі. Генералізація інфекційного процесу особливо легко наступає в умовах недосконалої нейро-ендокринної регуляції і високої здатності до проникання гемато-енцефалічного бар'єру. У новонароджених речовина мозку недостатньо диференційована і дуже добре забезпечується кров'ю, тоді як відтік крові істотно важкий через незавершеність розвитку венозної системи. Створюються сприятливі умови для акумулювання токсичних речовин, особливо бактеріальних і вірусних токсинів, чим і пояснюється частіше виникнення у дітей раннього віку токсичних форм інфекційних захворювань. Серед неспецифічних чинників захисту найважливіше значення має фагоцитоз. Розрізняють дві популяції клітин, що циркулюють в крові і фагоцитують: гранулоцити (мікрофагоцити) і тканинні макрофаги. Мікрофагами є нейтрофіли, а макрофагами - моноцити. Фагоцитарна функція нейтрофілів починає формуватися вже на 15-25 тижні внутрішньоутробного розвитку. Дитина народжується з досить вираженою фагоцитарною активністю лейкоцитів. Але це стосується лише процесу хемотаксису, руху і поглинання, тоді як переварювання поглинених мікробів ще значно знижене і досягає величин дорослого на 6-12 місяці життя. Система фагоцитозу може бути генетично дефектна, а крім того ряд мікроорганізмів, такі як пневмокок, клебсиелла, гемофільна паличка та ін., взагалі не піддаються завершеному фагоцитозу. У цих випадках перебіг хвороби може бути особливо важким з розвитком деструктивних процесів або сепсису. Макрофаги можна розглядати як мікроеталон неспецифічної резистентності організму. Якщо вірус не розмножується в макрофагах, організм є резистентним. Комплемент - система, що включає, принаймні, 18 сироваткових білків, які активируються в каскаді реакцій. Здійснює лізис сенсибілізованих антитілами клітинних антигенів, обумовлює реакцію імунного прилипання, бере участь в опсонізації бактерій, вірусів, прискорюючи їх фагоцитоз. Дитина народжується з низькою активністю системи комплементу (близько 50% від рівня активності дорослого). Проте, вже на першому місяці життя, ефективність системи комплементу швидко зростає і досягає рівня дорослої людини до 6-ти місячному віку. Інтерферон - низькомолекулярний білок з противірусними властивостями, виробляється клітинами організму, інфікованими вірусом. Інтерферон продукується параллельно з репродукцією вірусу. Найбільш активними ідукторами інтерферону є міксовіруси і ентеровіруси. Іноді його продукція може випереджати або, навпаки, відставати від розмноження вірусу. Усі інтерферони діють головним чином як противірусні чинники. До найбільш вивчених ефектів відносяться: активація макрофагів; активація натуральних кілерів; пригноблення вірусної реплікації. Противірусна дія інтерферону проявляється на внутрішньоклітинному етапі репродукції вірусу. Здатність до продукції інтерферона генетично детермінована і передається у спадок, вона істотно залежить від віку. Відразу після народження здатність до утворення інтерферону відносно низька, потім вона підвищується, досягаючи максимуму до 12-16 років. Інтерферон виробляють практично усі клітини організму, причому процес виробництва інтерферону починається вже у вхідних воротях інфекції. Тому результат зустрічі мікро- і макроорганізму певною мірою буде залежити від активності інтерфероногенеза вже на ранніх етапах інфекційного процесу. Разом з противірусною дією, інтерферон пригнічує внутрішньоклітинне розмноження малярійних плазмодіїв, хламідій, рікетсій. Показано, що у присутності інтерферону клітини є стійкіші до дії екзо- і ендотоксинів. Інтерферон посилює фагоцитоз, пригнічує трансформацію клітин онкогенними вірусами, гальмує зростання пухлинних клітин, підвищує цитотоксичность лімфоцитів. У дітей першого місяця життя інтерферон гальмує диференціювання нервової тканини. Якщо вірус проникає через бар'єр неспецифічної резистентності, тоді починають діяти специфічні чинники захисту - гуморальні (імуноглобуліни) і клітинні (сенсибілізовані лімфоцити). Під час вірусних інфекцій вирішальна роль належить клітинному імунітету. 1. Специфічні імунологічні реакції пов' язані в довгий ланцюг з Т- і В-системою імунітету. Ці клітини спільно з макрофагами здійснюють найголовніші типи імунологічного реагування, включаючи продукцію антитіл і накопичення сенсибілізованих лімфоцитів, що розпізнають і видаляють чужерідні субстанції. 2. Нейтралізуючі вірус антитіла перешкоджають проникненню вірусу в клітину. Механізми взаємодії вірусних антигенів з антитілами не досить вивчені, проте розглядаються два можливі варіанти взаємодії антигенів з антитілами: антитіла взаємодіють з поверхневими білками вірусних оболонок, блокуючи їх здатність зв'язуватися з рецепторами клітинної поверхні; антитіла змінюють просторову орієнтацію вірусних антигенів і при цьому а) порушується взаємодія вірусу з клітинним рецептором; б) порушується злиття вірусних оболонок з клітинною мембраною і проникнення вірусного нуклеопротеїду у цитоплазму.
Імунокомпетентності клони лімфоїдних клітин добувають в різний час. Раніше за все з'являється здатність до імунної відповіді на антигени вірусів, жгутиковий антиген сальмонел, антиген стафілокока. В процесі дозрівання імунної системи плоду має значення проникнення деякої кількості різних антигенів через плаценту і внутріутробна підготовка лімфоїдних клітин плоду до бактеріальних і вірусних антигенів, що найчастіше всього зустрічаються. Особливо швидке дозрівання імунної системи дитини відбувається після народження, у зв'язку з масовим мікробним обсіменінням і багатократним збільшенням антигенного навантаження. У цьому процесі велику роль грають умовно-патогенні бактерії, що колонізують верхні дихальні шляхи і шкірні покриви, особливо шлунково-кишковий тракт. Про стан специфічного иммунологічного реагування прийнято судити по вмісту в сироватці крові імуноглобулінів класів A, E, D, G, M (рис. 28).
При народженні Рис. 28. Зміна рівнів вмісту імуноглобулінів в сироватці крові при народженні і в постнатальному періоді
Імуноглобуліни М складають близько 10% усього пулу імуноглобулінів в організмі, до його складу входять антитіла проти грамнегативних бактерій (шигелл, сальмонелл, та ін.), частково проти вірусів, розчинних антигенів і токсинів. Антитіла класу ІgМ не проходять через плаценту, тому новонароджена дитина може захворіти шигеллезом, сальмонельозом, респіраторною вірусною інфекцією та ін. Антитіла, що відносяться до ІgМ мають високу аглютинуючу активністю і виконують важливу роль в антимікробному імунітеті. Синтез антитіл ІgМ починається вже в перший тиждень життя дитини, швидко наростає, досягаючи рівня дорослого на 12 - 24 місяці життя. Імуноглобулін G - складає до 80% усіх імуноглобулінів. У його складі розрізняють чотири підкласи: ІgG1, ІgG2, ІgG3 і ІgG4. Клас ІgG містить велику частину противірусних антитіл, а також антитіла до бактеріальних токсинів, полісахаридів, клітиної стінки, капсул грампозитивних бактерій, до типоспецифічного М-протеіну стрептокока. Підкласи ІgG1 і ІgG3 можуть індукувати фагоцитоз, а підкласи ІgG1, ІgG2 і ІgG3 здатні фіксувати комплемент. Найважливішою особливістю усіх під класів ІgG являється їх здатність проходити через плацентарний бар'єр. Процес переходу ІgG через плаценту особливо активно здійснюється в останні тижні вагітності, тому зміст ІgG у недоношених дітей може бути низьким або повністю бути відсутнім. У тих же випадках, коли народжується доношена дитина зміст ІgG в її пуповинній крові відповідає рівню такого у матері або навіть перевищує цей рівень (см. рис. 22). Тому новонароджена дитина не хворіє, як правило, кором, епідемічним паротитом і дифтерією Відразу після народження починається процес катаболизму пасивно отриманих ІgG і рівень його поступово знижується, досягаючи мінімальних значень на 6-9 місяці життя. Саме в цьому віці дитина найбільш сприйнятлива до багатьох вірусних і бактеріальних інфекційних захворювань. Синтез власних антитіл класу ІgG, хоча і виявляється ще внутріутробно, проте після народження цей процес блокується високим рівнем трансплацентарних антитіл цього класу. У міру катаболізму трансплацентарних антитіл наростає синтез власних імуноглобулінів класу 1gG, але рівня дорослої людини вони досягають лише на 5-6 році життя дитини. Імуноглобуліни А складають за об'ємом близько 15% усіх імуноглобулінів сироватки крові. Характерна присутність імуноглобуліну А в жіночому молозиві, слині, сльозах, носовому і бронхіальному секреті, а також на слизовій оболонці кишковика. Ці імуноглобуліни грають вирішальну роль в місцевому імунітеті, перешкоджаючі інвазії бактерій і вирусів в організм. Але, оскільки ІgА не проходять через плаценту, дитина народжується з майже повною їх відсутністю. Цим можна пояснити особливу сприйнятливість новонароджених і дітей перших місяців життя до гострих респіраторних вірусних захворювань. Важливо враховувати, що недостатність секреторних імуноглобулінів у новонароджених і дітей перших місяців життя компенсується грудним вигодовуванням. Показано, що молозиво і свіже жіноче молоко містять велику кількість ІgА. Оцінюючи динаміку наростання основних класів імуноглобулінів в процесі розвитку і зростання дитини, можна бачити, що найбільша імунологічна незахищеність відзначається у віці від 6 місяців до 1,5 - 2 років. Саме у цьому віці дитина повністю втрачає пасивний материнський імунітет, тоді як здатність до вироблення власних антитіл знаходиться лише у стадії розвитку, далеко не досягаючи активности дорослої людини. Цим пояснюється легка сприйнятливість дітей цього віку до ГРВІ (гострих респіраторних вірусних інфекцій), шлунково-кишкових захворювань, інших вірусних і бактеріальних інфекцій. Процес дозрівання імунної системи може бути порушений у зв'язку з внутріутробним інфікуванням дитини. У цих дітей синтез імуноглобулінів починається до народження. При цьому особливо значущо підвищується синтез імуноглобулінів М. Отже, високий зміст ІgM у новонародженого можна вважати найважливішим показником наявності природженої інфекції. Після зіткнення з антигеном В-лімфоцити певного клона починають продукувати специфічні антитіла (імуноглобуліни). Функціональна активність В-лімфоцитів регулюється спеціальними Т-клітинами і гуморальними чинниками, такими, як ІЛ-1 (інтерлейкін). При продукції антитіл раніше усього відбувається секреція IgM. В-лімфоцити потім діференціюються у плазматичні клітини, утворюючи клітини, що синтезують інші класи імуноглобулінів (IgG, IgA, IgЕ, IgD). Деякі популяції В-лімфоцитів не диференціюються в плазматичні клітини і стають В-клітинами пам'яті, які обумовлюють розвиток негайної реакції антитіла з повторно виділеним антигеном. Система противірусного імунітету має деякі особливості, в порівнянні з імунітетом протибактеріальним або протипухлинним: 1. В першу чергу спрацьовують інтерферони і Т-кілерні клітини. 2. Віруси виявляють слабку антигенну дію на В-лімфоцити і для їх активування, проліферацію (розмноження) і диференціювання потрібна участь Т-хелперів. 3. Противірусну дію мають α і β-інгібітори. α-інгібітор входить до складу α-глобулінів, перешкоджає адсорбції вірусів на клітинній мембрані. b-інгібітор входить до складу b-глобулінів, пригнічує розмноження орто- і параміксовірусів. 4. Т-цитотоксичні лімфоцити і інші килерні клітини знищують будь-які клітини, інфіковані чужими антигенами. 5. Противірусні антитіла адсорбуються на вірусних рецепторах, унеможливлюють прикріплення вірусу на мембрані клітини. 6. Проти внутрішньоклітинних форм вірусів антитіла не ефективні.
Схема взаімодії клітин у противірусному імунітеті подана на рис. 29.
1 - представлення і розпізнавання вірусного антигена (Ag) за участю макрофагів (мф) і Т-хелперів (Тх); 2 - розпізнавання Ag(антигену) Т-лімфоцитами, їх активація продуктами Тх (ізолейкінами - ІЛ- 2); 3 - формування клонів, які продукують антитіла плазматичних клітин (пк), і продукція віруснейтралізуючих антитіл; 4 - формування клона Т-кілерів; 5 - розпізнавання Тк антигенів вірусу на мембрані клітин -"мишеней" (км); 6 - формування клітин пам'яті (кп).
Імунітет можна розділити на природжений (видовий) і придбаний. Придбаний імунітет у свою чергу можна підрозділити на природний (як наслідок перенесеного захворювання) і штучний. Штучний імунітет може бути активним (після вакцинації) і пасивним. Пасивний імунітет у свою чергу підрозділяється на природний (у разі передачі антитіл від матері дитині через плаценту) і штучний (як наслідок введення в організм імунних сироваток). Пасивний природний імунітет зберігається від 2 до 6 місяців, а пасивний штучний - до 2 тижнів. Найбільш надійним і перевіреним засобом зниження захворюваності гострими інфекційними хворобами є активна імунізація (профілактичні щеплення). В результаті активної імунізації створюється антитоксинний, антиінвазивний або нейтралізуючий ефект в імунному органіизмі. Деякі імунізуючі агенти дають повний захист упродовж усього життя, інші - частковий, а треті повинні застосовуватися повторно, через певні інтервали часу. Планове проведення активної імунопрофілактики призвело до різкого зниження захворюванності багатьма інфекційними хворобами і зробило можливою ліквідацію такої особливо небезпечної інфекції, як натуральна віспа. Це досягнення стало результатом здійснення програми Всесвітньої організації охорони здоров'я (ВООЗ) по ліквідації віспи. Успіхи активної імунізації (вакцинопрофілактики) дозволили ВООЗ прийняти в 1974 році "Розширену програму імунізації", яка передбачає проведення масових щеплень дітям в усіх країнах світової спільноти проти шести основних інфекційних хвороб: туберкульозу, поліомієліту, коклюшу, діфтерії, правця і кору.
2.2. Теоретичні аспекти активної імунізації
Початок вакцинопрофілактики був покладений геніальним експериментом Е. Дженнера, який в 1798 році опублікував роботу під назвою "Дослідження про причини і наслідки варіолавакцини - хвороби, відомої під назвою коров'ячої віспи". Метод щеплення він назвав вакцинацією, а матеріал, узятий з коров'ячої оспини - вакциною. Проте, перш ніж був науково обгрунтований і розроблений спосіб боротьби з інфекційними хворобами повинна була виникнути абсолютно нова наука - імунологія. Ця наука бере свій початок з 1891 року, коли Луї Пастером був відкритий геніальний принцип: "Якщо знизити отруйність мікроба, то він перетворюється на засіб захисту від хвороби, ним викликаної". Видатний внесок у розвиток імунології зробив наш співвітчизник І.І. Мечников, який в 1884 році відкрив явище фагоцитозу. Подальший прогрес був досягнутий в 1901 році, коли німецький лікар, мікробіолог і біохімік Ерлих створив теорію утворення антитіл (теорія імунітету, теорія білкових ланцюгів). Згідно цієї теорії, у клітин є рецептори, здатні специфічно розпізнавати антигени і зв'язувати їх. Численні наукові дослідження підтвердили основні положення теорії Ерліха і встановили, що антитіла - це імуноглобуліни з різними фізико-хімічними властивостями і функціями. Утворення специфічних противірусних антитіл складається з трьох фаз: фази індукції антитілоутворення, фази продукції антитіл і фази прогресивного зниження концентрації антитіл. Тривалість індуктивної фази - 12-24 години, в цей період можна впливати на імуногенез, посилюючи або уповільнюючи його. Власне продукція і наростання антитіл триває від 4 до 30 днів і впливати на них вже не можна. Досягнувши піку, концентрація антитіл починає знижуватися, спочатку швидко, а потім повільно. Це може продовжуватись на протязі багатьох років. У відповідь на введення певної вакцини виробляється імунітет тільки проти цьогого збудника. Один і той самий антиген викликає імунну відповідь у організмів різних генотипів, і, навпаки, один і той самий організм буває в різній мірі реактивним по відношенню до різних антигенів. Гуморальный імунітет формується ще в період внутріутробного розвитку, але найбільш значні зрушення в показниках імунологічної реактивності відбуваються в перші місяці життя дитини. Специфічна імунна відповідь регулюється генами імунологічної реактивності, зчепленними з головною генетичною системою гістосумісності, що має велике значення для імунологічного розпізнавання і взаємодії в імунній відповіді. Комплекс гістосумісності - це центральний генетичний апарат для функціонування імунної системи. У людини він локалізується в шостій хромосомі. Є істотні відмінності в імунологічної реакції на первинний і повторний контакт з антігенами. Прийнято вважати, що при першій зустрічі з антигеном В-лімфоцити мігрують в зародкові центри лімфовузлів і селезінки, забезпечуючи початковий синтез антитіл, після чого залишається певна кількість клітин пам'яті. Згідно точки зору Р. В. Петрова (1987) імунологічна пам'ять - це здатність організму реагувати за вторинним типом тобто прискорено і посилено при повторній появі антигена, яким індивідуум був імунізований раніше. Пам'ять зберігається ша протязі багатьох місяців, а для деяких антигенів - багато років. До зберігання імунологічної пам'яті причетні обидва типи лімфоцитів, що стимулюються цим антигеном, тобто В- і Т-клітини. При повторній зустрічі з антигеном (вторинна відповідь) відбувається посилене размноження імунокомпетентних клітин, при цьому синтез антитіл здійснюється швидше, іноді вже через 48 годин. Для збереження імунної пам'яті не обов'язкова присутність антигена, а імунологічна перебудова лімфоїдної системи після першого контакту з ним може зберігатися в організмі протягом тривалого часу Тому у ряді випадків через багато років після первинного введення антигена відповідь на його повторне введення є швидкою і у високому титрі створююься відповідні антитіла. Дата добавления: 2014-12-11 | Просмотры: 1264 | Нарушение авторских прав |
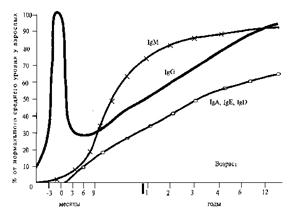
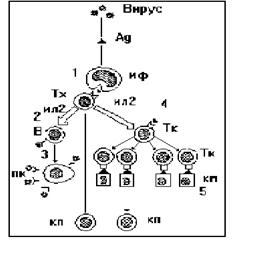 Рис. 29. Взаємодія клітин у специфічному імунітеті
Рис. 29. Взаємодія клітин у специфічному імунітеті