|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
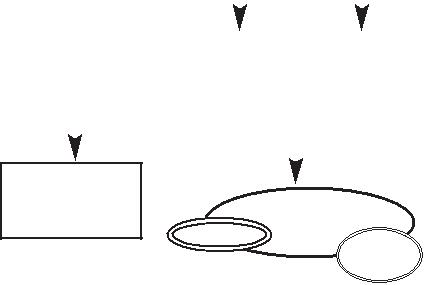
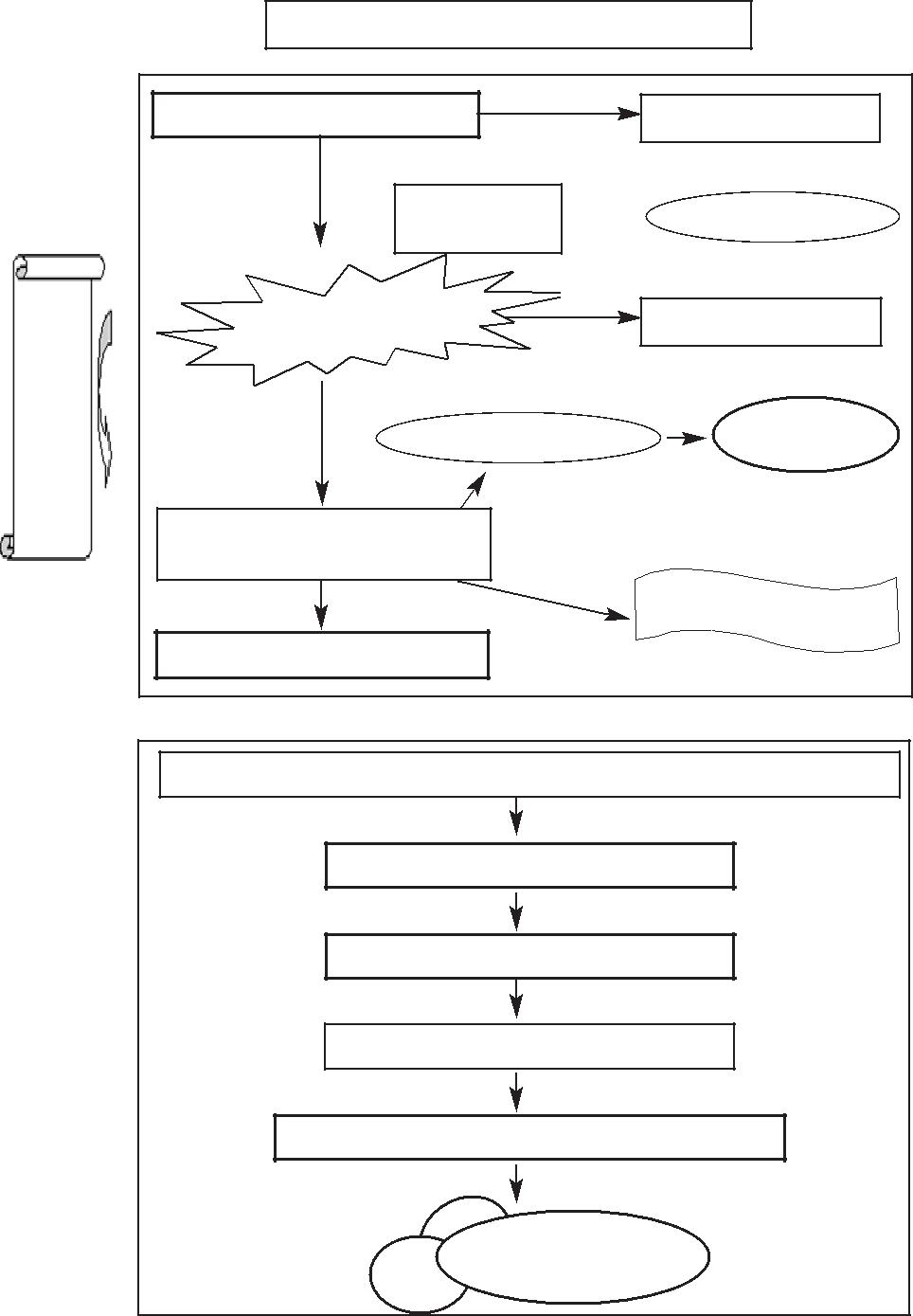
РАДИАЦИОННЫЙ КАНЦЕРОГЕНЕЗ
Сохранная клетка (дикий тип p53)
Повреждение ДНК
Активация p53 и связывание ДНК
Нарушение транскрипции
Репарация ДНК Апоптоз
Нормальная клетка
Клетка с мутантным р53 или потерей двух аллелей р53
Повреждение ДНК
Отсутствие инактивации р53 зависимых генов
Мутантные клетки
Дополнительные мутации
Злокачественная трансформация клеток
Злокачественная опухоль
Профессиональный рак легкого, вызванный вдыханием радио-активного газа радона, был впервые описан у шахтеров урановых руд-ников. Саркома костей у рабочих, разрисовывающих циферблаты часов люминесцирующими красителями, также связана с накопле-нием в костях радиоактивных частиц. Имеются противоречивые данные о более высокой частоте развития лейкозов у людей, живу-щих вблизи предприятий, обрабатывающих отходы ядерного топ-лива.
Радиационные катастрофы, такие как атомная бомбардировка японских городов во время II Мировой войны, ядерные испытания на полигонах в области Семипалатинска и на Маршалловых остро-вах, а также авария 1986 г. на Чернобыльской АЭС привели к резко-му росту онкологических заболеваний среди пострадавшего насе-ления. Был отмечен в несколько раз рост развития лейкозов и солидных опухолей, в первую очередь щитовидной железы, осо-бенно у детей. Поражение щитовидной железы связывают с избира-тельным накоплением в ее ткани радиоактивного йода, образующе-гося в ходе ядерных цепных реакций.
Сейчас становится ясным, что канцерогенное действие радиа-ции может суммироваться с другими канцерогенными агентами — химическими и вирусными. Кроме того, как было показано в экспе-риментах, радиация может активировать вирусы (например, вирус миелоидной лейкемии мышей).
Подводя итог разделу о физических канцерогенных агентах, следует подчеркнуть, что, как и химические канцерогены, они реа-лизуют канцерогенное действие через повреждение ДНК генома клеток.
Теория химических канцерогенов. Химический канцерогенезу человека был впервые описан J.Hill, наблюдавшим развитие поли-поза слизистой оболочки носа у людей, вдыхавших чрезмерные коли-чества лекарств. Sir Percival Patt (1775) первый дал описание рака мошонки у трубочистов. С тех пор описано более 1000 химических канцерогенных веществ, из которых только 20, как было доказано, инициируют опухоли человека. Хотя основные исследования в обла-сти химического канцерогенеза проводятся на лабораторных живот-ных и в клеточных культурах, тем не менее есть наблюдения опухолей человека, развитие которых обусловлено воздействием химических канцерогенов. Яркими примерами могут служить профессиональные опухоли — рак мочевого пузыря у работающих с анилиновыми кра-сителями, рак легкого у людей, контактирующих с асбестом, рак печени работников поливинилхлоридного производства и др.
Канцерогенные агенты подразделяются на две большие группы: генотоксические и эпигенетические в зависимости от их способности взаимодействовать с ДНК. К генотоксическим канцерогенам относят-ся полициклические ароматические углеводороды, ароматические амины, нитрозосоединения и др. Эпигенетические химические канце-рогены не дают положительных результатов в тестах на мутагенность,однако их введение вызывает развитие опухолей. Эпигенетические канцерогены представлены хлорорганическими соединениями, иммунодепрессантами и другими.
В свою очередь часть генотоксических канцерогенов может напрямую взаимодействовать с ДНК, поэтому они называются пря-мыми. Другие же должны претерпеть химические превращения
в клетках, в результате которых они становятся активными, приоб-ретают электрофильность, могут концентрироваться в ядрах клеток и взаимодействовать с ДНК. Последний вид генотоксических канце-рогенов называется непрямым. Активация непрямых генотоксических канцерогенов происходит с участием ряда ферментных систем клет-ки, таких как монооксигеназной ферментной системы, основным действующим компонентом которой является цитохром Р-450-гемо-протеид, эпоксидгидратазы, а также трансферазы, катализирующих реакции конъюгации канцерогенных веществ. Активированные метаболиты реагируют с различными участками ДНК, вызывая алки-лирование ее оснований — аденина, гуанина, цитидина и тимидина. Образование алкилгуанина может приводить к точковым мутациям
в геноме клетки. Названные ферментные системы обнаружены
в клетках печени, бронхиального, желудочного, кишечного и почеч-ного эпителия и др. клетках.
Происхождение химических канцерогенов может быть экзо-и эндогенным. Известными эндогенными канцерогенами считаются холестерин, желчные кислоты, аминокислота триптофан, некоторые стероидные гормоны, перекиси липидов. Накоплению эндогенных канцерогенов в организме могут способствовать некоторые заболе-вания, а также хронические гипоксические состояния.
Х и м и ч е с к и й к а н ц е р о г е н е з имеет многоступенчатый ха-рактер и протекает в несколько стадий: инициации, промоции и про-грессии опухоли (схема 11.2). Каждая из стадий требует специальных этиологических факторов и отличается морфологическими проявле-ниями. В стадию инициации происходит взаимодействие генотокси-ческого канцерогена с геномом клетки, что вызывает его перестрой-ки. Однако для злокачественной трансформации этого недостаточно. Последняя обеспечивается действием еще одного повреждающего
Иммортализация клеток
агента, вызывающего дополнительные перестройки в геноме. Клетка малигнизируется, начинает бесконтрольно делиться. Вещество, используемое на 2-й стадии, называется промотором. В качестве промоторов нередко выступают эпигенетические канцерогены, а также вещества, не являющиеся сами по себе канцерогенами. Эффект химических канцерогенов зависит от длительности введения и дозы, хотя и нет пороговой минимальной дозы, когда канцерогенный агент может считаться безопасным. Инициация является необрати-мым процессом. Кроме того, эффект от действия различных химиче-ских канцерогенов может суммироваться.
Резюмируя данные по химическому канцерогенезу, следует под-черкнуть, что для реализации своего действия химические канцеро-гены должны воздействовать на ядерную ДНК и вызвать ее повреж-дения.
Инфекционная теория — вирусный и микробный канцерогенез.Основоположником теории по праву считается Л.А.Зильбер (1968). Согласно данной теории ряд опухолей может развиться под дейст-вием особых вирусов, которые называются онкогенными вирусами. Первые эксперименты по доказательству роли вирусов в развитии опухолей ставились с использованием бесклеточных фильтратов из ткани неоплазмы, которые вызывали развитие опухолей у живот-ных-реципиентов. Таким способом в 1908 г. Ellerman и Bang впервые удалось вызвать лейкоз у кур. Первый онкогенный вирус был описан в 1911 г. экспериментатором-патологом Рокфеллеровского института Pyeton Rous как фильтрующийся агент, способный вызывать развитие саркомы у кур. За данное открытие P.Rous через 55 лет в 1968 г. был удо-стоен Нобелевской премии. В 30-е годы Bittner открыл вирус рака молочной железы мышей, а Shope — вирус папилломы кролика. После этих основополагающих исследований начался лавинообразный поток работ по идентификации онкогенных вирусов. До недавнего времени вирусный канцерогенез считался присущим только живот-ным. В последние десятилетия получены данные о значении вирусов
и в развитии некоторых опухолей человека: африканской лимфомы Беркитта (ДНК-вирус Эпстайна—Барр), назофарингеальной карцино-мы (вирус Эпстайна—Барр), папилломы и рак кожи гениталий (ДНК-вирус папилломы человека), некоторые виды Т-клеточных лейкозов
и лимфом (РНК-вирус HLTV I) и др. (схема 11.3). Онкогенные вирусы относятся к семействам ДНК- и РНК-содержащих вирусов.
ДНК-онковирусы содержат две группы генов: первая группа — гены, необходимые им для репликации вируса, вторая группа — гены структурных белков вируса. ДНК-онковирусы встраиваются
Схема 11.3 Дата добавления: 2015-12-15 | Просмотры: 1017 | Нарушение авторских прав |