|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
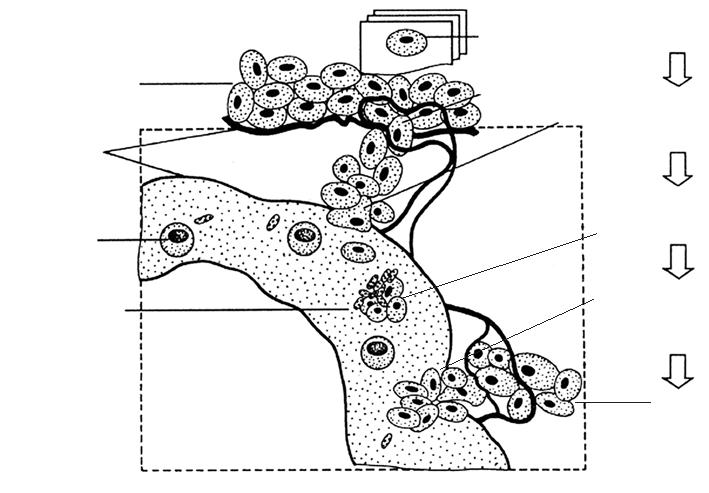
Метастатический каскад
Размножение клона трансформированной клетки
Появление метастатического опухолевого субклона Проникновение
опухолевых клеток в венулу
Циркуляция опухолевого микроэмбола
Адгезия опухолевых клеток к эндотелию в отдаленных органах
Рост метастатической опухоли
ными, поскольку имеется мало данных о клетках-предшественниках многих тканей. Предлагаются гипотетические схемы цитогенеза рака легкого, желудка, молочной железы и др. В теории гисто- и ци-тогенеза опухолей следует выделить несколько основных аспектов.
1. Трансформации может подвергаться только пролиферирую-щая соматические клетки — т. е. поли- или унипотентные клетки-предшественницы.
2. Опухолевая клетка способна повторять в извращенной форме признаки дифференцировки (то есть фенотип), заложенные в клет-ке-предшественнице из которой она возникла.
3. В опухолевых клетках извращение дифференцировки связано
с наличием блока дифференцировки. При наличии такого блока на уровне унипотентных клеток-предшественниц опухолевые клетки обладают минимальной фенотипической гетерогенностью. При наличии блока дифференцировки на уровне полипотентных клеток-предшественниц в неоплазме выражена фенотипическая гетерогенность опухолевых клеток и появляются клетки-химеры
с множественной дифференцировкой.
4. Дифференцировка опухолевых клеток зависит как от уровня малигнизации клетки-предшественницы, так и от уровня блока дифференцировки. Доброкачественные опухоли развиваются при трансформации унипотентных клеток-предшественниц с низким блоком дифференцировки, поэтому они построены из зрелых кле-точных элементов. Злокачественные опухоли характеризуются меньшим уровнем дифференцировки их клеток по сравнению с до-брокачественными, что связывают с их развитием из полипотентных клеток-предшественниц и наличием высокого блока дифференци-ровки. Чем выше уровень малигнизации и уровень блока дифферен-цировки, тем менее дифференцированная злокачественная опухоль возникает.
В качестве гисто- и цитогенетических маркеров опухолевых кле-ток могут использоваться ультраструктурная организация опухоле-вой клетки, а также генные, хромосомные, антигенные и биомоле-кулярные маркеры, получившие названием опухолевых маркеров.
Строение опухоли. Опухоли построены из паренхимы и стромы. Паренхима опухоли — это собственно опухолевые клетки, образовав-шиеся в результате злокачественной трансформации клетки-пред-шественницы и ее клональной пролиферации.
Второй важный структурный компонент опухоли — это ее строма. Строма опухоли, так же как и строма нормальной ткани, в основном,выполняет трофическую, модулирующую и опорную функции.
Стромальные элементы опухоли представлены клетками и внекле-точным матриксом соединительной ткани, сосудами и нервными окончаниями. Внеклеточный матрикс опухолей представлен двумя структурными компонентами: базальными мембранами и интерсти-циальным соединительнотканным матриксом. В состав базальных мембран входят коллагены IV,VI и VII типов, гликопротеиды (лами-нин, фибронектин, витронектин), протеогликаны (гепарансульфат и др.). Интерстициальный соединительнотканный матрикс содер-жит коллагены I и III типов, фибронектин, протеогликаны и глико-заминогликаны.
П р о и с х о ж д е н и е с т р о м ы о п у х о л и. В настоящее время получены убедительные данные о возникновении клеточных эле-ментов стромы опухолей из предсуществующих нормальных соеди-нительнотканных предшественников, окружающих опухоль тканей. В 1971 г. J.Folkman показал, что клетки злокачественных опухолей продуцируют некий фактор, стимулирующий пролиферацию эле-ментов сосудистой стенки и рост сосудов. Это сложное вещество бел-ковой природы впоследствии было названо фактором Фолькмана. Как впоследствии было установлено, фактор Фолькмана представле-яет собой группу факторов роста фибробластов, из которых уже изве-стно более 7. Фолькман первым убедительно показал, что стромооб-разование в опухоли является результатом сложных взаимодействий между опухолевой клеткой и клетками соединительной ткани.
Важную роль в стромообразовании в неоплазме выполняют соединительнотканные клетки как местного, гистиогенного, так и гематогенного происхождения. Стромальные клетки продуцируют разнообразные факторы роста, стимулирующие пролиферацию кле-ток мезенхимального происхождения (факторы роста фибробластов, фактор роста тромбоцитов, фактор некроза опухолей α, фибронек-тин, инсулиноподобные факторы роста и др.), некоторые онкобелки (c-sis, c-myc), одновременно экспрессируют рецепторы, связываю-щие факторы роста и онкобелки, что позволяет стимулировать их пролиферацию как по аутокринному, так и по паракринному пути. Кроме того, сами клетки стромы способны выделять разнообразные протеолитические ферменты, приводящие к деградации внеклеточ-ного матрикса.
Опухолевые клетки активно участвуют в образовании стромы. Во-первых, трансформированные клетки стимулируют пролифе-рацию соединительнотканных клеток по паракринному регуля-торному механизму, продуцируют факторы роста и онкопротеины. Во-вторых, они способны стимулировать синтез и секрецию соеди-
нительнотканными клетками компонентов внеклеточного матрик-са. В-третьих, сами опухолевые клетки способны секретировать определенные компоненты внеклеточного матрикса. Причем такие компоненты в некоторых опухолях имеют характерный состав, что можно использовать при их дифференциальной диагностике. В-чет-вертых, опухолевые клетки продуцируют ферменты (коллагеназы и др.), их ингибиторы и активаторы, способствующие или, напро-тив, препятствующие ифильтрирующему и инвазивному росту зло-качественных опухолей. Динамическое равновесие между коллаге-назами, их активаторами и ингибиторами обеспечивает стабильное состояние опухоли и препятствует ее прорастанию в прилежащие ткани. В момент роста опухолевые клетки активно синтезируют кол-лагеназы, эластазы и их ингибиторы.
Резюмируя вышеизложенное, можно заключить, что образова-ние стромы опухоли является сложным многостадийным процес-сом, основными ступенями которого можно считать:
1) секрецию опухолевыми клетками митогенных цитокинов — раз-личных факторов роста и онкопротеинов, стимулирующих проли-ферацию соединительнотканных клеток, прежде всего эндотелия, фибробластов, миофибробластов и гладкомышечных клеток;
2) синтез опухолевыми клетками некоторых компонентов внекле-точного матрикса — коллагенов, ламинина, фибронектина и др.;
3) пролиферацию и дифференцировку клеток-предшественниц соединительнотканного происхождения, секрецию ими компо-нентов внеклеточного матрикса и формирование тонкостенных сосудов капиллярного типа, что в совокупности и является стро-мой опухоли;
4) миграцию в строму опухоли клеток гематогенного происхождения — моноцитов, плазмоцитов, лимфоидных элементов, тучных кле- ток и др.
Злокачественые опухоли часто формируют строму, в которой до-минирует тип коллагена стромы соответствующего органа на стадии эмбрионального развития. Так, например, в строме рака легкого пре-обладающим типом коллагена является коллаген III, характерный для эмбрионального легкого. Разные опухоли могут отличаться по составу коллагенов стромы. В карциномах, как правило, доминируют коллагены III типа (рак легкого), IV типа (почечноклеточный рак и нефробластомы), в саркомах — интерстициальные коллагены, но в хондросаркоме — коллаген II тип, в синовиальной саркоме достаточ-но много коллагена IV. Описанные различия в строении стромы осо-бенно важно учитывать при дифференциальной диагностике сарком.
Ангиогенез в опухоли. Рост опухолей зависит от степени развитости
в них сосудистой сети. В новообразованиях диаметром менее 1—2 мм питательные вещества и кислород поступают из тканевой жидкости окружающих тканей путем диффузии. Для питания же более круп-ных новообразований необходима васкуляризация их ткани.
Ангиогенез в опухоли обеспечивается группой ангиогенных факторов роста, некоторые из которых могут генерироваться также активированными эпителиальными клетками в очагах хронического воспаления и регенерации. Группа ангиогенных факторов опухоли включает в себя факторы роста фибробластов и эндотелия, ангиоге-нин, фактор роста кератиноцитов, эпидермоидный фактор роста, фактор роста сосудов глиомы, некоторые колониостимулирующие костномозговые факторы и др.
Наряду с факторами роста в ангиогенезе большое значение имеет состав внеклеточного матрикса стромы опухоли. Благоприятным является содержание в нем компонентов базальных мембран — лами-нина, фибронектина и коллагена IV типа. Формирование сосудов
в опухолях происходит на фоне извращенной митогенетической стимуляции и измененного внеклеточного матрикса. Это приводит к развитию неполноценных сосудов преимущественно капиллярного типа, имеющих нередко прерывистую базальную мембрану и нару-шенную эндотелиальную выстилку. Эндотелий может замещаться опухолевыми клетками, а иногда и вовсе отсутствовать.
Роль стромы для опухоли не ограничивается только трофически-ми и опорными функциями. Строма оказывает модифицирующее влияние на поведение опухолевых клеток, то есть оказывает регуля-торное влияние на пролиферацию, дифференцировку опухолевых клеток, возможность инвазивного роста и метастазирования. Моди-фицирующее воздействие стромы на опухоль осуществляется благо-даря наличию на клеточных мембранах опухолевых клеток интегри-новых рецепторов и адгезивных молекул, способных передавать сигналы на элементы цитоскелета и дальше в ядро опухолевой клетки.
И н т е г р и н о в ы е р е ц е п т о р ы — класс гликопротеидов, рас-положенных трансмембранно, внутренние конецы которых связаны с элементами цитоскелета, а наружный внеклеточный — способен
взаимодействовать с трипептидом субстрата Arg-Gly-Asp. Каждый рецептор состоит из двух субъединиц α и β, имеющих множество раз-новидностей. Разнообразие сочетаний субъединиц обеспечивают разнообразие и специфичность интегриновых рецепторов. Интегри-новые рецепторы в опухолях подразделяются на межклеточные и ин-тегриновые рецепторы между опухолевыми клетками и компонентами
внеклеточного матрикса — ламининовые, фибронектиновые, витронектиновые, к различным типам коллагенов, гиалуронатовые (к адгезивным молекулам семейства CD44). Интегриновые рецепто-ры обеспечивают межклеточные взаимодействий между опухолевы-ми клетками, а также с клетками и внеклеточным матриксом стромы и, в конечном итоге, интегриновые рецепторы определяют способ-ность опухоли к инвазивному росту и метастазированию.
А д г е з и в н ы е м о л е к у л ы С А М (от английского cell adhe-sive molecules) — другой важный компонент клеточных мембран опу-холевых клеток, обеспечивающий их взаимодействие между собой
и со стромальными компонентами. Они представлены семействами NCAM, LCAM, N-кадгерином, CD44. При опухолевой трансфор-мации происходит изменение структуры и экспрессии адгезивных молекул, входящих в состав клеточных мембран, что приводит к на-рушению взаимосвязи между опухолевыми клетками, а, следова-тельно, к их инвазивному росту и метастазированию.
В зависимости от развитости стромы опухоли подразделяются на органоидные и гистиоидные. В органоидных опухолях имеются паренхима и развитая строма. Примером органоидных опухолей могут служить различные опухоли из эпителия. При этом степень развито-сти стромы может также варьировать от редких узких фиброзных прослоек и сосудов капиллярного типа в медуллярном раке до мощ-ных полей фиброзной ткани, в которой эпителиальные опухолевые цепочки бывают едва различимыми, в фиброзном раке или скирре. В гистиоидных опухолях доминирует паренхима, строма практичес-ки отсутствует, так как представлена лишь тонкостенными сосудами капиллярного типа, необходимыми для питания. По гистиоидному типу построены опухоли из собственной соединительной ткани
и некоторые другие неоплазмы.
Характер роста. Важнейшим вопросом онкогенеза является во-прос о том, развивается ли злокачественная опухоль при малигниза-ции одной или нескольких клеток. Ответ на этот вопрос неоднозна-чен, так как, хотя большинство опухолей и имеет моноклоновое происхождение, существует также и небольшое количество опухолей, формирующихся из нескольких клеток. Моноклоновое происхожде-ние большинства опухолей доказывается наблюдениями неоплазм у женщин, гетерозиготных по изоформам глюкозо-6-фосфатдегидро-геназы (Г-6-ФДГ). Известно, что ген Г-6-ФДГ локализуется в Х-хро-мосоме, одна из которых получена от матери, а другая — от отца. Одна из двух Х-хромосом, содержащихся в каждой клетке, инактиви-руется на стадии бластоцисты, а в клетке остается единственная
Х-хромосома с той или иной изоформой Г-6-ФДГ. Все клетки жен-ского организма подразделяются на две группы в зависимости от изо-формы Г-6-ФДГ. Описанная гетерогенность по Г-6-ФДГ свойствен-на многим женщинам негритянского происхождения. При этом установлено, что развивающиеся у них опухоли состоят из клеток только одного вида по изоформе Г-6-ФДГ, то есть имеют моноклоно-вое происхождение. Методом определения инактивации Х- хромосомы доказано моноклоновое происхождение для аденом и карцином тол-стой кишки, аденом паращитовидной железы. При хроническом ми-елолейкозе имеется другой маркер моноклонового происхождения опухолевых клеток — филадельфийская хромосома, при Т- и В- кле-точных лимфомах и лейкозах — специфические перестройки генов Т- и В- рецепторов,выявляемые с помощью блот-анализа ДНК. Моноклоновое происхождение сопровождается ростом опухоли на начальной стадии развития в виде одного узла, т.е. имеет место уни-центрический характер роста.
Моноклоновость уже развившейся опухоли может быть резуль-татом не моноклонового ее происхождения, а возникать в результа-те селекции наиболее злокачественного клона опухолевых клеток и вытеснении им менее злокачественных клонов.
Поликлоновое происхождение опухолей встречается значитель-но реже и характерно для опухолей с мультицентричным характером роста, таких как полипоз толстой кишки, мультицентрический рак молочной железы и печени и др.
Мультицентричный характер роста может приводить и к форми-рованию единого узла опухоли при близком расположении и слия-нии нескольких очагов роста, что впервые сформулировал Willis
в своей теории опухолевого поля (1967). Согласно данной теории возможно образование одновременно нескольких очагов пролифе-рации клеток с их последующей трансформацией. По мере роста опухолевые очаги сливаются. При этом опухолевые клетки принад-лежат к разным клонам.
В ходе прогрессии опухоли может происходить ее клональная эволюция (Nowell P., 1988), т.е. могут появляться новые клоны опу-холевых клеток, возникающие в результате вторичных мутаций, что приводит к поликлоновости опухоли и доминированию наиболее аг-рессивных клонов как итог клональной селекции. Доброкачествен-ные опухоли характеризуются доминированием опухолевых клеток одного клона на протяжении всего существования, в то время как
в злокачественных опухолях постоянно прогрессирует поликлоновость, особенно в низкодифференцированных высокозлокачественных
вариантах. Теория клональной эволюции может помочь в объясне-нии не только прогрессии злокачественной опухоли и метастазирова-ния, но также дать ответы на такие вопросы, как: почему в опухолях может возникать феномен “метаплазии” — изменения дифференци-ровки клеток на отдельных участках, как может усиливаться злока-чественность опухоли со временем или особенно после проведения противоопухолевой терапии; почему возникают устойчивые к про-тивоопухолевым воздействиям опухоли спонтанно и после терапев-тических воздействий (феномен множественной лекарственной устойчивости опухоли).
Характер роста опухолей по отношению к окружающим тканям бывает экспансивным с формированием соединительнотканной капсу-лы и оттеснением прилежащих сохранных тканей, а также инфильтри-рующим и инвазивным с прорастание прилежащих тканей. В полыхорганах выделяют также два типа роста в зависимости от отношения опухоли к их просвету: экзофитный при росте опухоли в просвет и эндофитный при росте опухоли в стенку органа.
В зависимости от количества узлов первичной опухоли неоплаз-мы могут обладать уницентрическим или мультицентрическим харак-тером роста.
Биомолекулярные маркеры опухолей. Традиционные морфоло-гические исследования, как правило, позволяют поставить точный диагноз в случаях дифференцированных опухолей и их метастазов. В случаях низкодифференцированных и недифференцированных злокачественных опухолей в диагностике используются совре-менные методы исследования, позволяющие диагностировать изменения на ультраструктурном и молекулярно-генетическом уровнях.
С этой целью используются различные молекулярно-биологиче-ские и морфологические методы (полимеразно-цепная реакция, in situ гибридизация, блот-анализ, цитогенетический анализ, иммун-ногистохимия и электронная микроскопия), позволяющие выявлять биомолекулярные маркеры опухолей.
Биомолекулярные маркеры опухолей — хромосомные, генные и эпи-геномные перестройки в опухолевых клетках, позволяющие осуществ-лять диагностику опухолей, определять степень риска, а также про-гнозировать течение и исходы заболевания.
Можно выделить две группы биомолекулярных маркеров опухо-лей: маркеры клеточной дифференцировки (гисто- и цитогенетиче-ские маркеры); маркеры прогрессии опухоли (пролиферации, апоп-тоза, инвазивного роста и метастазирования).
Маркеры клеточной дифференцировки (гистогенеза). Клетки раз-личных типов различаются между собой по набору дифференциро-вочных антигенов или, другими словами, по иммуннологическому фенотипу. При этом экспрессия многих дифференцировочных анти-генов зависит от степени зрелости (дифференцировки) опухолевой клетки. Таким образом, маркеры клеточной дифференцировки поз-воляют оценить не только гисто- и цитогенез опухоли, но и уровень (степень) ее дифференцировки, а также функциональную активность опухолевых клеток. Большинство из известных дифференцировочных маркеров принадлежит к структурным белкам (белки цитоскелета), ферментам, продуктам секреции (гормонам, иммунноглобулинам, муцинам), клеточным поверхностным антигенам, компонентам вне-клеточного матрикса. Известны также и белковые опухолевые марке-ры, продуцируемые только эмбриональной тканью (α -фетопротеин) и специфические опухолевые антигены (антигены меланомы).
Маркеры прогрессии опухоли. Маркеры клеточной пролиферациишироко используются в современной онкологии для диагностики, прогнозирования и подбора терапии опухолей. Существует множе-ство морфологических методов, позволяющих выявлять клетки в различных фазах митотического цикла: G1,G0, G2, S и M.
При подсчете числа митозов при световой микроскопии, мето-дом ДНК-цито- и гистофотометрии, а также проточной фотометрии определяется процент клеток в фазе митоза М, называемый мито-тическим индексом.
При использовании радиоактивной метки (тимидина, бромокси-уридина) выявляются клетки в S, G2, M-фазах митотического цикла.
В последнее время широко используется иммунногистохимичес-кое определение антигенов митотического цикла: Ki-67, PCNA, ДНК-полимеразы альфа, р105, CDK-2, cdE, статина. Наибольшим диапазоном обладает PCNA, позволяющий выявлять клетки практи-чески во всех фазах митотического цикла. Напротив, селектин метит только неделящиеся клетки.
Маркеры гибели опухолевых клеток подробно разобраны в раз-деле, посвященном апоптозу опухолей. О возможности апоптоза в опухолевых клетках может свидетельствовать экспрессия многих маркеров: CD95, рецепторов к ФНОα, ТФРβ, каспаз, Apaf-1, про-апоптозных членов семейства bcl-2, цитохрома С, p53. Однако о свершившемся апоптозе можно говорить только по характерной фрагментации ДНК, выявляемой методом метки in situ (TUNEL-тест) участков разрыва ДНК, а также по фрагментации PARP или обнару-жению фосфатидилсерина на наружной поверхности клеточной мембраны апоптозных телец (Anexin-тест).
Взаимодействие опухоли и организма. Взаимодействие опухолии организма-опухоленосителя складывается из действия опухоли на организм и защиты организма-опухоленосителя от опухоли. Дейст-вие опухоли на организм хозяина проявляется в локальном и общем воздействии. Локальное воздействие включает в себя нарушения ме-таболизма, сдавление прилежащих сохранных тканей, их разруше-ние растущей опухолью, прорастание стенок сосудов, что может приводить к местному венозному застою. Некроз и изъязвление опу-холи может сопровождаться кровотечением и присоединением вто-ричных инфекций.
Общее воздействие опухоли на организм хозяина может приво-дить к развитию различных видов анемии, раковой интоксикации, раковой кахексии и паранеопластических синдромов. Остановимся на двух последних проявлениях.
Кахексия. Раковая кахексия характеризуется истощением больногос развитием бурой атрофии миокарда, печени и скелетной мускулатуры. Возникновение раковой кахексии связывается с увеличением уров-ня белкового обмена в ткани опухоли, которая становится ловушкой для питательных веществ и обрекает организм на “голодание”. В последние годы развитие раковой кахексии связывают также с уси-ленной продукцией фактора некроза опухоли α (ФНОα) макрофагами и другими клетками в организме-опухоленосителе. ФНОα называют также кахектином, и его патогенетическая роль в возникновении кахексии доказана пока только в экспериментах на животных.
Паранеопластические синдромы. Паранеопластические синдро-мы — это синдромы, связанные с наличием опухоли в организме. Патогенез их различен, но всегда ключевое событие обусловлено воздействием неоплазмы. При гормонально активных опухолях могут возникать различные эндокринопатии, как, например, синд-ром Иценко—Кушинга при аденомах передней доли гипофиза или нейроэндокринных опухолях легких; гиперкальцемия и остеопороз при аденомах околощитовидных желез и раке легкого. Опухоль, осо-бенно на стадии метастазирования, воздействуя на свертывающую и противосвертывающую систему крови, и сама продуцирует факто-ры, усиливающие коагуляцию крови, и способствует развитию раз-личных видов тромбопатий (мигрирующие тромбофлебиты, небакте-риальный тромбэндокардит) и афибриногенемии. При опухолевом росте описан широкий спектр иммунопатологических процессов с имуннокомплексными, антительными и цитотоксическими меха-низмами развития, приводящих к возникновению у онкологических больных нейропатий, миопатии и дерматопатий.
Противоопухолевый иммунитет. Механизмы противоопухоле-вой защиты организма разнообразны. Они складываются из защит-ных реакций с участием процессов репарации мутированного участка ДНК, сбалансированной работы генов-супрессоров и клеточных онкогенов, а также из факторов неспецифической и специфичес-кой, иммунной и неиммунной защиты.
В защите от опухоли имеют значение реакции клеточного и гу-морального иммунитета. Основными клетками, участвующими в противоопухолевой иммунной защите, являются: специфические цитотоксические Т-лимфоциты, способные распознавать мембра-носвязанные опухолевые антигены, а также антигены, относящиеся
к антигенам 1-го класса главного комплекса гистосовместимости; натуральные Т-киллеры (NK-клетки), вызывающие деструкцию опухолевых клеток без предварительной сенсибилизации. Лизис осу-ществляется за счет непосредственного связывания с опухолевыми клетками или же через Fc-фрагменты противоопухолевых антител;
макрофаги осуществляют как неспецифическое повреждение опу-холевых клеток через выделение ФНОα и других факторов, так и специфическое иммунное повреждение путем присоединения
к Fc-фрагментам противоопухолевых антител и через активацию Т-лимфоцитов, выделяющих гамма-интерферон и другие цитокины.
Антительный механизм противоопухолевого иммунитета может осуществляться связыванием противоопухолевыми антителами комплемента с формированием литического комплекса, который взаимодействует с опухолевой клеткой путем присоединения к ней через Fc-фрагмент противоопухолевых антител NK-клеток и мак-рофагов.
Интересным является вопрос о неэффективности иммунных реакций в защите от опухоли. Ее, вероятно, можно объяснить разви-тием иммуносупрессии у онкологических больных, наличием фено-мена антигенного ускользания опухоли в связи с антигенной лабиль-ностью, антигенным упрощением ее клеток, а также усилением роста опухоли под влиянием противоопухолевых антител.
Основные принципы классификации опухолей. В основу совре-менных классификаций опухолей положены их клинические и мор-фологические проявления, причем последние являются в настоящее время основными и учитываются в клинике при диагностике, выборе терапии и прогнозировании жизни больных.
Среди клинических критериев выбраны те, которые характеризу-ют стадию процесса и распространенность метастазов в организме. Используется система TNM (tumour, lymph nodules, organ metastases),
которая учитывает размеры опухоли (Т), наличие метастазов в реги-онарных и отдаленных лимфатических узлах (N), а также в других органах (M). При этом степень выраженности каждого показателя колеблется от 1 до 3, что для опухолей определенных локализаций определяется по-разному. Среди карцином, диаметр которых не пре-вышает 1 см или же они не прорастают собственную пластинку сли-зистой, отдельно рассматривают микрокарциному (например, рак щитовидной железы, молочной железы и др.) и “маленький рак” (например, рак желудка). Выделяют оккультные опухоли, т.е. опухо-ли, которые не проявлялись и не были диагностированы при клини-ческом обследовании больных.
М о р ф о л о г и ч е с к и е к р и т е р и и к л а с с и ф и к а ц и и о п у х о л е й можно разделить на макроскопические и микроско-пические. Макроскопические критерии включают в себя помимо размеров и наличия метастазов в лимфатических узлах и отдален-ных органах характер роста. По характеру роста выделяют опухоли с преимущественным экзофитным, экспансивным, эндофитным, инфильтрирующим ростом. При этом образуются различные макро-скопические варианты. Так, например, в желудке карциномы с пре-имущественным экзофитным ростом образуют бляшковидную, полиповидную, грибовидную и блюдцеобразную макроскопические формы рака. В легком карциномы с преимущественным эндофит-ным, инфильтрирующим ростом представлены узловатой, разветв-ленной и узловато-разветвленной формами.
К микроскопическим критериям классификации опухолей относят: степень зрелости опухолевых клеток; гисто (цитогенез) — ткане-вое, клеточное происхождение опухоли; органоспецифичность; уровень дифференцировки как правило, только для злокачествен-ных опухолей.
от того вида ткани или клеток, из которых опухоль развилась и со-хранила в той или иной степени признаки гистогенетической диф-ференцировки. Часто гистогенез опухоли может быть определен без дополнительных методов исследования только на основе изучения препаратов, окрашенных гематоксилином и эозином. Например, гистогенетическими признаками принадлежности карциномы к плоскому эпителию являются ороговение, стратификация опухо-левых клеток и наличие межклеточных мостиков, выявляемых в пре-паратах, окрашенных гематоксилином и эозином. В то же время
в низкодифференцированных и недифференцированных опухолях гистогенетическая принадлежность определяется только при ис-пользовании специальных методов — иммуногистохимических, по-лимеразной цепной реакции (ПЦР), анализа генома клеток, элек-тронной микроскопии (см. раздел биомолекулярные маркеры).
О р г а н о с п е ц и ф и ч н о с т ь относится к той группе опухолей, которые возникают только в определенных органах. Обычно речь идет о неоплазиях, возникающих в эндокринных органах, а также о раке печени (печеночноклеточная карцинома), почек (почечнок-леточная карцинома). Опухоли, развивающиеся из тканей и клеток, распространенных в разных органах, считаются органонеспецифи-ческими. Например, опухоли из покровного эпителия обнаружива-ются в коже, многих слизистых и легких.
У р о в е н ь д и ф ф е р е н ц и р о в к и з л о к а ч е с т в е н н ы х о п у х о л е й определяется по степени выраженности маркеров гис-тогенетической дифференцировки, сохранности признаков функ-циональной активности и выраженности клеточного атипизма опухолевых клеткок. В соответствии с этим выделяют высоко-(хорошо), умеренно- и низко- (мало) дифференцированные карци-номы и саркомы.
Морфологические особенности опухолей из эпителия и опухолей из тканей, производных мезенхимы. Опухоли из эпителия. Классификацияопухолей из эпителия базируется на основе общепринятых критериев,в соответствии с которыми выделяют: доброкачественные опухоли из эпителия (эпителиомы) и злокачественные (рак, карцинома); по гистогенезу: из покровного эпителия (плоского и переходного — папилломы и плоскоклеточный и переходноклеточный рак) и желе-зистого эпителия (аденомы, аденоматозные полипы и аденокарци-номы); по уровню дифференцировки (для аденокарцином).
Д о б р о к а ч е с т в е н н ы е о п у х о л и и з п о к р о в н о г о э п и т е л и я называются папилломами, из железистого эпителия — аденомами. Аденомы на слизистых могут обладать эндофитным рос-том и называются плоскими аденомами, напротив, при экзофитном росте формируются полипы, именуемые также аденоматозными полипами. З л о к а ч е с т в е н н ы е о п у х о л и и з п о к р о в н о г о э п и т е л и я — плоскоклеточный и переходноклеточный рак, из ж е л е з и с т о г о
— аденокарцинома.
По органоспецифичности опухоли из эпителия могут быть как органоспецифичными, так и органонеспецифичными. В карцино-мах выделяют три уровня дифференцировки.
Папилломы развиваются на коже, слизистых оболочках мочевогопузыря, пищевода, влагалища, реже в бронхиальном дереве. Поэтому папилломы относятся к органонеспецифическим опухолям. Макро-скопически папиллома имеет сосочковую поверхность и напоминает цветную капусту. При эндофитном росте может выявляться только при микроскопическом исследовании и называется инвертирован-ной папилломой.
Для папиллом характерны сосочковые разрастания покровного эпителия, имеющие фиброваскулярный стержень. При этом отмечается сохранение всех основных свойств плоского эпителия — базальной мембраны, полярности, стратификации и комплексно-сти. В папилломах обнаруживаются признаки тканевого атипизма
в виде увеличения слоев эпителия в плоском эпителии, разрастаю-щемся в виде сосочков. В папилломах из плоского эпителия не-редко имеется выраженное ороговение, поэтому их именуют также кератомами. Обсуждается вирусная природа папиллом. Следует также отметить, что малигнизируются папилломы крайне редко. Однако есть локализации опухоли, которые считаются опасными
в плане развития рака. Это папилломы гортани, мочевого пузыря и кожи.
Аденомы — доброкачественные новообразования из железистогоэпителия. Они развиваются в органах, паренхима которых представ-лена целиком эпителием (печень, почки, эндокринные органы), а также в трубчатых и полых органах, слизистая которых содержит железы. В связи с вышесказанным среди аденом встречаются как органоспецифические, так и органонеспецифические опухоли. Макроскопически имеет вид пальцевидного выроста, полипа при экзофитном росте. При эндофитном росте может выявляться только при микроскопическом исследовании и называется плоской адено-мой. В зависимости от структур, которые строит железистый эпите-лий, выделяют следующие гистологические типы аденом: тубуляр-ные (трубчатые структуры), трабекулярные (балочные структуры), альвеолярные, папиллярные (сосочковые), цистаденомы (кистоз-ные). Аденома с развитой стромой называется фиброаденомой и встречается в некоторых органах (в молочной железе, яичниках и др.). В отличие от папиллом в аденомах нередко можно обнару-жить диспластические изменения и даже рак на месте, они чаще подвергаются малигнизации с развитием аденокарцином. Рассмот-рению аденом, множественных эндокринных неоплазий (МЭН) и злокачественных опухолей эндокринных органов посвящены лек-ции по эндокринной патологии.
Плоскоклеточный рак развивается в тех же органах и тканях, чтои папилломы из клеток-предшественниц плоского эпителия, а так-же в очагах метаплазии. Наиболее часто плоскоклеточный рак возни-кает в коже, легких, гортани, пищеводе, шейке матки и влагалище, мочевом пузыре. Выделяют рак на месте и инвазивный плоскокле-точный рак, классифицируемый по уровням дифференцировки. Для высокодифференцированного плоскоклеточного рака характерно наличие внеклеточного ороговения с формированием раковых жем-чужин, стратификации, комплексности, наличия межклеточных мостиков, для умеренно дифференцированного плоскоклеточного рака — внутриклеточного ороговения, стратификации, комплексно-сти, наличия межклеточных мостиков, для низкодифференцирован-ного — только стратификации, комплексности, наличия межклеточ-ных мостиков. Метастазирует плоскоклеточный рак прежде всего лимфогенным путем, поэтому первые метастазы рака обнаружива-ются в регионарных лимфатических узлах. На поздних стадиях раз-виваются гематогенные метастазы.
Аденокарцинома — злокачественная органонеспецифическаяопухоль из железистого эпителия, встречается в желудке, кишечни-ке, молочной железе, легких, матке и в других органах, где есть же-лезистый эпителий или возможна железистая метаплазия эпителия (например, в пищеводе). По гистологическому строению выделяют следующие гистологические типы аденокарцином: тубулярные (трубчатые структуры), трабекулярные (балочные структуры), аль-веолярные, папиллярные (сосочковые), цистаденомы (кистозные). По уровню дифференцировки — высоко-, умеренно и низкодиффе-ренцированные опухоли. Кроме того, выделяют специальные вари-анты аденокарцином в зависимости от их клеточного происхождения (с учетом цитогенеза или дифферона), например, эндометриоидный рак яичника, В-клеточный рак щитовидной железы и т.д. Встреча-ются аденокарциномы, в которых клетки содержат много слизи, но при этом не формируют железистых структур. Этот вариант называ-ется перстневидноклеточным раком.
В зависимости от характера роста, который определяется соот-ношением паренхимы и стромы, среди аденокарцином выделяют опухоли со слабо развитой стромой — медуллярный рак, солидный рак (солидный характер роста), а также опухоли с развитой стромой
— скиррозный рак (скиррозный характер роста). Метастазирует аде-нокарцинома прежде всего лимфогенным путем, поэтому первые метастазы рака обнаруживаются в регионарных лимфатических узлах. На поздних стадиях развиваются гематогенные метастазы.
Нейроэндокринные опухоли. Нейроэндокринные опухоли разви-ваются из клеток-предшественниц апудоцитов, расположенных практически во всех органах и имеющих общее происхождение с эпителиальными клетками данного органа. В норме апудоциты осу-ществляют местную нейроэндокринную регуляцию органов и услов-но объединены в диффузную АPUD-систему. Клетки этой системы продуцируют множество биогенных аминов и полипептидных гор-монов (серотонин, кальцитонин, АКТГ и др.).
Опухоли из нейроэндокринных клеток называются апудомами. Они могут быть доброкачественными — карциноиды, а также злока-чественными — атипичный карциноид, высокодифференцирован-ные и низкодифференцированные нейроэндокринные карциномы. Часто их называют по гормону, который они продуцируют, напри-мер гастринома, инсулома, випома и т.д. Чаще всего карциноиды развиваются в червеобразном отростке, желудке и легком.
Опухоли из производных мезенхимы. Классификация опухолей изпроизводных мезенхимы базируется на основе общепринятых кри-териев, в соответствии с которыми выделяют: доброкачественные опухоли из производных мезенхимы, название которых формирует-ся из корня от названия ткани и суффикса -ома (фиброма, липома
и др.), и злокачественные (саркома); по гистогенезу в зависимости от ткани-источника: из фиброзной ткани — фиброма и фибросаркома, из гладкомышечной ткани — лейомиома и леймиосаркома, из жиро-вой ткани — липома и липосаркома, из хрящевой ткани — хондрома
и хондросаркома, из костной ткани — остеома и остеосаркома. Свойства перечисленных мезенхимальных опухолей индивиду-
альны и зависят не только от гистогенеза, но и органной локализации. Наиболее часто встречающейся доброкачественной опухолью являет-ся лейомиома, она может обнаруживаться в матке, мочевом пузыре, желудочно-кишечном тракте, мочевом пузыре. Полагают, что лейо-миома развивается из перицитов сосудистой стенки вне зависимости от органной локализации. Лейомиомы матки имеют развитую строму, поэтому правильнее их называть лейомиофибромами. Саркомы, как правило, отличаются выраженными признаками злокачественности: быстрым инфильтрирующим, инвазивным ростом, ранними гемато-генными метастазами и нередко выраженными вторичными измене-ниями в виде некроза, ослизнения, кровоизлияний, кальцификации. Дата добавления: 2015-12-15 | Просмотры: 1097 | Нарушение авторских прав |