|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
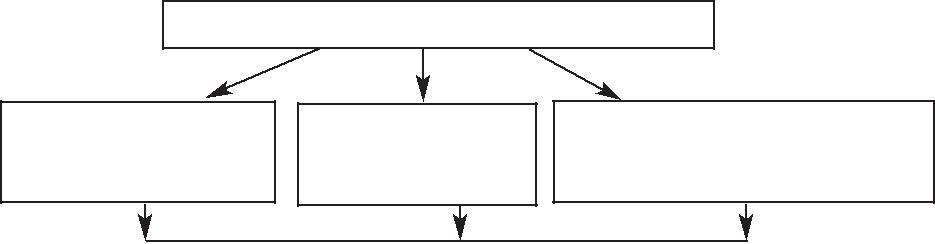
Механизмы активации протоонкогенов
ПРОТООНКОГЕН
Усиление экспрессии Точковые мутации Амплификация (встраивание энхансера при транслокации хромосом)
Превращение протоонкогена в клеточный онкоген (доминантный признак)
Усиленный несбалансированный синтез онкопротеинов
Гиперплазия и дисплазия с нарушением дифференцировки и последующей иммортализацией клеток
Злокачественная трансформация клеток, инвазивный рост опухоли, метастазирование
Клеточные онкогены кодируют синтез белков, которые называ-ются онкобелками, или онкопротеинами. Следует отметить, что все известные в настоящее время онкопротеины принимают участие в передаче митогенетических сигналов от клеточной мембраны до ядра к определенным генам клеток. Это значит, что большинство факторов роста и других цитокинов в той или иной степени могут взаимодействовать с онкобелками.
По функциональной активности и структурному сходству с эле-ментами сигнальной митогенетической цепочки все онкобелки могут быть подразделены на: онкобелки-гомологи факторов роста (c-sis, int-r, k-fgt и др.); онкобелки-гомологи рецепторов факторов роста (c-erbB, c-erbA и др.); онкобелки, связанные с работой рецеп-торов — аналоги G-белка (c-ras), и протеинкиназные белки (c-src, c-fps, c-fes, c-abl, c-met); онкобелки, передающие ростовые сигналы на ДНК (c-fos, c-jun, c-myc и др.).
Для того чтобы стимулировать пролиферацию клеток, протоон-когены должны превратиться в клеточные онкогены. Известны четыре основных механизма активации протоонкогенов: инсерци-онная активация — активация под действием встроенных в геном генов (вирусных); активация при транслокации участка хромосомы с встроенным в него протоонкогеном; активация путем амплифика-ции (умножении копий) протоонкогена; активация при точковых мутациях протоонкогенов.
И н с е р ц и о н н а я а к т и в а ц и я происходит при участии РНК- и реже ДНК-вирусов, которые могут встраиваться в геном клетки и своими генами модулировать активность близлежащих клеточных генов, среди которых могут оказаться протоонкогены. Ретровирусы могут быть носителями вирусного онкогена или энхан-сера, выполняющих роль активаторов онкогенов.
Тр а н с л о к а ц и я у ч а с т к о в х р о м о с о м в клетках может приводить к контакту протоонкогенов с сильными энхансерами, как это происходит при лимфоме Беркитта и хроническом миелолейкозе человека.
При лимфоме Беркитта наблюдается реципрокная транслокация участков 8-й и 14-й хромосом. В результате участок хромосомы 8q24, со-держащий c-myc, транслоцируется на участок 14-й хромосомы 14q32, в зону действия гена тяжелых цепочек иммуноглобулинов. В 10% случа-ев встречается другой вариант реципрокной транслокации с встраива-нием участка 8q24, несущего c-myc, во 2 хромосому, вблизи генов легких цепочек иммуноглобулинов. Активные гены иммуноглобулинов высту-пают в роли энхансеров по отношению к клеточному онкогену c-myc.
Хронический миелоидный лейкоз человека характеризуется спе-цифическим генетическим дефектом — Филадельфийской хромосо-мой, которая образуется в результате реципрокной транслокации между 9-й и 22-й хромосомами. Участок 9-й хромосомы, несущий протоонкоген с-abl, оказывается на фрагменте 22-й хромосомы, где формируется новый ген-гибрид c-abl-bcr, белковый продукт которо-го обладает тирозиназной активностью. А м п л и ф и к а ц и я к л е т о ч н о г о о н к о г е н а проявляется
в увеличении числа его копий и может захватывать как отдельные ге-ны, так и целые участки хромосом. При этом могут обнаруживаться добавочные мелкие хромосомы. Амплификация описана для c-myc и с-ras семейств клеточных онкогенов при раке легкого, мочевого пузыря, толстой кишки, поджелудочной железы. Амплификация N-myc найдена в человеческой нейробластоме в 38% случаев и кор-релирует с плохим прогнозом жизни больных. Амплификация c-neu, онкобелок которого гомологичен рецепторам к эпидермоидному фактору роста, является плохим прогностическим фактором при раке молочной железы. Накопление в клетках карциномы онкопро-
теина с-neu приводит к усиленному связыванию ростовых факторов, которые синтезируются самими же опухолевыми клетками (ТФРα), что стимулирует рост опухоли по аутокринному механизму.
Гены — супрессоры рака. В геноме клеток обнаруживаются гены,которые, напротив, тормозят пролиферацию клеток и обладают антионкогенным действием. Потеря клеткой таких генов может приводить к развитию рака. Наиболее изученными антионкогенами являются р53 и Rb (retinoblastoma gene). Потеря Rb обнаруживается
в редко встречающейся детской опухоли ретинобластоме (частота ретинобластомы 1 на 20000 детей). 60% ретинобластом развиваются спорадически, а 40% описываются как наследственные опухоли с ау-тосомно-доминантным типом наследования. В случаях наследствен-ного дефекта Rb нормальный ген отсутствует только на одной алле-ли. Вторая аллель остается сохранной, поэтому опухоль может развиться только при одновременном повреждении второго сохран-ного гена Rb. В случае спонтанно развившейся ретинобластомы по-теря Rb затрагивает сразу обе аллели (схема 11.6).
Молекулой 1995 г. назван ген-супрессор р53. Существует две формы антионкогена р53: “дикая” (неизмененная) и мутированная. В опухолевых клетках при многих типах рака обнаруживается накоп-ление мутированной, или “дикой” формы, р53 в избыточном коли-честве, что оказывает отрицательное действие на регуляцию клеточ-
ного цикла, в связи с чем клетка приобретает способность к усиленной пролиферации.
Схема 11.6 Дата добавления: 2015-12-15 | Просмотры: 1022 | Нарушение авторских прав |