|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Вен пищевода и желудкаА.К. Ерамишанцев
ожно найти немного заболеваний, для лечения которых было бы предложено столь много оперативных вмешательств, как при портальной гипертензии (ПГ). Данное обстоятельство свидетельствует о чрезвычайной сложности проблемы ПГ и о неудовлетворенности хирургов результатами операций, что и обусловливает постоянный поиск более эффективных методов лечения этого страдания. Основное показание к операции при ПГ - лечение и профилактика кровотечений из варикозно расширенных вен (ВРВ) пищевода и желудка, являющихся главной причиной летального исхода. Указанному симптому «обязан» практически весь арсенал хирургических пособий, применяемых при этой болезни. Именно этим симптомом ПГ объясняется повышенный интерес хирургов к обсуждаемой проблеме. К 1980 г. общее количество разработанных операций и их модификаций при ПГ превышало 100. В последующие годы их количество еще более увеличилось. Между тем в связи с развитием и внедрением в клиническую практику ортотопической трансплантации печени у больных циррозом печени (ЦП) характер их изменился благодаря появлению «малоинвазивных» эндоваскулярных и эндоскопических технологий, позволяющих получить недолгосрочный гемостатический эффект. абдоминальная хирургия В России трансплантация печени делает лишь первые шаги. Поэтому хирургические методы лечения ПГ у больных ЦП еще длительное время будут иметь первостепенное значение. Что же касается внепеченочной портальной гипертензии (ВПГ), то альтернативы оперативному лечению этой патологии нет. Собственные наблюдения более чем за 2000 оперированными пациентами с ПГ позволяют проследить эволюцию хирургического лечения ПГ и подвести некоторые итоги почти 40-летнего периода работы с этим контингентом больных. Началом хирургического лечения ПГ следует считать 80-90-е годы XIX века, когда в основу оперативного вмешательства была взята идея декомпрессии портальной системы, т.е. создания новых путей оттока крови из системы воротной вены. Для решения этой задачи почти одновременно были предложены 2 типа операций: 1-й - оментопари-етопексия, т.е. подшивание большого сальника к передней брюшной стенке, автором которой, согласно данным литературы, является S. Talma (1898); 2-й - сосудистый портокавальный анастомоз (ПКА), что было предложено Н.В. Экком (1877). Идея Talma дала начало целому направлению в хирургии ПГ, названному «органоанастомозы», сторонники которого использовали для этой цели не только сальник, фиксируя его к печени, почке, полой вене, но и целые органы, такие как тонкая кишка, желудок, печень, селезенка, подшивая их в зависимости от уровня блока друг к другу, легкому, диафрагме, мышцам, брюшной стенке. Сравнительно простая техника вышеуказанных операций способствовала их широкому распространению в клинической практике. При этом подавляющая часть хирургов совмещала их со спленэктомией или перевязкой селезеночной артерии, мотивируя такую комбинацию тремя обстоятельствами: 1) уменьшением притока крови в портальную си 2) улучшением артериального кровообращения 3) коррекцией гиперспленизма, часто сопутству Следует заметить, что спленэктомия в комбинации с органоанастомозами среди российских хирургов и хирургов бывшего союзного государства, так же как и в нашем отделении, была операцией выбора в течение как минимум 3 десятилетий (1950-1980 гг.) при лечении больных ПГ. Изучение данных литературы и многолетний личный опыт показали малую эффективность этих операций в борьбе с проявлениями ПГ, следствием чего явился практически полный отказ от их выполнения. Кроме того, как показали наши наблюдения, спленэктомия сопровождалась высокой послеоперационной летальностью, причинами которой являлись тромбоз сосудов портальной системы с последующим кровотечением из вариксов пищевода и желудка и печеночная недостаточность. Последняя в немалой степени была обусловлена и интраоперационной кровопотерей, достигающей в ряде случаев 2 л крови и более. Попытки ее умень- шения путем предварительной перевязки селезеночной артерии или дооперационной эмболиза-ции артериального притока к селезенке ощутимых результатов не дали. Будучи благополучно перенесенной, спленэктомия в ряде наблюдений осложнялась новым еще более тяжелым страданием - аспленической геморрагической тромбоцитемией, требующей новых лечебных подходов. Начиная с 1980 г. мы подвергли ревизии наше отношение к спленэктомии как самостоятельной операции и резко сузили показания к ней, ограничив их наличием 3 ситуаций: 1) сегментарная портальная гипертензия, когда 2) артериовенозная фистула между селезеноч 3) инфантилизм у подростков, имеющих ЦП, ког При наличии ВРВ пищевода и желудка спленэктомия должна быть дополнена их прошиванием. Гиперспленизм, т.е. нарушение в составе периферической крови, в настоящее время не рассматривается как настоятельное показание к спленэктомии, ибо повышение числа тромбоцитов и лейкоцитов после удаления селезенки совершенно не влияет на течение ПГ, а в ряде случаев ухудшает прогноз болезни, о чем мы уже указали выше. В единичных наблюдениях у больных ЦП показанием к спленэктомии может быть желтуха и анемия, когда имеются доказательства в пользу гемолиза эритроцитов. Опыт показал, что спленэктомия в этой ситуации благотворно влияет на состояние больных и способствует улучшению функции печени. Однако подобные случаи редки (за последние 3 года мы оперировали одного такого больного); при наличии ВРВ спленэктомия должна обязательно сочетаться с операцией на пищеводе и желудке, иначе риск кровотечения из ВРВ остается. В случаях, когда слишком большие размеры селезенки препятствуют выполнению прямого вмешательства на варикозных венах пищевода и желудка, осуществляемого с целью лечения или профилактики гастроэзофагеальных кровотечений, а сосудистый ПКА не показан или невыполним, спленэк-томию можно признать оправданной операцией, без которой основное вмешательство оказалось бы неосуществимым. В связи с низкой эффективностью органоанасто-мозов и спленэктомии при кровотечениях из ВРВ пищевода и желудка в хирургии ПГ появилась новая проблема - проблема повторных операций, приобретшая особую актуальность для больных с ВПГ, которые в отличие от больных циррозом печени имеют практически нормальную функцию печени, а при отсутствии кровотечений — продолжительность жизни, не отличающуюся от таковой у здоровых людей. Перенеся по нескольку операций, выполненных в других лечебных учреждениях страны, эти больные поступали в наше отделение в связи с продолжающимися рецидивами кровотечения из ВРВ пищевода и желудка без всякой надежды на успех. абдоминальная хирургия
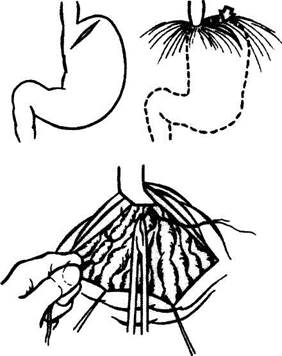
Рис. 1. Частичная эзофагогастрэктомия. Этапы формирования пищеводно-желудочного анастомоза по Цацаниди.
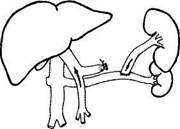
Рис. 2. Дистальный спленоренальный анастомоз.
Первые операции частичной эзофагогастрэкто-мии в нашей клинике были выполнены проф. МД Пациора в промежутке 1960-1965 гг., однако из 9 больных 4 умерли от несостоятельности швов пищеводно-желудочного анастомоза. И только с 1968 г. после внедрения КН. Цацаниди инвагинационно-го метода пищеводного соустья непосредственные результаты этой операции значительно улучшились. По данным мировой литературы 19б0-70-х гг. на эту операцию возлагались большие надежды как наиболее радикальную, последнюю попытку борьбы с кровотечениями из флебэктазов пищевода и желудка, когда шунтирующие операции невыполнимы. К 1985 г. мы имели опыт уже 80 подобных операций, однако анализ отдаленных результатов заставил нас отнестись к ее популяризации с осторожностью. У подавляющего большинства больных, перенесших эту операцию, развились диспепсические расстройства, которые в 42% сочетались с симптомами агастральной астении в виде значительной потери масса тела и анемии. Кроме того, серьезными осложнениями оказались эрозивно-язвенные поражения культи желудка, оставшейся в условиях нарушенного оттока крови и в этой связи рецидивы кровотечений. Вместе с тем у отдельных больных срок наблюдения после операции уже превысил 30 лет (9 пациентов); рецидивов кровотечения у них не отмечалось, больные сохранили трудоспособность при остающемся небольшом дефиците масса тела. Анализ этих наблюдений не позволяет отказаться от этой операции и считать ее показанной в тех редких ситуациях, когда другого пути помочь этим больным не остается. Возможно, что полное, а не частичное удаление желудка улучшит результаты этой операции за счет исключения тяжелой гастро-патии со стороны остающейся культи этого органа. Однако этот вопрос требует дальнейшего изучения. Идея шунтирования портальной системы для больных ЦП сохраняет свою актуальность и по настоящее время. Однако накопленный мировой и собственный опыт (более 450 операций за последние 20 лет) показал, что прямые ПКА между воротной и нижней полой венами, радикально излечивая больного с ЦП от портальной ги- пертензии, как правило, влекут за собой ухудшение функционального состояния печени, следствием чего нередко явля.тся гепатогенная энцефалопатия и смерть больного. Вот почему интерес к шунтирующим операциям у больных ЦП на длительное время угас и вновь возродился только после 50-х годов XX века, когда были предложены ПКА с корнями воротной вены -селезеночным и брыжеечным сосудами. Однако и они сопровождались значительным числом осложнений, среди которых гепатогенной энцефалопатии принадлежит основная роль. Позднее, в 1967 г. Warren была предложена операция «дистального спленоренального анастомоза» (ДСРА) (рис. 2), суть которой сводилась к шунтированию селезеночно-желудочного бассейна при сохранении кровотока по воротной вене, что позволило значительно улучшить результаты шунтирующих операций. К этому времени было уже ясно, что, осуществляя декомпрессию портальной системы при ЦП, следует сохранять кровоток по воротной вене и что ДСРА позволяет решить эту дилемму. Однако анатомические условия редко позволяли осуществить этот тип анастомозов. Кроме того, серьезным, иногда смертельным, осложнением этой операции был послеоперационный панкреатит. Вот почему последующие годы в мировой практике, а в нашей клинике в основном с 1990 г. получают распространение так называемые парциальные сосудистые ПКА, основной идеей которых становится ограничение диаметра создаваемого пор-токавального соустья, результатом чего будет не полный, а парциальный, т.е. частичный, сброс портальной крови и сохранение остаточного проград-ного кровотока к печени. Практика показала, что оптимальный диаметр такого соустья должен находиться в пределах 8-10 мм. Поэтому последние 10 лет, осуществляя портока-вальное шунтирование (ПКШ) у больных ЦП, мы выполняем ПКА указанного размера (105 операций). При этом стремимся осуществлять спленоренальный шунт в двух вариантах: Н-типа или бок в бок (рис. 3), избегая спленэктомии и травмы поджелудочной железы. При удобном расположении селезеночной вены операцией выбора может быть ДСРА. Считаем, что для больных ЦП мезентерико-кавальный шунт (рис. 4) менее предпочтителен из-за более высокого риска развития энцефалопатии. Однако в ряде наблюдений он является единственно возможным по анатомическим условиям. Отбор больных ЦП для выполнения сосудистого ПКА является ответственным моментом. Биохимические характеристики таких больных должны соответствовать параметрам группы А по Чайлду а абдоминальная хирургия
Кроме того, последние 10 лет мы придаем значение и показателям объемного кровотока по воротной вене. Как показали исследования, проведенные в отделении функциональной диагностики РНЦХ РАМН, объемный кровоток по воротной вене у здоровых лиц равен 897±220,8 мл/мин, между тем как у больных ЦП, которых обследовали перед наложением сосудистого анастомоза, он был равен 739,75±ЗП,66 мл/мин (р>0,05). Ретроспективный анализ показал, что после выполнения парциального шунта спустя 14-16 дней после операции кровоток плохо определялся или совсем не определялся в тех наблюдениях, где в исходе он был ниже 500 мл/мин. Так, из 46 больных с наложенными парциальными шунтами при выписке из отделения кровоток по воротной вене не определялся у 8, у которых до операции он был равен или ниже 500 мл/мин. В отдаленном периоде, т.е. спустя 6 мес -14 лет, из 39 обследованных нами больных ЦП и парциальными сосудистыми анастомозами кровоток по воротной вене сохранился у 22 больных, у 17 он не определялся. При этом только у 3 из 17 больных результат операции оценен как неудовлетворительный, что выражалось в прогрессирова-нии печеночно-клеточной недостаточности и последующем летальном исходе. Таким образом, парциальные анастомозы не гарантируют сохранение проградного кровотока к печени как в ближайшем, так и в отдаленном периоде. Однако клинические результаты их несопоставимы с тотальными ПКА, при которых портальный кровоток сразу или почти сразу прекращается, следствием чего и может быть резкое ухудшение функции печени, наступающее сразу после операции с последующей печеночной недостаточностью и смертью больного. Наши исследования показали, что частичная декомпрессия портальной системы у большинства больных сохраняет приток портальной крови к печени, хотя и редуцированный. В тех же наблюдениях, где он не определялся, угасание его, как мы полагаем, происходило на протяжении более или менее длительного временного интервала, достаточного для адаптации печени к изменившимся условиям гемодинамики. Изучая отдаленные клинические результаты парциальных ПКА у 78 больных ЦП в сроки от 6 мес до 14 лет, мы могли констатировать развитие энцефалопатии в легкой форме у 23 % больных; трудоспособность сохранилась у 83 % больных, работавших до операции. 75 % оперированных больных пережили 2-летний срок, 60 % - 3-летний, а 50 % -5-летний срок с момента операции. Основной причиной смерти в отдаленном периоде было про-грессирование ЦП (19 больных) и рецидив кровотечения (4 пациента) вследствие тромбоза анастомоза. При этом 9 из 19 больных умерли в течение первого года после операции, причем все они до операции относились к группе В по Чайлду и имели несколько повышенные маркеры цитолиза. Что касается больных с ВПГ, то, как показал наш опыт, диаметр и тип шунта не влияют на исходы операций. ПКШ для этой категории больных (более 300 операций за последние 20 лет) дает исключительно хорошие результаты, полностью реабилитируя их от этого страдания. Однако, отбирая больных с ВПГ для шунтирующей операции, надо обязательно оценить сократительную функцию миокарда и, если она скомпрометирована, от шунтирования следует отказаться. При невыполнимости сосудистого анастомоза или наличии противопоказаний к его выполнению профилактика и лечение кровотечений из ВРВ пищевода и желудка в настоящее время осуществляются путем модифицированной проф. МД Пацио-ра операции Таннера (рис. 5) - прошиванием и перевязкой вариксов дистального отдела пищевода и проксимального отдела желудка путем гастрото-мии, выполняемой как из абдоминального, так и торакального доступов. Из многочисленных операций такого типа, предложенных в мире, именно эта получила в России наибольшее распространение как наиболее простая в техническом отношении и непродолжительная по времени. За последние 20 лет нами было выполнено 683 таких операции, из них в плановом порядке - 428 (62,7%) с общей послеоперационной летальностью 9,1 %• При этом у больных ЦП она составила 13,6%, с ВПГ-5,5%. Комбинация этой операции со спленэктомией значительно повышала количество послеоперационных осложнений и летальных исходов. После ограничения показаний к спленэктомии общая летальность уменьшилась и, начиная с 1990 г. уже не превышала 6,1%. абдоминальная хирургия
При операциях, произведенных по срочным показаниям, т.е. в период продолжающегося кровотечения, у 255 больных общая послеоперационная летальность достигла 31,4%. У больных ЦП она составила 39,3%, а с ВПГ - 16%. Причинами послеоперационной летальности для больных ЦП, как правило, была прогрессирующая печеночная недостаточность, а для больных ВПГ - полиорганная недостаточность и гнойно-септические осложнения. Отдаленные результаты в сроки от 1 года до 10 лет изучены у 218 больных ЦП и 257 больных ВПГ. Рецидивы кровотечений отмечены - у 114 больных ЦП (52,3%), что явилось причиной смерти 38 больных. У больных ВПГ рецидивы кровотечений имели место у 102 больных (39%), что явилось причиной смерти у 19 из них. Следует заметить, что рецидивы кровотечений после операции у большинства больных носили менее тяжелый характер, чем до операции. Как правило, поступившие больные с ЦП в связи с наличием рецидивов кровотечения подвергались эндоскопическому исследованию и последующей склеротерапии или лигированию ВРВ пищевода. Что касается больных с ВПГ, то в связи с рецидивами кровотечений 52 больных были подвергнуты повторным операциям: 32 было произведено повторное прошивание ВРВ пищевода и желудка, а 20 наложен сосудистый анастомоз. Пятилетняя выживаемость у больных ЦП после прошивания ВРВ в группе А составила 73%, в группе В - 55%. У больных ВПГ 5-летняя выживаемость составила 90,5%. По прошествии 6 мес после прошивания ВРВ рекомендуется эндоскопический контроль результатов операции. Оставшиеся или вновь появившиеся у ряда больных вариксы в пищеводе подвергаются превентивным эндоскопическим вмешательствам. Особо следует остановиться на алгоритме лечения при острых кровотечениях из ВРВ пи- щевода и желудка. Последовательность действий хирурга сводится к следующему. После эндоскопической диагностики и распознавания варикозных вен как источника кровотечения немедленно вводится зонд Сенгстакена-Блекмора, что дает остановку кровотечения в 95% случаев. Одновременно проводится интенсивная заместительная инфузионно-трансфузионная терапия, а также оценивается функциональное состояние печени. Для этого используется широко распространенная классификация по Чайлду. После стабилизации гемодинамики подключается внутривенное введение препаратов нитроглицерина для снижения портального давления и пролонгирования ге-мостатического эффекта зонда. В течение этого времени желудок отмывается от крови; по истечении 6 ч воздух из желудочной манжетки выпускается. Если кровотечение не рецидивирует, больному осуществляется попытка эндоскопического склерозирования или лигирования ВРВ. Если после распускания желудочной манжетки возникает рецидив кровотечения, то дальнейшие действия зависят от тяжести ЦП. Больной группы А и В (по классификации Чайлда) и пациенты с ВПГ подаются в операционную, где производится операция - прошивание ВРВ пищевода и желудка. Если это больной группы С по Чайлду - вновь раздувается желудочная манжетка, наряду с этим проводятся гемостатические мероприятия, включающие переливание свежезамороженной плазмы и гемо-статиков. После достижения временного гемостаза производится эндоскопическое вмешательство с надеждой добиться окончательного гемостаза. Если после эндоскопического гемостаза у больного ЦП группы А и В или с ВПГ вновь возникает рецидив кровотечения, то вновь вводиться зонд Блекмора и больной направляется в операционную для хирургического вмешательства - прошивания ВРВ пищевода и желудка. Последние 10 лет нами накапливался опыт чрес-печеночного эндоваскулярного тромбирования внеорганных вен желудка. Технология этого метода достаточно сложна, требует дорогостоящей аппаратуры и высокого мастерства хирурга, что сдерживает ее широкое распространение. Следует заметить, что эта манипуляция дает достаточно надежный, но временный гемостатический эффект и вероятность рецидивов кровотечения сохраняется. В настоящее время мы не имеем возможности осуществлять трансюгулярное портосистемное шунтирование (TIPS), которое, по данным литературы, более эффективно при лечении острых кровотечений из ВРВ пищевода и желудка. Однако гемостатический эффект его также не длительный и, в целом, эта процедура используется за рубежом как этап перед трансплантацией печени. Подводя итог вышеизложенному, можно признать, что лечение и профилактика кровотечений из ВРВ пищевода и желудка по-прежнему составляют основу показаний для хирургического вмешательства при ПГ. До 80-х годов прошлого столетия выполнимость сосудистых ПКА во многом сдерживалась отсутствием соответствующего шовного материала, а также бытовавшим в то время мнением о непригодности сдсудов малых диаметров (8-10 мм) для адекватной декомпрессии портальной системы. Поэто- абдоминальная хирургия му процент сосудистых ПКА среди всех хирургических вмешательств не превышал 15. Позднее с накоплением опыта и внедрением элементов микрохирургической техники процент выполнимости портокавальных шунтов значительно возрос и к настоящему времени для больных ЦП составляет 30-35, а для больных ВПГ - 50-55, что позволило значительно улучшить результаты операций по профилактике кровотечений из вариксов пищевода и желудка. Испытав практически весь арсенал хирургических пособий при лечении ПГ, последние 10 лет для больных ЦП и ПГ мы окончательно остановили свой выбор на 2 видах операций - это парциальные сосудистые ПКА и прямые вмешательства на ВРВ пищевода и желудка. Накопленный опыт показал, что сосудистые анастомозы следует признать операцией выбора для больных ЦП группы А по Чайлду, без признаков активности и с удовлетворительными параметрами центральной и печеночной гемодинамики; для больных ЦП группы В этот вопрос остается пока предметом исследования. Основной процент летальных исходов пришелся именно на эту категорию больных в течение первого года после операции в связи с про-грессированием печеночной недостаточности. Вот почему общая 5-летняя выживаемость у больных ЦП после сосудистых анастомозов не превысила 50 %. Есть все основания полагать, что она оказалась бы ощутимо выше, если выполнение парциальных сосудистых анастомозов было бы ограничено только больными группы А. Отдавая себе отчет в паллиативном характере прямых вмешательств на ВРВ, мы тем не менее получили приемлемые отдаленные результаты у больных ЦП. Несмотря на сохраняющуюся возможность рецидива кровотечения почти у 50% больных после операции, они чаще переживают 5-летний срок, чем после операций ПКШ. В этой связи есть основания вернуться к изучению вопроса об обоснованности выполнения шунтирующих операций у больных ЦП группы В по Чайлду, особенно при наличии цитолитического синдрома. Что касается больных с ВПГ, то вопрос о целесообразности ПКШ у них уже не обсуждается. Этот вид хирургического пособия для них однозначно является операцией выбора. При его невыполнимости операцией выбора остается только прошивание ВРВ, что может быть произведено как из абдоминального, так и торакального доступов. Риск рецидива кровотечения после этой операции сохраняется, однако по этому поводу может быть предпринята повторная операция такого же типа или эндоскопическое пособие. В отличие от резекции пищевода и желудка эта операция сама по себе не приводит к более тяжелой инвалидизации больных и в целом никак не ухудшает качества их жизни. Однако в отдельных случаях нельзя исключить возможность гастрэктомии, когда сосудистый шунт невыполним и доминирующим симптомом является поражение варикозными венами желудка и гастропатия. При этом такое вмешательство может рассматриваться как операция выбора у ранее не оперированных больных. Последние годы у отдельных больных нам удается выполнить в качестве повторной операции сосудистые ПКА, которые полностью решают проблему ПГ при ВПГ. Эндоскопические процедуры, как правило, носят вспомогательный характер и применяются в основном при угрозе рецидива кровотечения после уже произведенной операции. При наличии отдельных стволов ВРВ или узлов, доступных для введения склерозантов или лигирования, целесообразно ограничиться только этой процедурой с последующим контролем через 5-6 мес за состоянием флебэктазов. В отдельных наблюдениях, где при первичном эндоскопическом исследовании устанавливается наличие ВРВ I—II степени без явлений эзофагита и в анамнезе у больного не было кровотечений, целесообразно не подвергать больного полостной операции и ограничиться только эндоскопическими вмешательствами с последующим контролем через 5-6 мес. При наличии в анамнезе у больных ЦП группы В кровотечения или угрозе его возникновения в отдельных случаях существует альтернатива полостной операции в виде совмещения эндоскопического склерозирования ВРВ с чреспеченоч-ной эндоваскулярной окклюзией внеорганных вен желудка. К сожалению эндоваскулярные вмешательства у больных ЦП в Москве могут быть выполнены только в крупных лечебных учреждениях несколькими высококвалифицированными хирургами, они достаточно трудоемки и сложны, что сильно лимитирует их применение, особенно при острых кровотечениях. Кроме того, являясь по своей сущности паллиативными процедурами, они, как и хирургические операции, могут сопровождаться тяжелыми осложнениями, вплоть до летального исхода. Поэтому термин «малоинвазивный» метод может быть применен к ним лишь условно. Наш многолетний опыт свидетельствует о том, что после установления диагноза «портальная ги-пертензия», что чаще всего происходит в терапевтической клинике, больные должны быть направлены в специализированные отделения как можно раньше до возникновения кровотечения, при котором операция дает более высокую летальность. Опытный эндоскопист должен оценить состояние ВРВ пищевода и желудка и риск развития кровотечения и передать эту информацию клиницисту, который должен решить вопрос о дальнейшей тактике. При наличии показаний к операции хирург должен выбрать метод хирургического пособия, адекватный функциональному состоянию печени, центральной и портальной гемодинамике, что в конечном итоге и определяет выживаемость этой категории больных. Возможность медикаментозной коррекции кровотечений из ВРВ пищевода и желудка, о чем имеется масса сообщений в зарубежной литературе, согласно собственному первому опыту, представляется нам преувеличенной и в настоящее время продолжает нами изучаться. Литература 1. Ерамишанцев А.К Рос. журн. гастроэнтерол., гепатол., колопрок- 2. Пациора М Д., Ерамишанцев А.К Хирургия, 1971.-№ 12.-С. 86-90. С. 39-44. 4. Экк Н.В. Военно-медицинский журнал.- 1877,- №130.- С. 1-2. 5. Talma S. Klin. Chir, 1898,- P. 38. 6. Warren W.D.,FomonJJ.,ZeppaR. Ann. Surg., 1969,-Vol. 169.-P. 652. абдоминальная хирургия Дата добавления: 2015-12-15 | Просмотры: 880 | Нарушение авторских прав |



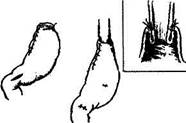


 Вот почему, начиная с I960 г., в нашем отделении операцией выбора у ранее оперированных больных и, как правило, с уже удаленной селезенкой, страдающих рецидивами кровотечения из ВРВ пищевода и желудка, становится резекция проксимального отдела желудка и дистального отдела пищевода (частичная эзофагогастрэктомия), т.е. участков пищеварительного тракта, являющихся в 95% случаев источником кровотечения (рис.1).
Вот почему, начиная с I960 г., в нашем отделении операцией выбора у ранее оперированных больных и, как правило, с уже удаленной селезенкой, страдающих рецидивами кровотечения из ВРВ пищевода и желудка, становится резекция проксимального отдела желудка и дистального отдела пищевода (частичная эзофагогастрэктомия), т.е. участков пищеварительного тракта, являющихся в 95% случаев источником кровотечения (рис.1).


 маркеры цитолиза - находиться в норме. Кроме того, сократительная функция миокарда также должна находиться в пределах нормы. Если имеются небольшие отклонения в биохимических показателях и больной может быть отнесен ближе к группе В или соответствует ей при нормальных показателях сократительной функции миокарда, то следует очень внимательно оценить наличие латентной энцефалопатии, выявление которой является абсолютным противопоказанием к наложению шунта.
маркеры цитолиза - находиться в норме. Кроме того, сократительная функция миокарда также должна находиться в пределах нормы. Если имеются небольшие отклонения в биохимических показателях и больной может быть отнесен ближе к группе В или соответствует ей при нормальных показателях сократительной функции миокарда, то следует очень внимательно оценить наличие латентной энцефалопатии, выявление которой является абсолютным противопоказанием к наложению шунта.