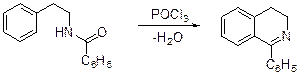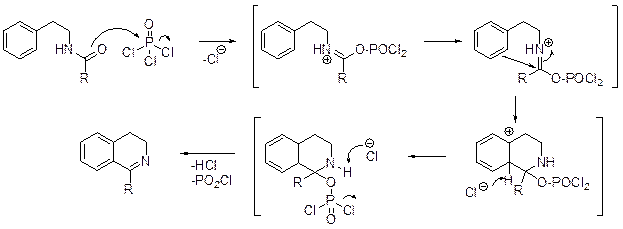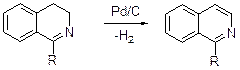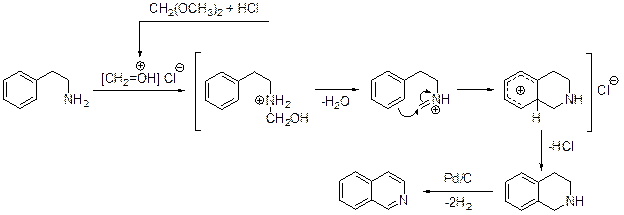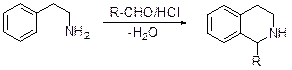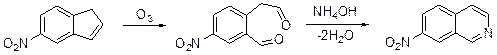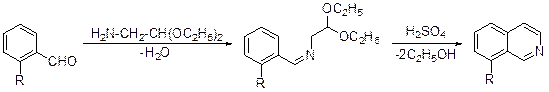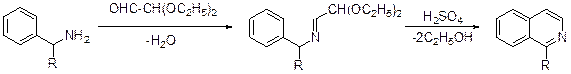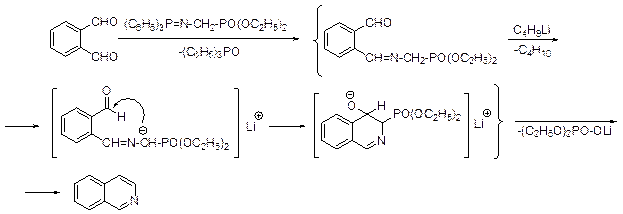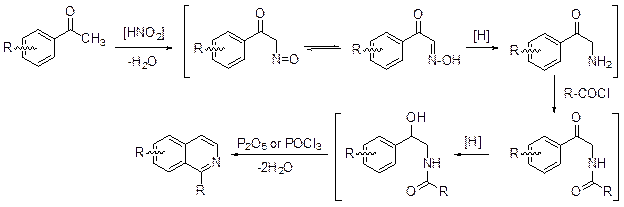|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Двухкомпонентные синтезы.3.3.2.1. Синтезы типа N(2)C(3)C(4)C(4a)C(8a)+C(1).
А.Бишлер и Б.Напиральский (1898) обнаружили, что при обработке b-фенилэтиламида бензойной кислоты, синтезируемого взаимодействием b-фе-нилэтиламина с эфиром бензойной кислоты, оксидом фосфора (V) или хлоридом цинка, получается 1-фенил-3,4-дигидроизохинолин.
Формально эту реакцию можно рассматривать как дегидратацию амида, сопровождающуюся циклизацией, однако механизм реакции Бишлера-Напи-ральского выглядит более сложным.
Дегидрирование 3,4-дигидроизохинолинов осуществляется над палладием, нанесенным на уголь.
Пикте и сотрудники улучшили предложенный метод и показали, что он представляет собой общий препаративный подход к синтезу изохинолинов.. b-Фенилэтиламин является исходным в синтезе изохинолинов по методу А. Пикте – Т.Шпенглера. Конденсация первого с диметилацеталем формальдегида в присутствии концентрированной соляной кислоты приводит в одну стадию к 1,2,3,4-тетрагидроизохинолину, дегидрирование которого дает сам изохинолин.
Гидрокси- и алкоксигруппы в мета -положении бензольного кольца облегчают замыкание цикла. Вместо ацеталя формальдегида в реакции Пикте-Шпенглера можно использовать ацетали других альдегидов или сами альдегиды. В этом случае получаются 1,2,3,4-тетрагидроизохинолины, имеющие заместитель у атома углерода С(1).
3.3.2.2. Синтез типа С(1)C(8а)C(4а)C(4)C(3)+N(2). Синтез этого типа – взаимодействие 1,5-дикарбонильного соединения с аммиаком. Дикарбонильное соединение – гомофталевый диальдегид может быть получен при озонолизе доступного 5-нитроиндана.
3.3.2.3. Синтез типаC(1)C(8a)C(4a)+N(2)C(3). Иной подход к построению изохинолинового цикла предложили Померанц и Фрич. В качестве трехуглеродной компоненты в методе Померанца-Фрича используется замещенный бензальдегид, имеющий свободное орто -положение по отношению к формильной группе и диэтилацеталь аминоуксусного альдегида в качестве двухатомной азотсодержащей компоненты.
Образовавшийся на первой стадии реакции азометин превращается в изохинолин действием 70% серной кислоты.
3.3.1.3. Синтез типаN(2)C(1)C(8a)C(4a)+C(3)C(4). Метод Померанца-Фрича практически непригоден для получения изохинолинов, содержащих заместитель в положении 1, из-за низких выходов соответствующих азометинов. Е.Шлиттлер и И.Мюллер предложили метод, в котором четырехатомной азотсодержащий компонентой является замещенный бензиламин, а двухуглеродной – неполный ацеталь глиоксаля, получаемый из ацеталя акролеина.
Циклизация азометина в изохинолин проходит в присутствии 76% серной кислоты.
3.3.1.3. Синтез типа С(1)С(8а)С(4а)С(4) + N(2)С(3).
Синтез этого типа был разработан под руководством А.Катрицкого сравнительно недавно – в 1993 г. В качестве четырехуглеродной компоненты используется фталевый диальдегид, а в качестве азотсодержащий двухатомной компоненты – диэтил {[(трифенилфосфанилиден)амино]метил}фосфонат.
3.3.1.4. Синтез типа С(3)C(4)C(4а)C(8а)+N(2) + С(1).
Метод, предложенный А.Пикте и А. Гамсом (1909) можно рассматривать как одну из модификаций метода Бишлера-Напиральского. Дегидратация ароилпроизводного a-гидрокси-b-аминоэтилфениламина приводит к полностью ароматизированному изохинолину.
Четырехуглеродным компонентом в синтезе Пикте-Гамса является ацетофенон, который нитрозируют и восстанавливают до амина. Далее следуют ацилирование и восстановление кетонного карбонила до гидроксила. Обработка (b-гидрокси-b-арил)этиламида карбоновой кислоты пентаоксидом фос-фора или оксохлоридом фосфора в толуоле дает замещенный изохинолин.
Дата добавления: 2015-12-15 | Просмотры: 776 | Нарушение авторских прав |