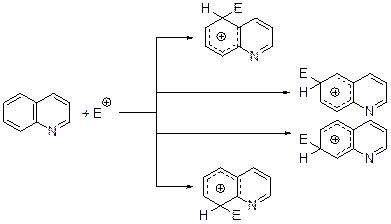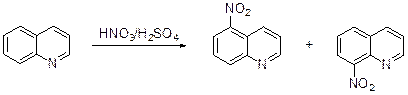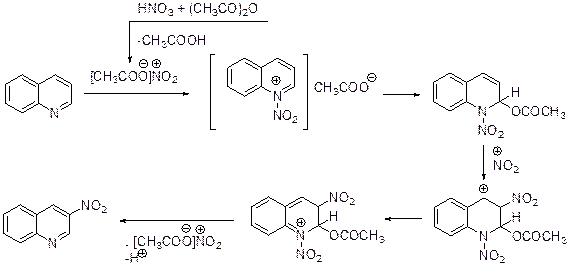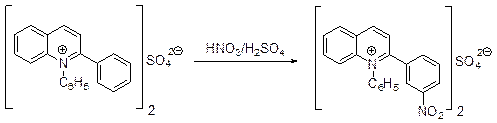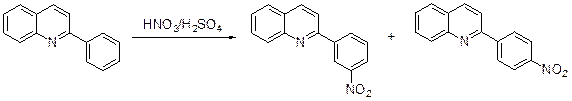|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Реакции электрофильного замещения атома водорода. Хинолины, являясь ароматическими гетероциклическими соединениями, вступают в характерные реакции электрофильного замещения атома водородаХинолины, являясь ароматическими гетероциклическими соединениями, вступают в характерные реакции электрофильного замещения атома водорода. Электрофильное замещение в хинолине протекает легче, чем в пиридине, но труднее, чем в нафталине. Это связано с тем, что атом азота, даже протонированный, дезактивируя гетероциклическую часть молекулы, оказва-ет гораздо меньшее влияние на карбоциклический фрагмент. Как правило, за-мещению подвергаются атомы водорода у С(5) и С(8), что объясняется боль-шей устойчивостью соответствующих σ-комплексов по сравнению с альтернативными.
Если фактор парциальной скорости нитрования бензола принять за 1, то для положений 5 и 8 хинолина аналогичные величины оказались равными 4´10-7.
Нитрование. Хинолин гладко нитруется нитрующей смесью при температуре 0°С, давая с высоким выходом смесь приблизительно равных количеств 5- и 8-нитрохинолинов, которая не содержит заметного количества других изомеров.
Кинетические исследования этой реакции подтверждают, что электрофильной атаке подвергается катион хинолиния. Совершенно иначе протекает нитрование концентрированной азотной кислотой в уксусном ангидриде (фактически ацетилнитратом). Основным продуктом нитрования оказывается, хоть и с небольшим выходом (~6%), 3-нитрохинолин, а также 6-и 8-нитрохинолины, суммарное количество которых не превышает 1% (образование 5-нитрохинолина зафиксировано не было).
Вероятно, имеет место присоединение катиона нитрония к атому азота хинолина, за которым следует присоединение ацетат-аниона в атому углерода С(2). Продукт 1,2-присоединения ацетилнитрата к молекуле хинолина далее вновь атакуется катионом нитрония, который присоединяется к атому С(3). Далее следуют изомеризация интермедиата, депротонирование и элиминирование ацетилнитрата. Нитрование хинолина Ti(NO3)4 или Zr(NO3)4 позволяют увеличить выход 3-нитрохинолина до 87-90%. В сульфате 1-фенил-2-фенилхинолиния нитруется исключительно фенильный заместитель в положении 2, причем гетероциклический фрагмент ведет себя как ориентант второго рода.
2-Фенилхинолин, который в аналогичных условиях частично протонирован, дает смесь 2-(м- нитрофенил)хинолина (40%) и 2-(п -нитрофенил)хи-нолина.
Дата добавления: 2015-12-15 | Просмотры: 890 | Нарушение авторских прав |