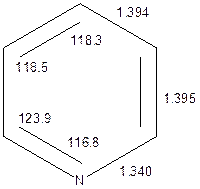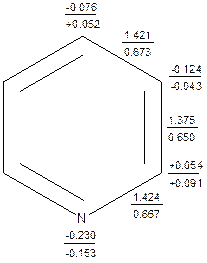|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
СТРОЕНИЕ МОЛЕКУЛЫ ПИРИДИНА. АРОМАТИЧНОСТЬ.Согласно данным микроволновой спектроскопии молекула пиридина планарна и симметрична относительно плоскости проходящей через атомы азота N1 и углерода С4. Длины связей С-С и С-Н в молекуле пиридина очень близки к таковым в молекуле бензола (рис.1.). Длины связей N1-C2 и N1-C6, естественно, короче.
Рис.1. Длины связей (Ǻ) и валентные углы (°) в молекуле пиридина по данным микроволновой спектроскопии.
Симметрия молекулы пиридина предопределяет равноценность атомов С2, С6 и С3, С5. Плоскостное строение молекулы пиридина ассоциируется с sp2 гибридизацией атомов, формирующих цикл. Три sp2 гибридизованных электронных облака атома углерода образуют три σ-связи (две с соседними по циклу атомами и одну - с атомом водорода). У атома азота два sp2 гибридизованных электронных облака используется для связывания с атомами углерода, а одно – представляет собой облако неподеленной электронной пары, ось которого лежит в плоскости молекулы. π-Электронный секстет формируется за счет облаков «чистых» 2рz электронов (по одному от каждого атома). Основное состояние атома азота s2p3. В пиридиновом атоме азота 4 валентных электрона из пяти находятся на sp2-гибридизованных орбиталях и один – на чистой р-орбитали. Таким образом, sp2-гибридизованная орбиталь является на одну треть s- и две трети p-орбиталью (s1/3p2/3), а валентное состояние атома азота с учетом его пяти электронов может быть представлено как s4/3p11/3. Превращение «обычного» атома азота в атом азота пиридинового типа требует промотирования 2/3 электрона с s- на p-орбиталь (в случае пиррольного атома азота необходимо промотирование 1 электрона). Этот анализ позволяет предположить, что энергетически пиридиновый атом азота «выгоднее» пиррольного. Молекула пиридина удовлетворяет правилу Хюккеля в полном объеме и является ароматической. Эмпирическая энергия резонанса для пиридина оценивается величиной от 116.7 до 130 кДж/моль (для сравнения для бензола аналогичная величина составляет 150.2 кДж/моль). Индекс А.Ф.Пожарского для пиридина равен 0.09, что позволяет оценить его ароматичность равную 82% от ароматичности бензола. Дьюаровская энергия резонанса для пиридина равна 89.1 кДж/моль, а индекс РЭНЭ – 14.9 кДж/моль. Все сказанное позволяет считать пиридин достаточно ароматичным соединением. О распределении электронной плотности в молекуле пиридина можно судить по результатам квантово-химических расчетов методом ССП МО ЛКАО в приближении MNDO. (молекулярная диаграмма приведена на рис.2.)
Рис.2. Молекулярная диаграмма пиридина. Цифры у атомов полные заряды/ π-электрон- ные заряды, цифры у связей – полные порядки связей/ π-электронныеэлектронные порядки связей.
Как следует из расчетов наибольшие полные отрицательные заряды локализованы на атомах азота N и β-углеродных атомах. Эти же атомы характe-ризуются и отрицательными π-электронными зарядами. γ-Углеродный атом в целом электроноизбыточен, но имеет положительную π-электронную составляющую заряда. Распределение электронной плотности в нереагирующей мо-лекуле пиридина благоприятствует атаке электрофилом атома азота и атомов углерода С3 или С5. Атомы углерода С2 и С6 в целом электронодефицитны. π-Дефицитны-ми оказались атомы С2, С4и С6. Таким образом объектами нуклеофильной атаки в молекуле пиридина могут быть атомы в α- и γ-положениях. Как оказалось, направление атаки электрофилов и нуклеофилов на молекулу пиридина может быть объяснено характером распределения электрон-ной плотности в нереагирующей молекуле.
Дата добавления: 2015-12-15 | Просмотры: 1038 | Нарушение авторских прав |