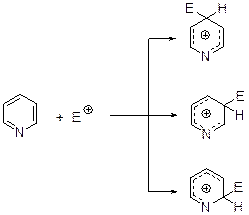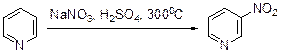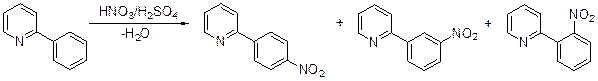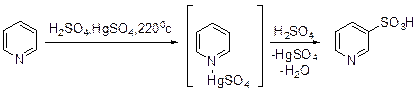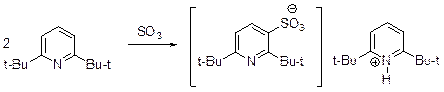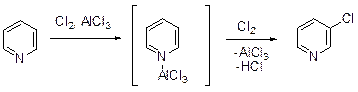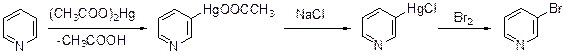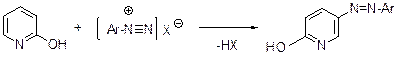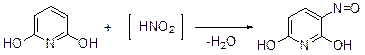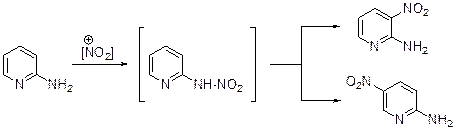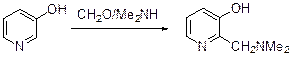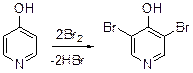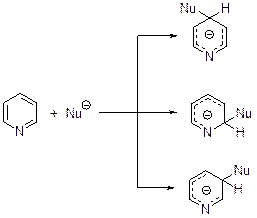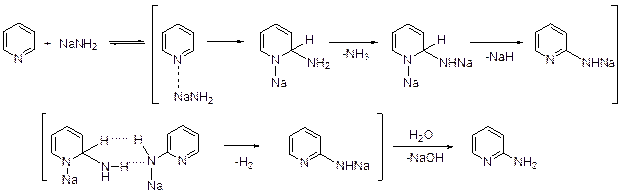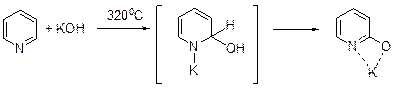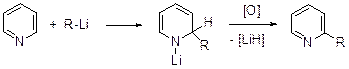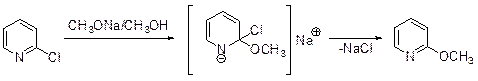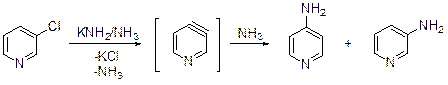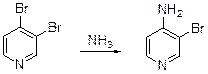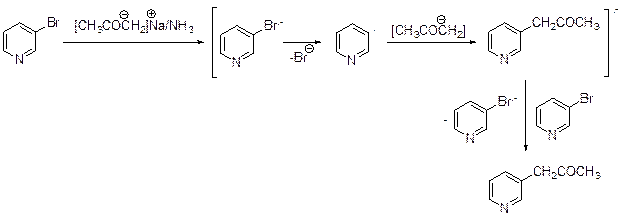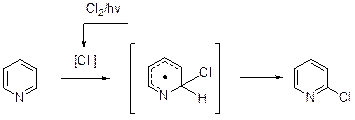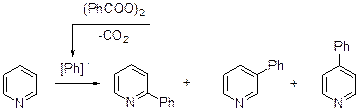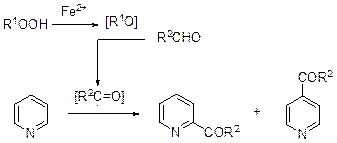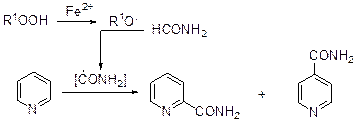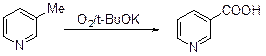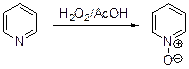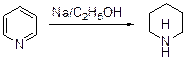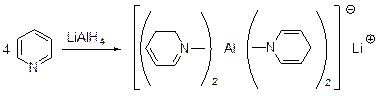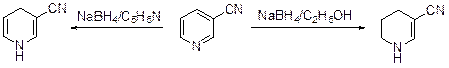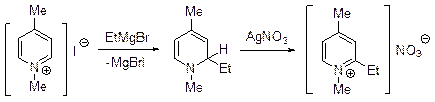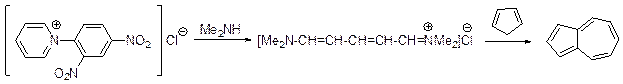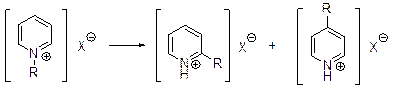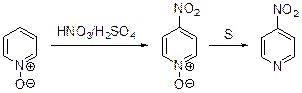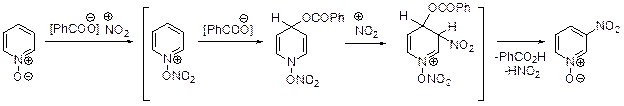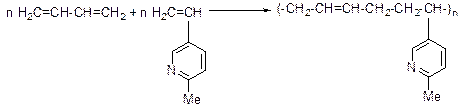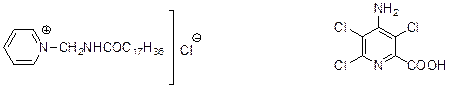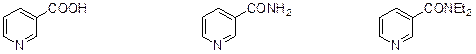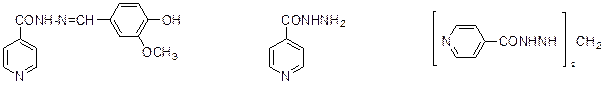|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Реакции электрофильного замещения атома водородаЭлектрофильное замещение атома водорода в пиридине и его производых протекает с большим трудом, что объясняется с одной стороны электроноакцепторным действием атома азота. Если принять парциальный фактор скорости замещения водорода в бензоле за 1, то для пиридина он оказывается равным 10-6. Но поскольку пиридины представляют собой основания, а боль-шинство электрофильных реагентов – это кислоты, то в реакцию чаще всего вступает катион пиридиния, для которого парциальный фактор скорости лежит в интерале 10-18 – 10-20. По этой, вероятно, причине незамещенный пиридин не вступает в реакции Фриделя-Крафтса, Манниха, Геша, не нитрозируется и не реагирует с солями диазония. Как в молекуле пиридина, так и в катионе пиридиния, электрофильной атаке подвергается β-углеродный атом, что объясняют большей устойчивостью соответствующего σ-комплекса и меньшей энергии активации при его образовании.
Как показывают кинетические исследования относительная активность реакционных центров по отношению к электрофилам такова:
С3 > С2 >> С4
Нитрование Их всех типов реакций электрофильного замещения в ряду пиридина наиболее подробно и глубоко изучено нитрование. Нитрование пиридинов с высокой основностью (рКа> 1.0) идет с участием протонированной формы, а слабоосновных (рК < -2.5) – с участием свободного основания. Пиридины, для которых величина рКа меняется в диапазоне от -2.5 до +1.0, нитруются гораздо легче своих аналогов с высокой основностью. Для нитрования пиридина требуются исключительно жесткие условия: нитрат натрия и дымящая серная кислота в качестве нитрующей смеси и тем-пература порядка 300°С.
Но даже в таких условиях выход 3-нитропиридина не превышает 6%. Низкие выходы соответствующих нитропроизводных получены в результате нитрования α-пиколина (5-нитро-2-метилпиридин получен с выходом:%), 2,4-лу-тидина. 2,4,6-Коллидин нитруется нитратом натрия в дымящей серной кис-лоте при 100°С, давая 2,4,6-триметил-3-нитропиридин с выходом 90%. Электронодонорные метильные группы делают гетероцикл более восприимчивым к электрофильной атаке, и хотя в реакцию вступает протонированный субст-рат, парциальный фактор скорости в этом случае увеличивается до 3.5·10-12. Невысокая реакционная способность пиридинового кольца по отношению в электрофильной атаке подтверждается нитрованием 2-фенилпириди-на: в результате реакции образуются 2-(п -нитрофенил)-, 2-(м -нитрофенил)- и 2-(о -нитрофенил)пиридины с выходами 42, 35 и 5%, соответственно.
Сульфирование
Сульфирование пиридина серной кислотой протекает с заметной скоростью при 220°С только в присутствии сульфата ртути в качестве катализатора (без катализатора реакция практически не идет).
Выход пиридин-3-сульфокислоты достаточно высок и достигает 70%. Возможной причиной этого является электронодонорное действие атома ртути, координирующгося с атомом азота. 2,6-Бис(трет -бутил)пиридин сульфируется оксидом серы (VI) с образованием 2,6-бис(трет -бутил)пиридиниевой соли 2,6-бис(трет -бутил)пи-ридин-3-сульфокислоты.
По-видимому, объемные трет -бутильные группы препятствуют координации атомов азота и серы, что делает невозможным образование соответствующего 1-сульфоната.
Галогенирование Электрофильное галогенирование «простых» пиридинов требует жестких условий. Так, 3-хлорпиридин получается с выходом 30-35% при хлорировании пиридина в присутствии большого избытка хлорида алюминия.
Не исключено, что в данных условиях пиридин реагирует в виде комплекса с AlCl3. Бромирование пиридина протекает достаточно легко, если в качестве реагента используется раствор брома в олеуме. Главным продуктом является 3-бромпиридин (выход до 90%), а в качестве побочных продуктов фиксируются дибромпиридины. Эта реакции включают, по-видимому, стадию электрофильной атаки катиона Br+ на комплекс пиридина с оксидом серы (VI).
Меркурирование
Пиридин можно меркурировать, нагревая его с ацетатом ртути при 170-180°С.
Меркурирование дает главным образом пиридин-3-меркурацетат, который можно превратить в меркурхлорид и далее в 3-бромпиридин.
Реакции активированных пиридинов со слабыми электрофилами.
Сильные электронодонорные заместители, находящиеся в пиридиновом кольце, увеличивают воприимчивость последнего к атаке слабых электрофилов. 2-Гидроксипиридин, как азосотавляющая компонента, реагируют с солями диазония с образованием 5-арилазо-2-гидроксипиридина.
Другая характерная реакция активированного ароматического кольца – нитрозирование, по-видимому, не идет с монозамещенными пиридинами. 2,6-Диамино- и 2,6-дигидроксипиридины успешно нитрозируются в положение 3.
Явление ориентации при электрофильном замещении атома водорода в пиридине
Введение заместителя в пиридиновый цикл меняет распределение электронной плотности в последнем, что может повлиять на направление электрофильной атаки. Поскольку пиридиновый цикл является электронодефицитным по сравнению с бензольным, реакции электрофильного замещения в молекуле пиридина, содержащий электроноакцепторный заместитель, неиз-вестны. По этой причине будут рассмотрены реакции пиридинов, содержащих электронодонорные заместители. Электронодонорные заместители (-ОН, -OMe, -NH2), находящиеся в положении 2, «направляют» электрофильную частицу в положения 3,5 или 3 и 5, что можно рассматривать как результат «согласованной» ориентации.
В случае нитрования 2-аминопиридина первоначально образуется соответствующий нитрамин, который затем перегруппировывается в 3- и 5-нитропири-дины. Электронодонорная группа в положении 3 активирует положения 2,4 и 6 пиридинового кольца, т.е. ведет себя как ориентант первого рода. Так, 3-гидроксипиридин иодируется иодидом натрия в присутствии гипохлорита натрия в метаноле с образованием 3-гидрокси-6-иодпиридина, а в условиях конденсации Манниха дает 3-гидрокси-2-диметилминометилипиридин.
В результате бромирования 3-амиропиридина получена смесь 2-бром-, 2,6-дибром- и 2.4,6-трибромпиридинов. Электронодонорная группа в положении 4 активирует положения 3 и 5 пиридинового кольца. 3,5-Дибром-4-гидроксипиридин получен в результате бромирования 4-гидроксипиридина.
Реакции нуклеофильного замещения атома водорода.
Направление нуклеофильной атаки на пиридиновое кольцо определяется с одной стороны распределением электронной плотности в нереагирующей молекуле, а с другой стороны - большей стабильностью аниона, образу-ющегося в результате присоединения нуклеофила к α-углеродному атому.
Аминирование Из реакций этого типа наиболее изучено аминирование по Чичибабину: превращение пиридина в 2-аминопиридин под действием амида натрия. В апротонных средах реакция идет при 100-160°С в течение нескольких часов, в жидком аммиаке (-33°С) процесс может затянуться на неделю. Механизм реакции Чичибабина впервые предложили в 1930 г. Циглер и Цайзер. Соглас-но существующей точке зрения реакция протекает по механизму присоедине-ния-отщепления.
Считается, что взаимодействие начинается с координации атомов азота пиридина и атома натрия, за которой следует присоединение амид-аниона в α-углеродному атому (образование комплекса Циглера). Ключевая стадия реакции Чичибабина – ароматизация интермедиатов. Есть основания полагать, что в этом процессе очень важную роль играет не столько комплекс Циглера, сколько динатриевое производное. Аминопиридины существуют преимущественно в аминоформе, однако протон присоединяется к гетероциклическому атому азота.
Гидроксилирование Введение гидроксильной группы в молекулу пиридина требует очень высоких температур. Так, взаимодействие пиридина с гидроксидом натрия при 320°С приводит с невысоким выходом к натриевому производному α-пиридона.
Алкилирование и арилирование. Введение алкильных и арильных групп в молекулу пиридина возможно действием литийорганических соединений. Реакция с алкил- и ариллитиевыми соединениями состоит из двух отдельных стадий. Литийорганическое соединение легко присоединяется к связи N1-С2 молекулы пиридина с образование литиевой соли 2-замещенного 1,2-дигидропиридина, которую можно выделить.
Для получения 2-замещенного пиридина эту соль необходимо окислить. В случае бензиллития первоначально имеет место 1,4-присоединение этого реагента, что в итоге позволяет получить 4-бензилпиридин.
Своеобразное поведение бензиллития в реакции с пиридином трудно объяснимо.
Реакции нуклеофильного замещения галогенов и других групп.
Галогенпиридины аналогично галогенбензолам реагируют с нуклеофилами по механизмам присоединения-отщепления (АЕ) и отщепления присоединения (ЕА). Реализация того или иного механизма зависит от положения заместителя в кольце пиридина. Так, галогены в 2-галогенопиридинах относительно легко замещаются широким рядом нуклеофилов.
Галоген в положении 4 часто замещается еще легче: константы скорости реакции 2- и 4-хлорпиридинов с этилатом натрия равны, соответственно, 2.2´10-9 и 8.7´10-8 л/моль×сек. Нуклеофильное замещение галогена в положении 3 протекает с меньшими скоростями и часто приводит к смеси продуктов.
45% 25%
По-видимому в случае 3-галогенопиридинов нуклеофильное замещение протекает по механизму SN(EA) (Substitution Nucleophilic Elimination Addition) – замещение по механизму отщепления-присоединения. Используя различную склонность к замещению атомов галогена, находящихся в положениях, например, 3 и 4, можно провести селективное замещение одного их галогенов.
В 1970 году Баннет и Ким, исследуя нуклеофильное замещение галогена в неактивированных аренах, открыли механизм, который назвали SRN1, «замещение радикальнонуклеофильное, мономолекулярное». Позднее этот механизм был «обнаружен» и в ряду других гетероциклов. Необходимое условие протекания реакции – наличие донора электронов.
SRN1 – по существу цепной механизм: первая стадия представляет собой инициирование, а последняя – ее рост. Приведенная здесь реакция лежит в основе препаративного синтеза 3-пиридилацетона.
Реакции радикального замещения атома водорода
Подобно бензолу и другим ароматическим углеводородам пиридин ре-агирует с различными радикалами, давая продукты замещения атома водорода. Данные реакции протекают по механизму присоединения-отщепления (АЕ), что предполагает образование замещенного пиридинильного радикала в качестве интермедиата. Главная особенность таких реакций- преимущественное образования 2-замещенного пиридина.
Считается, что пиридинильный радикал, образовавшаяся в результате присоединения к атому углерода С2 более стабилен по сравнению с альтернативными. Присоединение атакующего радикала к атому С3 пиридина возможно лишь в том случае, когда положения 2 и 4 заняты.
Галогенирование Если проводить галогенирование пиридина при температурах, обеспечивающих гомолитический распад молекул хлора (270°С) и брома (500°С), полученные в результате реакции продукты будут отличаться от соединений, образующихся при более низких температурах.
Основными продуктами реакции является 2-галогенпиридины, а в качестве минорных – 2,6-дигалогенпиридины.
Алкилирование Метильный радикал, генерируемый термолизом пероксида диацетила (или другим способом) в нейтральной среде замещает атом водорода в всех положениях кольца пиридина, что приводит к смеси α-, β- и γ-пиколинов в соотношении 62.7:20.3:17.0%.
2- трет -Бутилпиридин является основным продуктом взаимодействия пиридина с триметилуксусной кислотой в водной серной кислоте в присутствии нитрата серебра и персульфата аммония. Считается, что в данных условиях триметилуксусная кислота расщепляется до трет -бутильного радикала.
Арилирование Из всех реакций радикального арилирования пиридина наиболее изучено фенилирование. Фенильный радикал генерируется из пероксида бензоила, тетрабензоата свинца или солей диазония.
55% 30% 15% Независимо от «источника» фенильного радикала соотношение изомерных фенилпиридинов остается практически постоянным.
Ацилирование С препаративной точки зрения больший интерес представляет ацилирование пиридина. Ацильные радикалы легко генерируются из альдегидов, пероксидов и солей двухвалентного железа.
В результате реакции образуется смесь 2- и 4-ацилпиридинов. В присутствии пероксида водорода и солей двухвалентного железа формамид превращается в карбамоильный радикал, который взаимодействует с пиридином. Эта реакция позволяет получать амиды пиколиновой и изоникотиновой кислот.
Реакции окисления и восстановления.
Пиридиновый цикл достаточно устойчив к действию окислителей. Водный раствор перманганата калия (100°С, запаянная трубка) окисляет пиридин до диоксида углерода. В кислой среде окисление происходит очень медленно, в щелочной – быстрее. Окисление алкилпиридинов приводит к соответствующим кислотам. Так, окислением b-пиколина получают никотиновую кислоту.
Диоксид селена окисляет алкильные группы, находящиеся в a- или g-поло- жениях пиридинового цикла. В результате взаимодействия пиридина с пероксидом водорода образуется пиридин-N-оксид.
Аналогично пиридину с пероксидом водорода реагируют гомологи первого. N-Оксиды пиридина и его гомологов обладают чрезвычайно интересными химическими свойствами, отличающимися от свойств самих пиридинов, а также пиридиниевых солей. Восстановление пиридина водородом «в момент выделения» - при действии натрия на спиртовый раствор первого - приводит к пиперидину (Вышнеградский).
Пиперидин образуется и в результате каталитического гидрирования () пиридина. Пиридин реагирует с алюмогидридом лития с образованием комплекса, в состав которого входят 1,2- и 1.4-дигидропиридины.
Боргидрид натрия восстанавливает только производные пиридина с электроноакцепторными заместителями. Так, нитрил никотиновой кислоты можно превратить 1,4,5,6-тетрагидропиридин-3-карбонитрил или 1,4-дигидропири-дин-3-карбонитрил, если проводить восстановление в этаноле или пиридине, соответственно.
Свойства солей пиридиния
Отличительные особенности солей алкилпиридиния заключаются в высокой склонности к реакциям нуклеофильного присоединения и замещения по a- и g-положениям, иногда сопровождающимся раскрытием цикла, а также в легком отщеплении протона от алкильных групп, находящихся в a- и g-положениях. Соли алкилпиридиния, будучи более электронодефицитными по сравнению с пиридином, реагируют в такими нуклеофилами, как реактивы Гриньяра.
В простейших случаях имеет место присоединение нуклеофильной частицы к атому углерода С2 и образующиеся 2-замещенные 1,2-дигидропиридины могут быть выделены, но что более важно в синтетическом плане, их можно легко окислить. Существует много примеров, когда присоединение нуклеофильного реагента к атому углерода С2 соли пиридиния влечет за собой раскрытие пиридинового цикла, чему способствует наличие электроноакцепторного заместителя у атома азота. В качестве примера можно привести синтез азулена, одной из стадий которого является дециклизация соли Цинке – хлорида 1-2,4-динитрофенилпиридиния.
Соли алкилпиридиния при нагревании до 200-300°С превращаются в с оли 2- и 4-алкилпиридинов в соотношении приблизительно 2:1.
Эта реакция получила название перегруппировки А.Ладенбурга.
Синтез и свойства пиридин-N-оксида.
Пиридин-N-оксид, образующийся в результате окисления пиридина пе-роксидами, нашел достаточно широкое применение в органическом синтезе. Электроноизбыточный атом кислорода, связанный с азотом, делает пиридиновый цикл более восприимчивым к электрофильной атаке. Так, нитрование пиридин-N-оксида нитрующей смесью в сравнительно мягких условиях приводит с высоким выходом к 4-нитропирдин-N-оксиду, нагревание которого с серой или трифенилфосфином позволяет получить 4-нитропиридин.
Нитрование пиридин-N-оксида бензоилнитратом протекает по другой схеме и приводит к 3-нитропиридин-N-оксиду.
Бромирование пиридин-N-оксида
Практическое использование производных пиридина.
Соединения, содержащие пиридиновый цикл, нашли широкое применение в различных областях производства, сельского хозяйства, медицины, науки. Так, продуктом крупнотоннажного производства является 2-метил-5-этилпиридин, дегидрирование которого дает 5-винил-2-метилпиридин. При совместной полимеризации 1,3-бутадиена и 5-винил-2-метидпиридина получают бутадиенвинилметилпиридиновый каучук, из которого изготавливают изделия, отличающиеся устойчивостью к истиранию, и морозостойкостью.
Некоторые производные пиридина используются для синтеза поверхностно-активных веществ, поскольку обладают эмульгирующими и гидрофобизирующими свойствами. Среди представителей подобных веществ можно выделить «зелан» Многие производные пиридина проявляют биологическую активность и применяются в сельском хозяйстве и медицине. Так, 4-амино-3,5,6-три-хлорпиридин-2-карбоновая кислота под торговой маркой «тордон» используется как гербицид.
зелан тордон
Никотиновая кислота и ее незамещенный амид и N,N-диэтиламиды - известные?????? препараты.
никотиновая витамин РР кордиамин кислота Некоторые производные изоникотиновой кислоты завоевали широкую известность как лекарственные средства для борьбы с туберкулезом: фтивазид, тубазид, метазид.
фтивазид, тубазид, метазид
Вопросы для самоконтроля.
1. Методом Ганча получите 2,6-дифенилпиридин. 2. Методом Янца-МакКеллога получите 2,3,4,5-пентаметилпиридин. 3. 4,5-Диметил-1,3-оксазол и акриловую кислоту нагревали в бензоле несколько часов. В результате было получено соединение состава С8Н9NO2. Каковы его структура и название? 4. Предложите схему синтеза и структурную формулу фузариновой кислоты, если в качестве исходных используются 1-этокси-1-гексен, метилвинилкетон и гидроксиламин в качестве источника азота. 5. Какое производное пиридина может быть получено, если в качестве исходных используются метиловый эфир ацетилпировиноградной кислоты и амид циануксусной кислоты? 6. Как называется продукт взаимодействия метиловых эфир ацетилпировиноградной и аминокротоновой кислот? Напишите уравнение реакции. 7. Какое производное пиридина может образоваться в результате взаимодействия 2,5-диметилпиррола с хлороформом в присутствии этилата натрия?
Библиографический список
1. Химическая энциклопедия. 2. Дж.Джоуль, К.Миллс. Химия гетероциклических соединений. М.Мир.2004. 3. Общая органическая химия. Под ред.Д.Бартона и У.Д.Оллиса. Т.8.М.Химия.1985. С.15-117.
ГЛАВА 2. ХИНОЛИН
Хинолин был обнаружен в каменноугольной смоле в 1834 году Ф.Рун-ге, который назвал его лейколом. В 1842 году Ш.Жерар получил хинолин, пе-регоняя хинин со щелочью, а А.Лоран установил его элементный состав. Дж.Дьюар (1870 г.) высказал предположение, что хинолин имеет такое же от-ношение к нафталину, как пиридин к бензолу. Синтетически хинолин был получен В.Кенигсом в 1879 году перегонкой N-аллиланилина над раскаленным оксидом свинца.
Дата добавления: 2015-12-15 | Просмотры: 3088 | Нарушение авторских прав |