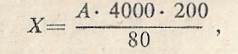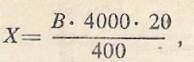|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ФИЗИОЛОГИЯ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
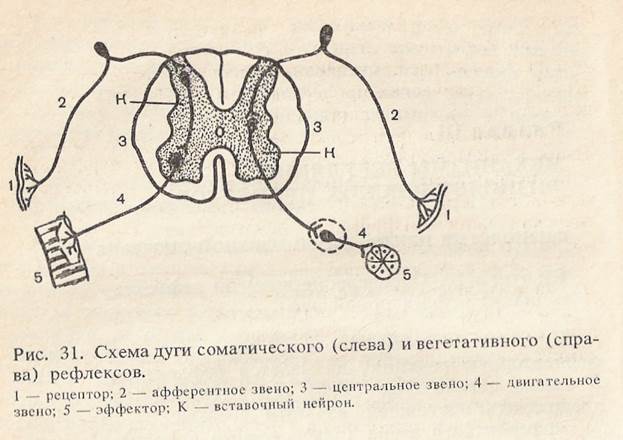
Путь, по которому проходят импульсы, вызывающие рефлекторную реакцию, называется рефлекторной дугой. В самом общем виде схему рефлекторной дуги можно представить состоящей из пяти звеньев: 1) рецептора; 2) афферентного звена (афферентный нейрон); 3) центрального звена (вставочные нейроны); 4) эфферентного звена (эфферентный нейрон); 5) рабочего органа (рис. 31). Для осуществления рефлекса необходима целостность рефлекторной дуги. Выключение любого ее звена ведет к исчезновению рефлекса. Путем последовательного выключения отдельных звеньев возможен анализ функционального значения каждого звена рефлекторной дуги. Для работы необходимо: штатив с крючком, препаровальный набор, лоток, стеклянный крючок, вата, 0,5% и 1% растворы новокаина; 0,5% и 1% растворы серной кислоты, стакан с водой, лягушка. Ход работы. Рефлексы спинного мозга изучают на спинальной лягушке. Для удаления головного мозга в рот лягушки вводят браншу ножниц и отсекают ей голову на уровне большого затылочного отверстия. Нижнюю челюсть при этом оставляют, за нее подвешивают лягушку на крючок штатива. Опыт можно начинать только через несколько минут, когда исчезнут явления спинального шока. Берут стаканчик с 0,5% раствором серной кислоты и погружают в него заднюю лапку лягушки примерно до голеностопного сустава — лапка отдергивается. Таким образом определяется время рефлекса, которое равно времени, прошедшему от момента нанесения раздражения до момента ответной реакции. Установив наличие -защитного рефлекса, серную кислоту с кожи лягушки смывают, погружая лягушку несколько раз в стакан с водой. Это необходимо делать каждый раз после раздражения серной кислотой, внимательно следя за тем, чтобы вода не попадала на разрез мозга. Таким путем определяют время рефлекса, которое будет в значительной степени зависеть от силы раздражителя. Анализ рефлекторной дуги проводят путем выключения отдельных ее звеньев.
Первыми исключаются кожные рецепторы. Для этого делают круговой разрез кожи задней лапки лягушки ниже коленного сустава и снимают ее, как чулок, лишая тем самым лапку кожной рецепции. Важно проследить, чтобы не осталось кожи на кончиках пальцев (если на каком-нибудь из пальцев кожа сохраняется, то можно срезать палец, иначе опыт не удастся). Затем погружают лапку в раствор серной кислоты и убеждаются, что рефлекс исчез. Вторыми исключаются афферентные волокна седалищного нерва. Для этого на другой лапке, с которой не снята кожа, ножницами делают разрез кожи вдоль задней поверхности бедра. Осторожно стеклянным крючком, стараясь не поранить сосуды, отпрепаровывают седалищный нерв и подводят под него лигатуру. Приподняв с помощью лигатуры нерв, подкладывают под него большой ватный фитилек, смоченный новокаином. Седалищный нерв является смешанным: в нем есть и чувствительные (афферентные), и двигательные (эфферентные) волокна. При непосредственном действии новокаина на нервный ствол проведение импульсов вначале прекращается по чувствительным волокнам, а затем по двигательным. Через 1—2 мин после действия новокаина лапку лягушки опускают в кислоту. Убеждаются, что сгибательный рефлекс исчез. Накладывают на кожу спины лягушки бумажку, смоченную 1% раствором серной кислоты. Возникает общая двигательная реакция с участием лапки, нерв которой обработан новокаином. Следовательно, проводимость по чувствительным волокнам исчезла, а по двигательным еще сохранена. При более длительном действии новокаина на нерв теряют проводимость и двигательные волокна. Наложив бумажку, смоченную кислотой, на спинку лягушки через 4—5 мин после начала действия новокаина на нерв, наблюдают, что в наступившей снова общей двигательной реакции лапка с обработанным новокаином нервом не принимает участия. Следовательно, прекратилось проведение импульсов не только по чувствительным, но и по двигательным волокнам. Наступил полный паралич всего нервного ствола. Последними выключаются нервные центры. Их выключение производят путем разрушения спинного мозга зондом. После разрушения спинного мозга никаких рефлексов вызвать не удается. Рекомендации к оформлению работ ы. Зарисуйте схему опыта в тетради. Дайте определение рефлекса и рефлекторной дуги. Назовите звенья рефлекторной дуги и укажите их значение.
Каждый рефлекс имеет свое рецептивное поле, т. е. участок тела, при раздражении которого этот рефлекс возникает. Однако один и тот же участок тела, например кожи, может быть рецептивным полем одного, двух и даже большего количества рефлексов. Характер ответной реакции при раздражении рецептивного поля зависит не только от его местоположения на теле, но и от силы и продолжительности раздражения, а также от функционального состояния нервных центров. Элементарные безусловные рефлексы можно изучать на животном и после удаления головного мозга или отделения его от спинного путем перерезки. Такие реакции называются спинальными рефлексами. Для работы необходимо: штатив, набор препаровальных инструментов, лоток, кусочки фильтровальной бумаги, вата; 0,1%, 0,3%, 0,5% растворы серной кислоты, раствор Рингера, вода, лягушка. Ход работы. У лягушки удаляют головной мозг и получают препарат спинальной лягушки. Выжидают 2—3 мин до исчезновения явлений спинального шока, подвешивают лягушку за нижнюю челюсть к крючку, закрепленному в штативе. Кусочек фильтровальной бумаги смачивают 0,1% раствором серной кислоты и пинцетом помещают на наружную поверхность кожи голени задней лапки. Наблюдают сгибательную реакцию соответствующей конечности. Смывают кислоту, погружая лапку в стакан с водой. Проводят раздражение той же лапки 0,3%, а затем 0,5% растворами кислоты. Выбирают ту концентрацию (силу раздражителя), при которой обнаруживается наиболее четкий сгибательный рефлекс. Бумажку,, смоченную кислотой выбранной концентрации, помещают на боковую поверхность брюшка. Спустя некоторое время наблюдают защитный рефлекс: лягушка сбрасывает раздражающий агент ближайшей лапкой. Накладывают бумажку на наружную поверхность передней лапки, на брюшко, ближе к грудной части, между передними и задними лапками. При этом каждый раз отмечают характер реакции, вызываемой раздражением данного рецептивного поля. Интервалы между раздражениями должны быть не менее 2—3 мин, после каждого раздражения лягушку погружают в стакан с водой и смывают остатки кислоты. Рекомендации к оформлению работы. Зарисуйте схемы рецептивного поля наблюдаемого защитного рефлекса и рефлекторной дуги.
Работа 18. Некоторые особенности функционирования нервных центров спинного мозга
Спинной мозг выполняете основные функции — рефлекторную и проводниковую. Рефлекторная функция спинного мозга связана с локализацией в нем большого количества самых разнообразных нервных центров, осуществляющих контроль за многими двигательными и вегетативными рефлексами.
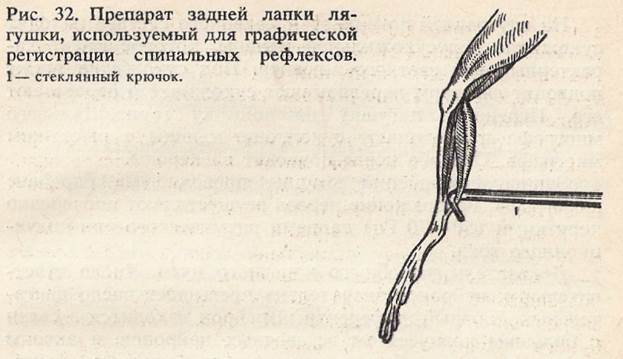
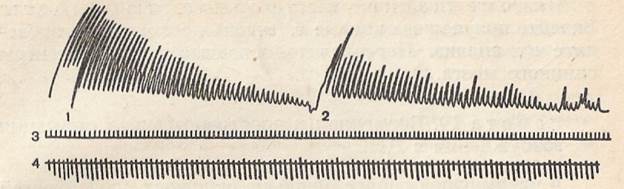
Нервные центры спинного мозга имеют некоторые особенности функционирования: 1) принцип общего конечного пути; 2) инертность нервных центров и способность их к суммации возбуждения; 3) относительная зависимость силы ответной реакции от силы раздражителя; 4) быстрая утомляемость Работа проводится с помощью методики графической регистрации спинальных рефлексов Для работы необходимо: кимограф, 2 стимулятора, провода, 2 пары вилочковых электродов, горизонтальный миограф, препаровальный набор, пипетка, лоток, пробковая дощечка, раствор Рингера, лягушка. Ход работы. У лягушки перерезают спинной мозг на уровне середины лопаток, делая скальпелем одномоментно разрез кожи, позвоночника и мозга. Прикалывают лягушку булавками к деревянной дощечке спинкой вниз. В верхней трети бедра делают круговой разрез кожи, после чего кожу с лапки бедра снимают. Затем перерезают пяточное (ахиллово) сухожилие, и икроножную мышцу отводят в сторону. Под мышцей обнаруживается 2 нерва. Один из них, лежащий на внутренней поверхности икроножной мышцы,— большеберцовый, второй, лежащий на кости голени,— малоберцовый. Под каждый нерв подводят лигатуру, нерв перевязывают как можно дистальнее и перерезают. На лигатуре остается центральный конец нерва (рис. 32). На внутренней поверхности коленного сустава находят сухожилие полусухожильной мышцы, которое имеет характерный вид светлого клювика. Под сухожилие также подводят лигатуру, перевязывают сухожилие и перерезают его. Переносят лягушку на дощечку горизонтального миографа и соединяют сухожилие мышцы с рычажком миографа. Под оба нерва подводят электроды. Запись сокращений мышцы проводят на барабане кимографа. Раздражение нервов осуществляют поочередно короткими (50—70 Гц) залпами ритмического или индукционного тока. Доказательство общего конечного пути. Число чувствительных нейронов значительно превышает число двигательных. Каждый афферентный нейрон находится в связи с большим количеством вставочных нейронов, а аксоны последних подходят к ограниченному количеству двигательных нейронов. Таким образом, двигательный нейрон является общим для различных афферентных путей. Доказательством существования общего конечного пути может служить опыт, в котором показывается, что сокращение полусухожильной мышцы можно вызвать, раздражая разные чувствительные нервы: большой и малый берцовые нервы. Доказательство инертности нервных центров и способности их к суммации возбуждения. Способность суммировать возбуждение присуща всем возбудимым тканям, однако в нервных центрах этот процесс выражен особенно отчетливо. Это объясняется относительно низкой возбудимостью нервных клеток и более продолжительным циклом возбуждения в них. В результате этого одиночные импульсы, приходящие в клетку, вызывают в ней лишь местное нераспространяющееся возбуждение, сопровождающееся, однако, повышением возбудимости. Если последующие афферентные импульсы приходят тогда, когда состояние местного возбуждения еще продолжается, то возбуждения суммируются, и возникает бегущая волна возбуждения, обусловливающая рефлекторную реакцию. В данной работе показывают, что одиночное раздражение чувствительного нерва не вызывает рефлекторного сокращения мышцы, тогда как раздражение, наносимое регулярно и многократно (с частотой несколько десятков герц), вызывает рефлекторное сокращение полусухожильной мышцы. Доказательство относительной зависимости силы ответной реакции (величины рефлекса) от силы раздражителя. Величина рефлекторной реакции находится в прямой зависимости от силы раздражителя. На раздражитель пороговой силы рефлекторное сокращение мышцы минимально, при усилении раздражения в известных пределах сила сокращения увеличивается. Раздражая один из нервов, находят порог раздражения и записывают на кимографе минимальное рефлекторное сокращение мышцы. Увеличивают силу раздражителя и наблюдают увеличение рефлекторного сокращения мышцы. На полученной кривой видно, что в известных пределах сила сокращения мышцы возрастает при увеличении силы раздражителя. Быстрая утомляемость нервных центров (утомление рефлекса) и ее анализ. Если раздражать с интервалом 1—2 с один из афферентных нервов короткими залпами ритмических стимулов и тем самым вызывать короткие рефлекторные тетанические сокращения мышцы, то можно наблюдать, что сила сокращения мышцы постепенно уменьшается и, наконец, в результате развивающегося утомления раздражение перестает вызывать сокращение мышцы. Затем начинают раздражать второй нерв, малоберцо-вый7 и вновь наблюдают сокращение мышцы, что демонстрирует отсутствие утомления в эфферентной части рефлекторной дуги. Во время полного утомления рефлекса двигательный нейрон сохраняет способность к деятельности и способен возбуждаться импульсами, пришедшими с других афферентных путей (рис. 33).
Рис. 33. Кривая, иллюстрирующая утомление рефлекса. 1— кривая утомления полусухожильной мышцы при раздражении малоберцового нерва; 2 — кривая вновь начавшегося сокращения полусухожильной мышцы после перенесения раздражающих электродов на большеберцовый нерв; 3— отметка времени в секундах; 4 — отметка раздражения.
Рекомендации к оформлению работы: Вклейте полученные кривые в тетрадь протоколов и проведите их анализ. Перечислите основные нервные центры спинного мозга.
Работа 19. Временная и пространственная суммация возбуждения в ЦНС В предыдущей работе одной из основных особенностей функционирования нервных центров была названа инертность нервных центров и способность их нейронов к суммации возбуждения. Различают 2 основных механизма этого процесса: временную и пространственную суммацию. Временная суммация возбуждения. Для работы необходимо: стимулятор, 2 провода, операционный столик, препаровальный набор, лоток, салфетка, вата, лягушка. Ход работы. Опыт проводят на таламической лягушке, для чего отрезают лягушке голову позади глаз, а затем кладут на операционный столик. На одной из задних лапок закрепляют электроды, соединенные со стимулятором. Электродами могут служить оголенные концы проводов, идущих от стимулятора. Их обвивают выше и ниже коленного сустава на расстоянии не менее 0,5 см друг от друга. Находят пороговую силу раздражителя. Затем наблюдают реакцию при раздражении с частотой 1 Гц и 20—50 Гц. Рекомендации к оформлению работы. При описании результатов работы обратите внимание на характер изменения двигательной реакции в ответ на раздражение с более высокой частотой. Объясните причину наблюдаемых явлений. Пространственная суммация возбуждения. Для работы необходимо: препаровальный набор, лоток, вата; метроном или секундомер, штатив с крючком и пробкой, 0,1%, 0,3%, 0,5% растворы серной кислоты, стакан с водопроводной водой, лягушка. Ход работы. Таламическую лягушку подвешивают за нижнюю челюсть на крючок, на конец крючка надевают пробку (чтобы лягушка не сорвалась при работе) и оставляют до прекращения кровотечения. Пространственную суммацию можно наблюдать на рефлексе сгибания. Для этого кончики пальцев задней лапки лягушки опускают в кислоту пороговой концентрации и определяют время рефлекса, сосчитав количество ударов метронома (или определив время по секундомеру) от начала погружения пальцев в кислоту до момента отдергивания. Затем, обмыв лапку в стакане с водопроводной водой, определяют время рефлекса при погружении в кислоту всей стопы. Рекомендации к оформлению работы. Отметьте время рефлекса в обоих случаях. Объясните, почему изменяется время рефлекса при погружении в кислоту всей стопы. Дайте схему, объясняющую пространственную и временную суммацию возбуждения.
Работа 20. Иррадиация возбуждения в ЦНС Явление распространения возбуждения в ЦНС носит название иррадиации. В эксперименте иррадиацию можно наблюдать при введении животному стрихнина — блокатора тормозных синапсов ЦНС. Для работы необходимо: штатив с крючком, набор препаровальных инструментов, лоток, тарелка, колпак, шприц с иглой; 0,1% раствор стрихнина, лягушка. Ход работы. Готовят спинальную лягушку. Пинцетом слабо сдавливают кончики пальцев задней лапки. Постепенно усиливая раздражение, отмечают порядок вовлечения в рефлекторную деятельность остальных конечностей. Опыт удается значительно лучше, если лягушку предварительно охладить на льду. Той же спинальной лягушке под кожу спины вводят 0,5 мл 0,1% раствора стрихнина. Наблюдают, что через некоторое время прикосновение вызывает приступы общих судорог, а не защитный рефлекс. Рекомендации к оформлению работы. Зарисуйте схему опыта. Дайте определение процесса иррадиации. Объясните механизм действия стрихнина на ЦНС.
Работа 21. Центральное торможение
Опыт Сеченова. В основе нервной деятельности лежат активные и противоположные по своим функциональным свойствам процессы — возбуждение и торможение. Торможением называется процесс, который ослабляет существующую деятельность или препятствует ее возникновению. Впервые экспериментально процесс торможения в ЦНС наблюдал в 1862 г. И. М. Сеченов в опыте, который получил название «опыт Сеченова». При раздражении поперечных разрезов головного мозга лягушки было обнаружено, что в том случае, когда раздражение наносится на промежуточный мозг, наступает резкое угнетение спинальных рефлексов: лапка лягушки, погруженная в раствор серной кислоты, либо вовсе не отдергивается, либо время рефлекса резко удлиняется. В этом классическом опыте была открыта вторая сторона нервной деятельности — торможение.
Для работы необходимо: штатив с крючком и пробкой, набор препаровальных инструментов, глазная пипетка, вата, зажим Пеана, лоток, 0,1 %, 0,25% и 0,5% растворы серной кислоты, раствор Рингера, стакан с водой, кристаллы каменной соли, лягушка. Ход работы. Лягушку завертывают в салфетку так, чтобы голова ее осталась открытой. Затем ножницами делают небольшой поперечный разрез кожи позади ноздрей. От краев этого разреза проводят два длинных косых разреза до туловища лягушки. Кожный лоскут откидывают, под ним виден просвечивающий через кости черепа головной мозг лягушки. Маленькими ножницами срезают верхнюю часть черепной коробки. Для этого делают небольшой поперечный разрез кости по краю переднего разреза кожи, а затем осторожно (чтобы не повредить мозг), прижимая бранщу ножниц к крышке черепа, срезают ее с двух сторон и обнажают головной мозг. Головной мозг лягушки состоит из 5 отделов, гомологичных отделам головного мозга высших животных (рис. 34). Просушив ватой поверхность мозга и внимательно его рассмотрев, делают скальпелем поперечный разрез мозга сразу же за нижними полюсами полушарий большого мозга. Удаляют из полости черепа части мозга, лежащие кпереди от разреза. Подвешивают лягушку за нижнюю челюсть на крючок и оставляют до прекращения кровотечения. Затем тщательно удаляют сгустки крови, поверхность разреза осторожно просушивают ватным тампончиком и приступают к опыту. Определяют время сгибательного рефлекса задних конечностей лягушки, пользуясь для раздражения 0,25% раствором серной кислоты. На каждой лапке определение проводят 2 раза с интерналом I—2 мин. Время рефлекса при частоте ударов метронома 100 в 1 мин должно лежать и пределах 7—12 ударов. Если оно короче, следует взять более слабую кислоту (0,1% раствор). После каждого определения тщательно обмывают лапку в стакане с водой. Определив время рефлекса, просушивают ватным тампончиком разрез мозга, накладывают на него небольшой кристаллик каменной соли и в течение первой же минуты снова измеряют время рефлекса. Убедившись, что время рефлекса резко удлинилось, например до 25—35 ударов (или лапка в течение 50 ударов не отдернулась, т.е. рефлекс отсутствует), кристаллик соли снимают и промывают разрез мозга раствором Рингера. Примечание: Еcли после наложения кристаллика соли наступают конвульсии, значит соль затекла на нижележащие отделы мозга. Мозг следует промыть, осторожно просушить ваткой и опыт повторить снова. Сеченовское торможение должно наступать при полном покое лягушки. Спустя 5—7 мин после удаления раздражителя снова измеряют время рефлекса и убеждаются, что оно вернулось к исходным показателям. Опыты Гольца. Явление торможения наличного рефлекса раздражением другого рецептивного поля носит название «торможение Гольца». Его можно наблюдать на примере торможения квакательного рефлекса лягушки в результате раздражения другого рецептивного поля — кожи лапки. Ход работы. Для опыта берут лягушку-самца, удаляют конечный мозг (отрезают голову позади глаз), получая так называемую таламическую лягушку. Лягушку берут двумя пальцами за боковые поверхности спинки. Это механическое раздражение вызывает квакательный рефлекс. Зажимают переднюю лапку зажимом Пеана — квакательный рефлекс тормозится. Взаимное торможение спинальных рефлексов. Торможение спинальных рефлексов может возникнуть также при одновременном сильном раздражении рецептивных полей двух рефлексов. Так, если раздражать обе лапки лягушки одновременно, то рефлекторная реакция отсутствует, в то время как то же самое раздражение, но приложенное к одной лапке, вызывает рефлекс. Ход работы. Готовят спинальную лягушку. Спустя 5—7 мин приступают к опыту. Погружают лапку лягушки в 0,5% раствор серной кислоты и наблюдают рефлекс сгибания. С помощью метронома определяют время рефлекса. Затем, погружая лапку в кислоту, одновременно сдавливают другую лапку зажимом Пеана — рефлекс сгибания или не возникает вовсе или время рефлекса удлиняется. Рекомендации к оформлению работы. Запишите схемы опытов и полученные результаты. Объясните, что доказывает опыт Сеченова и раздражением какого отдела головного мозга можно вызвать торможение спинальных рефлексов. Приведите примеры торможения в ЦНС, возникающего при одновременном сильном раздражении рецептивных полей двух рефлексов.
Р а б о т а 22. Исследование рефлекторных реакций человека Основу функций нервной системы — от самых простых реакций до наиболее сложных — составляет рефлекторная деятельность, проявляемая сложным взаимодействием безусловных и условных рефлексов. Безусловными рефлексами называются постоянные и врожденные реакции на различные воздействия из внешней и внутренней среды, осуществляемые через посредство низших отделов ЦНС — спинного мозга, мозгового ствола и подкорковых ганглиев. В клинической практике используются те из них, которые отличаются значительным постоянством. Надбровный рефлекс. Возникает при ударе неврологическим молоточком по краю надбровной дуги. Рефлекторная дуга: глазной нерв (I ветвь тройничного нерва), чувствительное ядро тройничного нерва, двигательное ядро лицевого нерва, лицевой нерв. Ответная реакция — смыкание век. Корнеальный рефлекс. Возникает при осторожном прикосновении ваткой либо мягкой бумагой к роговице над радужной оболочкой. Рефлекторная дуга та же, что и у надбровного рефлекса. Ответная реакция — смыкание век. Нижнечелюстной рефлекс. Возникает при постукивании молоточком по подбородку при слегка открытом рте. Рефлекторная дуга: чувствительные волокна нижнечелюстного нерва (III ветвь тройничного нерва), чувствительное ядро тройничного нерва, двигательное его ядро в мосту, двигательные ветви III ветви тройничного нерва. Ответная реакция — сокращение жевательных мышц. Рефлекс с сухожилия сгибателя верхней конечности. Возникает при ударе неврологическим молоточком по сухожилию двуглавой мышцы в локтевом сгибе. Рефлекторная дуга: мышечно-кожный нерв, V и VI шейные сегменты спинного мозга. Ответная реакция — сокращение мышц и сгибание руки в локтевом суставе. Рефлекс с сухожилия разгибателя верхней конечности. Возникает в результате удара молоточком по сухожилию трехглавой мышцы. Рефлекторная дуга: мышечно-кожный нерв, VII и VIII шейные сегменты спинного мозга. Ответная реакция — сокращение трехглавой мышцы плеча и сгиба-ние руки в локтевом суставе. Коленный рефлекс. Возникает при ударе молоточком по плотной связке надколенника ниже коленной чашечки. Рефлекторная дуга: бедренный нерв, III и IV поясничные сегменты спинного мозга. Ответная реакция — сокращение четырехглавого разгибателя бедра и разгибание голени. Ахиллов рефлекс. Вызывается ударом молоточка по пяточному (ахиллову) сухожилию. Рефлекторная дуга: большеберцовый нерв (ветвь седалищного нерва), I и II крестцовые сегменты. Ответная реакция — сгибание стопы. Для работы необходимо: неврологический молоточек, работа проводится на человеке. Ход работы. 1. Для определения коленного рефлекса испытуемому предлагают сесть на стул и положить ногу на ногу. Наносят легкий удар неврологическим молоточком по сухожилию четырехглавой мышцы. Сравнивают рефлексы слева и справа. 2. Определение ахиллова рефлекса производится у испытуемого, стоящего коленями на стуле. Ступни ног свободно свисают. Неврологическим молоточком наносится легкий удар по пяточному (ахиллову) сухожилию. Отмечают, сгибаются ли стопы. 3. При определении локтевого рефлекса полусогнутая и расслабленная рука испытуемого находится на ладони экспериментатора. Большой палец руки экспериментатора ложится на сухожилие двуглавой мышцы испытуемого. Удар молоточком наносится по большому пальцу испытуемого. Отметить, сгибается ли предплечье. 4. При определении рефлекса с трехглавой мышцы плеча экспериментатор становится сбоку от испытуемого, отводит пассивно его плечо кнаружи до горизонтального уровня и поддерживает его левой рукой у локтевого сгиба так, чтобы предплечье свисало под прямым углом. Удар неврологическим молоточком наносится у самого локтевого сгиба. Отметить, разгибается ли предплечье. Рекомендации к оформлению работы: Дайте определение безусловных рефлексов. Нарисуйте схему соматической рефлекторной дуги. Нарисуйте схемы вегетативных рефлекторных дуг (симпатической и парасимпатической). Обозначьте основные звенья всех перечисленных типов дуг. Отметьте принципиальные различия в структуре соматических и вегетативных рефлекторных дуг.
Работа 23. Изучение статических и статокинетических рефлексов у интактных животных (морской свинки, кролика и лягушки)
Существует 2 типа соматических рефлексов — фазные и тонические. Фазные рефлексы являются орновой сложных координированных локомоторных актов. Они обеспечивают перемещение тела (ходьбу, плавание, бег) или его частей в пространстве. Тонические рефлексы направлены на сохранение естественной позы, т. е. определенной ориентации тела в пространстве, определенного взаимного расположения его частей (у человека — выпрямление позвоночника, стояние на двух ногах, вертикальное положение головы). Они возникают при изменении ориентации головы по отношению к туловищу, при изменении позы, а также в случае перемещения тела в вертикальной или горизонтальной плоскостях как по прямой, так и по кругу. Тонические рефлексы в свою очередь подразделяются на статические и статокинетические. Наиболее выражены они у децеребрированных животных. Статические рефлексы возникают при пассивных и активных изменениях положения тела, не связанных с его перемещением в пространстве. К их числу относятся рефлексы положения (позно-тонические) и выпрямительные. Позно-тонические рефлексы возникают при изменениях положения головы по отношению к туловищу. В этих условиях в связи с перемещением центра тяжести тела появляется опасность нарушения равновесия. Одновременно раздражаются отолитовый аппарат вестибулярного анализатора, проприорецепторы мышц и сухожилий, а также кожные рецепторы шеи, что и дает начало позно-тоническим рефлексам. Эти рефлексы приводят к перераспределению тонуса мышц шеи, туловища и конечностей, что обеспечивает поддержку той части тела, куда сместился центр тяжести.
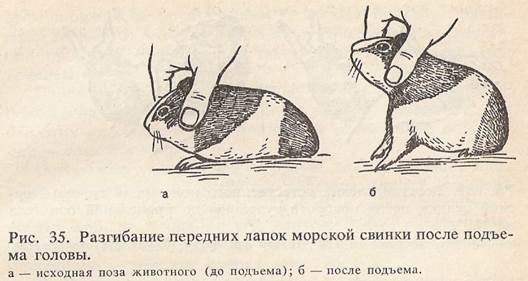
При активных поворотах головы перераспределение мышечного тонуса создает базу для последующего перемещения всего тела. Поэтому у хорошо тренированного спортсмена поворот головы всегда предшествует повороту туловища. Если же с помощью гипсового воротника его исключить, то движения туловища утрачивают быстроту и точность. Убедиться в существовании позно-тонических рефлексов можно у различных животных. Для работы необходимо: салфетка из полиэтиленовой пленки, морская свинка. Ход работы. 1. Сажают морскую свинку на салфетку из пленки и изучают ее естественную позу. Передние и задние лапки у нее согнуты и приведены к туловищу, голова ориентирована теменем кверху; голова, шея и туловище располагаются по продольной оси тела. 2. Взяв морскую свинку за мордочку, поднимают ее голову вверх. Отмечают, что в этих условиях передние лапки животного разгибаются (рис. 35), задние же остаются согнутыми, что обусловлено особенностями позы, типичной для данного вида животных. Выпрямительные рефлексы возникают при нарушении нормальной позы, например при повороте тела на 90° или на 180° (положение на боку или на спинке). Они представляют собой цепь тонических рефлексов, направленных на восстановление нормальной позы.
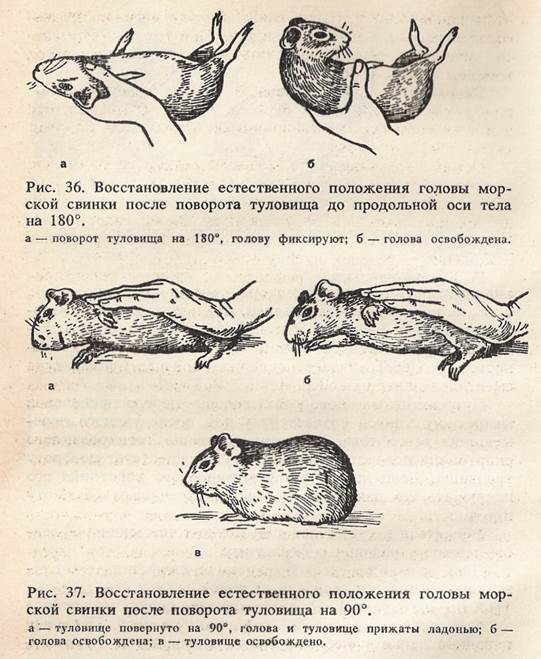
Для работы необходимо: салфетка из полиэтиленовой пленки, морская свинка. Ход р а б о т ы. А. Выпрямительный рефлекс с отоли-тового аппарата вестибулярного анализатора на мышцы шеи у морской свинки. Поднимают животное вверх, придерживая за плечевой пояс; затем поворачивают туловище на 180°, голова при этом направлена теменем книзу. Голову вначале прижимают пальцами, затем освобождают. При этом она стремится принять нормальное положение — поворачивается теменем кверху (рис. 36, а).
Переводят туловище морской свинки в вертикальное положение головой вниз, беря ее за таз. Отмечают, что и в этих условиях голова принимает нормальное положение — теменем кверху. Осторожно укладывают морскую свинку на один бок, прижимая голову и туловище ладонью (или дощечкой) к плоскости опоры; удерживают ее в этом положении до тех пор, пока она не успокоится. Затем голову освобождают. Отмечают, что она также принимает нормальное положение — теменем кверху (рис. 36, б). Б. Выпрямительные рефлексы с проприорецепторов мышц и сухожилий шеи, проприорецепторов и кожных рецепторов туловища на мышцы туловища и конечностей у морской свинки. Повторяют предыдущий опыт. Укладывают морскую свинку на один бок, прижимая голову и туловище ладонью. Затем освобождают голову и плечевой пояс: голова немедленно поворачивается теменем кверху, а за нею и передняя часть туловища. После этого освобождают заднюю часть туловища. Отмечают, что свинка принимает естественную позу, приподнимаясь на лапках и поворачивая туловище на 90° спинкой кверху (рис. 37). Поднимают морскую свинку вверх, поворачивают ее спинкой книзу и отпускают, предоставляя возможность свободного падения. Голова животного тут же принимает исходное положение; вслед за ней поворачивается передняя часть туловища и передние лапки, а затем таз и задние лапки. Животное переворачивается в воздухе на 180° и приземляется на все четыре лапки. Рекомендации к оформлению работы. Опишите наблюдаемые статические рефлексы. Укажите назначение позно-тонических и выпрямительных рефлексов. Статокинетические рефлексы возникают в результате активного или пассивного перемещения тела в пространстве и направлены на сохранение равновесия. В зависимости от характера движения эти рефлексы подразделяются на 2 группы. Одни возникают под влиянием линейного ускорения во время поступательного движения, другие — под влиянием углового ускорения во время вращения. I. Статокинетические рефлексы, возникающие под влиянием линейного ускорения. К рефлексам этого типа относятся рефлексы спуска и подъема («лифтные»), а также рефлексы приземления. Они обусловлены раздражением рецепторов отолитового аппарата и отчасти рецепторов полукружных каналов. В начале подъема под действием положительного ускорения происходит непроизвольное сгибание конечностей и опускание головы и туловища; в конце подъема под действием отрицательного ускорения наступает разгибание конечностей, голова и туловище при этом приподнимаются. При спуске описанные выше реакции сменяют друг друга в обратной последовательности. Это и есть «лифтные» рефлексы.
Рефлекс приземления возникает в безопорной фазе вертикального прыжка. Когда животное находится в воздухе, его конечности разгибаются и направляются вперед, готовясь принять на себя тяжесть тела. Упав, оно пружинит конечностями и этим предохраняет голову и туловище от удара о землю. Убедиться в существовании «лифтных» рефлексов и рефлекса приземления можно на морской свинке и кролике. Для работы необходимо: дощечка размером 10X10 см, салфетка из полиэтиленовой пленки, морская свинка, кролик. Ход работы. Помещают морскую свинку на площадку и изучают ее позу: передние и задние лапки у нее согнуты, голова приподнята (рис. 38, а). Быстро перемещают свинку вместе с площадкой то вверх, то вниз. При этом наблюдают, как именно меняется положение ее туловища, головы, лапок. Отмечают, что в начале быстрого спуска передние и задние лапки у свинки выпрямляются, а туловище и голова приподнимаются (рис. 38, б). В момент внезапной остановки в конце спуска лапки сгибаются, голова и туловище прижимаются к плоскости опоры (рис. 38, в). При подъеме описанные выше рефлекторные реакции чередуются в обратном порядке. Приподнимают морскую свинку и удерживают ее в воздухе: лапки ее полусогнуты и свисают. Затем быстро продвигают ее по направлению к земле. Отмечают, что во время движения передние и задние лапки животного разгибаются и вытягиваются вперед, а пальцы расходятся веером. Это и есть рефлекс приземления. Аналогичные изменения в положении конечностей наступают у кролика и морской свинки, если посадить их на стол и быстро продвинуть вперед (рис. 39).
II. Статокинетические рефлексы, возникающие под влиянием углового ускорения. Убедиться в существовании статокинетических рефлексов на положительное и отрицательное угловое ускорение удобно на лягушке. Для работы необходимо: вращающийся стул, большая воронка, таз с водой, лягушка. Ход работы. 1. Наблюдают за характером статокинетических рефлексов, возникающих у лягушки в период неравномерного вращения. Для этого ее сажают на вращающийся стул, покрывают сверху большой воронкой и быстро вращают. Отмечают, что в начале вращения, когда сказывается действие положительного углового ускорения, голова лягушки поворачивается в сторону, противоположную направлению вращения. Вслед за головой в ту же сторону изгибается туловище. Нередко удается наблюдать, как, реагируя на положительное угловое ускорение, лягушка ползет по кругу в сторону, противоположную направлению вращения. После окончания вращения у лягушки восстанавливается исходная поза. 2. Опускают лягушку в таз с водой, ставят таз на вращающийся стул. Отмечают, что во время вращения лягушка уплывает в противоположную вращению сторону. Рекомендации к оформлению работы. Перечислите известные Вам статические и статокинетические рефлексы. Укажите их рецептивные поля и значение.
Работа 24. Роль различных отделов головного мозга в осуществлении сложных локомоторных актов у лягушки
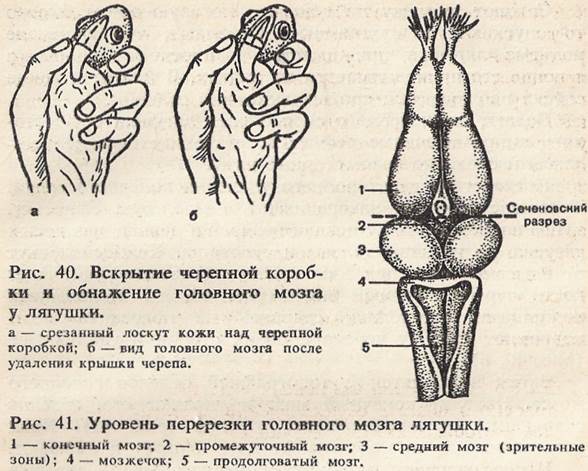
Для выяснения роли различных отделов головного мозга в регуляции тонуса скелетных мышц обычно используют методы перерезок и экстирпаций. С их помощью у разных классов позвоночных животных были выявлены общие черты, а также некоторые особенности в механизмах центральной регуляции мышечного тонуса. В частности, оказалось, что удаление у лягушки высшего отдела ЦНС — конечного мозга — существенно не отражается ни на позе, ни на способности животного производить сложные координированные двигательные акты. В отличие от лягушки у обезьяны и человека удаление полушарий большого мозга ведет к отчетливым расстройствам движений. Однако булъбарные лягушки утрачивают способность поддерживать естественную для них позу сидения. Тем не менее у таких лягушек сохраняется один из выпрямительных рефлексов — рефлекс переворачивания со спинки на живот. У млекопитающих он осуществляется при обязательном участии среднего мозга. Для работы необходимо: препаровальный столик, деревянный брусок размером 2X8X12 см, площадка, вращающаяся вокруг вертикальной оси, большая стеклянная воронка, тарелка, набор хирургических инструментов, нитки, таз с водой, две лягушки. Ход работы. Наблюдают за естественной позой лягушки, ее реакциями на болевое раздражение, способностью осуществлять сложные локомоторные акты. Отмечают, что голова ее ориентирована теменем кверху, голова и туловище расположены по продольной оси тела, задние лапки согнуты, передние разогнуты. В ответ на раздражение задней лапки лягушка совершает прыжок — сложный локомоторный акт. Она способна осуществлять целенаправленные движения и самостоятельно. Сажают лягушку на брусок, который затем медленно переводят из горизонтального положения в вертикальное и обратно. Отмечают, что в этих условиях, стремясь сохранить равновесие, лягушка переползает с одной грани бруска на другую. Поворачивают лягушку на 180° по продольной оси тела и кладут на спину. Она переворачивается и принимает нормальную позу. Вращают лягушку с ускорением в горизонтальной плоскости. Во время вращения лягушка поворачивает голову в сторону, противоположную направлению вращения. В ту же самую сторону изгибается и ее туловище. Сажают лягушку на дощечку, которую затем быстро то опускают, то поднимают. Отмечают, что в начале подъема лягушка прижимается к плоскости опоры, а в конце его приподнимается на лапках. В начале и конце спуска наблюдаются противоположные реакции. Делают заключение о способности лягушки осуществлять выпрямительные рефлексы, статокинетические рефлексы и сложные локомоторные акты. Последствия двустороннего удаления конечного мозга. Туловище лягушки заворачивают в марлевую салфетку, затем надрезают кожу позади ноздрей и делают два косых разреза до границы головы и туловища. Кожный лоскут откидывают вниз, под ним виден просвечивающий через кости черепа головной мозг (рис. 40, а). Маленькими ножницами осторожно, стараясь не повредить мозг, подрезают крышку черепа с обеих сторон и удаляют ее (рис. 40, б). Затем знакомятся с топографией отделов головного мозга. Находят конечный мозг и удаляют его, отделив скальпелем от нижележащих отделов (рис. 41). Края разрезанной кожи подтягивают друг к другу и сшивают.
После операции лишенная конечного мозга лягушка сидит неподвижно, но через 15—30 мин ее двигательная активность восстанавливается и она принимает нормальную позу. Если отвести заднюю лапку лягушки в сторону, то она подтягивает ее к туловищу; на сильное болевое раздражение лапки лягушка отвечает либо прыжком, если она находится на суше, либо уплывает, если она помещена в воду. Поглаживание кожи на боковой поверхности туловища вызывает квакание. Таким образом, у лишенной конечного мозга лягушки сохраняется нормальная поза и способность совершать сложные локомоторные акты. Кроме того, у такой лягушки сохраняются выпрямительные рефлексы, а также рефлексы на угловое ускорение. Последствия двустороннего удаления мозжечка, среднего, промежуточного и конечного мозга. Для этого опыта используют другую лягушку. Сначала устанавливают ее способность совершать перечисленные выше тонические рефлексы и сложные локомоторные акты. Затем обнажают мозг, отделяют зрительные доли и мозжечок от продолговатого мозга и удаляют их вместе с промежуточным и конечным мозгом, в результате чего у лягушки остаются только продолговатый и спинной мозг (так называемая бульбарная лягушка). Останавливают кровотечение ватными тампонами, прикрывают мозг лоскутом кожи и помещают лягушку под стеклянный колпак. Через 20— 30 мин повторяют описанные выше наблюдения, используя те же критерии. Убеждаются в том, что у бульбарной лягушки поза при посадке неправильная, голова ее опущена вниз, туловище прижато • к плоскости опоры. Лягушка утрачивает способность совершать почти все сложные локомоторные акты, все статокинетические и почти все статические рефлексы. Она не реагирует прыжком на болевое раздражение (хотя лапки ее приходят в движение), не совершает плавательных движений в воде в ответ на щипок, утрачивает способность сохранять равновесие и переползать с одной грани бруска на другую и потому падает, если брусок, на котором она сидит, перемещают из горизонтального положения в вертикальное. У бульбарной лягушки отсутствуют «лифтные» рефлексы и рефлекс противовращения. У нее сохраняется лишь один тонический выпрямительный рефлекс — рефлекс переворачивания: перевернутая на спинку лягушка, хотя и с нескольких попыток, но все же переворачивается на живот и принимает естественное положение. Последствия удаления продолговатого мозга у бульбарной лягушки. Для опыта используют бульбарную лягушку предыдущего опыта. Острым скальпелем делают разрез на уровне лопаток и отделяют продолговатый мозг от спинного: животное становится спинальным. Через 5—10 мин (по прошествии спинального шока) приступают к опыту. У спинальной лягушки поза отсутствует: голова и туловище распластаны на плоскости опоры, мышцы конечностей расслаблены. Исчезает последний статический выпрямительный рефлекс: положенная на спинку лягушка больше не переворачивается. Сохраняется лишь минимальный мышечный тонус, способность отвечать на раздражение кожи туловища и конечностей простыми сегментарными рефлекторными актами — сгибанием, разгибанием, потиранием и т. п. Рекомендации к оформлению работы. Изобразите схематически головной мозг лягушки, обозначьте его отделы и места перерезок. Укажите значение различных отделов головного мозга в регуляции мышечного тонуса и в осуществлении локомоторных актов у лягушки.
Работа 25. Определение локализации функций в продолговатом мозге лягушки При изучении локализации функций в ЦНС, в том числе и головном мозге, с давних пор используют методы раздражения, экстирпаций, перерезок мозга на разных уровнях, отведения биоэлектрических потенциалов и т. п. Наиболее простым является метод локального электрического раздражения; в силу этого он применяется не только в остром и хроническом экспериментах, но и при операциях на мозге у человека. Ознакомиться с методом локального электрического раздражения продолговатого мозга и установить функциональную неоднозначность различных его отделов можно достаточно просто на мозге лягушки. Для работы необходимо: электронный стимулятор, два электрода: пластинчатый (индифферентный) и игольчатый (активный), препаровальный набор, лоток, марлевая салфетка, ватные тампоны, лягушка. Ход работы. У лягушки разрезают и удаляют кожу с поверхности черепной коробки; осторожно, стараясь не повредить мозг, вскрывают полость черепа. С помощью острого скальпеля полностью перерезают мозг по задней границе мозжечка и одномоментно удаляют его вместе с конечным, промежуточным и средним мозгом. Затем подсушивают оставшийся продолговатый мозг ватными тампонами и помещают лягушку спинкой кверху на мокрую металлическую пластинку, являющуюся индифферентным электродом. Готовят стимулятор для раздражения продолговатого мозга одиночными ударами. С этой целью подбирают пороговый ток, прикладывая активный игольчатый электрод к мышцам головы. Затем приступают к опыту. Касаются игольчатым электродом различных участков продолговатого мозга. Наблюдают за характером ответной реакции животного. В переднем отделе продолговатого мозга находят участки, раздражение которых вызывает мигание и западание глазных яблок. В среднем его отделе находят участки, раздражение которых ведет к сокращению мышц диафрагмы рта, что вызывает ее перемещение вверх и вниз. Рекомендации к оформлению работы. Нарисуйте схему установки для раздражения продолговатого мозга у лягушки. Перечислите известные сегментарные и надсегментарные центры продолговатого мозга.
ГОРМОНАЛЬНАЯ РЕГУЛЯЦИЯ ФИЗИОЛОГИЧЕСКИХ ФУНКЦИЙ
Работа 26. Действие адреналина на зрачок энуклеированного глаза лягушки
Адреналин — гормон мозгового вещества надпочечников. При введении адреналина в кровеносное русло или при закапывании его в глаз происходит расширение зрачка. Тот же эффект наблюдается при действии адреналина на энуклеированный глаз. Для работы необходимо: препаровальный набор, лоток, глазная пипетка, 2 стеклянных или фарфоровых чашечки, полоска миллиметровой бумаги, раствор адреналина 1:1000, лягушка. Ход работы. Обезглавливают лягушку разрезом верхней челюсти за глазными яблоками. Разрушают зондом спинной мозг. Удаляют оба глаза. В две небольшие чашечки наливают по 5 мл раствора Рингера. Каждый глаз помещают в отдельную чашечку и ставят их на яркий свет. Измеряют диаметр зрачка каждого глаза с помощью миллиметровой бумаги. В одну из чашек прибавляют 3 капли раствора адреналина 1:1000. Через 25—30 мин исследуют величину зрачка каждого глаза. Устанавливают, что зрачок глаза, помещенного в раствор с адреналином, значительно больше по размерам зрачка второго глаза, находящегося в чистом растворе Рингера. Рекомендации к оформлению работы. В тетради для ведения протоколов зарисуйте два глаза в виде кружков, в центре каждого изобразите зрачок в виде круга с разными диаметрами, соответствующими размерам зрачка в миллиметрах до и после действия адреналина.
Работа 27. Влияние избытка инсулина на белых мышей
Инсулин вырабатывается 6-клетками эндокринной части поджелудочной железы (островки Лангерганса). Гормон представляет собой полипептид, состоящий из двух цепей, одна из которых содержит 21, а другая 30 аминокислотных остатков. Одним из физиологических эффектов инсулина является поддержание концентрации сахара в крови на определенном уровне. В организме человека и Других позвоночных инсулин является единственным гормоном, который снижает уровень сахара в крови. Если после введения чрезмерно высокой дозы инсулина уровень сахара в крови падает ниже 2,250 ммоль/л, то нарушается снабжение глюкозой головного мозга и развивается гипогликемический шок. Для работы необходимо: 2 стеклянных колпака, корнцанг, туберкулиновый шприц, шприц на 1 мл, инсулин, 10% раствор глюкозы, 2 белые мыши одинаковой массы (лучше менее 20 г), голодавшие 24 ч. Ход работы. Опыт проводят на двух мышах, голодавших в течение 24 ч. Каждой мыши под кожу вводят 1 ЕД инсулина и помещают ее в отдельную стеклянную банку. Одной мыши сразу же вводят внутрибрюшинно 1 мл 10% раствора глюкозы. Наблюдают за состоянием и поведением животных. Через 40—60 мин у мыши, получившей инсулин без глюкозы, появляются признаки гипогликемического шока (необычная поза, учащение дыхания, вздыбливание шерсти, нарушение координации движений, клонические судороги). Чем выше температура, при которой содержатся мыши, тем действие инсулина развивается быстрее. Приступ судорог может продолжаться около 20 с и дольше и привести к гибели животного. Внутрибрюшинное введение такому животному 1 мл 10% раствора глюкозы через несколько минут приводит к восстановлению нормального состояния. У мыши, которой раствор глюкозы был введен сразу же после инъекции инсулина, судорог и других признаков гипогликемического состояния не наблюдается. Рекомендации к оформлению работы. В тетради опишите все изменения состояния животного после введения ему инсулина, а затем глюкозы. Отметьте время наступления гипогликемического шока и устранения его введением глюкозы. Объясните механизм поддержания уровня сахара в крови.
Раздел IV
ВНУТРЕННЯЯ СРЕДА ОРГАНИЗМА. СИСТЕМЫ, ОРГАНЫ И ПРОЦЕССЫ, УЧАСТВУЮЩИЕ В ПОДДЕРЖАНИИ ЕЕ ПОСТОЯНСТВА КРОВЬ
Работа 28. Получение крови для анализа
Получение крови из уха кролика (хронический эксперимент). Для решения ряда экспериментальных задач необходим регулярный забор крови у животных, например у иммунизированных кроликов, для получения иммунных сывороток. С этой целью кровь берут из краевой вены уха кролика. Метод забора крови из краевой вены уха кролика не сложен. Для работы необходимо: пинцет, бритва, стаканчик или пробирки, вата, кролик. Ход работы. Забор крови производят без наркоза, на интактном животном. Кролика предварительно напоить. Пинцетом выщипывают шерсть по краю уха кролика. Через кожу хорошо видна краевая вена. Бритвой делают надрез вдоль вены, собирают кровь в сосуд. После получения необходимого объема крови (не более 70—80 мл за один раз) область надреза зажимают ватным тампоном. Рекомендации к оформлению работы. Зарисуйте топографию краевой вены уха кролика. Получение крови из сонной артерии кролика (острый эксперимент). При выполнении ряда физиологических, биохимических, иммунологических и других работ необходим тотальный забор крови у животных. У кролика это производят непосредственно из сонной артерии. Для работы необходимо: станок для фиксации кролика, пинцет, зажим, ножницы, стеклянные крючки, шприц, полиэтиленовая трубочка, стаканчик или пробирки, 2% раствор новокаина, нитки, бинты, кролик. Ход работы. Кролика фиксируют за конечности брюшной стороной вверх. Подкожно в область шеи вводят 2 мл 2% раствора новокаина. Выстригают шерсть на шее. Спустя 5 мин после введения новокаина делают разрез на шее по средней линии. Кожу отсепаровывают в стороны, вводят 2 мл 2% раствора новокаина внутримышечно в шейные мышцы. Кроме того, орошаются раствором новокаина мышцы. Их отсепаровывают в стороны, при необходимости подрезают. Сонную артерию, находящуюся между трахеей и веной, отсепаровывают на длину 2— 4 см и перевязывают ближе к голове, а ближе к сердцу подводят лигатуру и накладывают зажим. Надрезают артерию между перевязкой и зажимом и вставляют в нее полиэтиленовую трубочку, срезанную под углом. Закрепляют трубочку лигатурой. Свободный конец трубочки опускают в пробирку и снимают зажим. Заполняют несколько центрифужных пробирок. При кровопотере у кролика могут начаться судороги, поэтому его необходимо удерживать руками. Количество крови у млекопитающих составляет 1/1 часть массы тела. Поэтому у кролика весом около 2 кг содержится около 150 мл крови, но практически можно получить не более 100 мл. Рекомендации к оформлению работы. Зарисуйте топографию сонной артерии. Получение крови у человека. В клинической практике и при решении ряда экспериментальных задач необходим регулярный забор крови у человека. С этой целью кровь берут из пальца руки. Для работы необходимо: скарификатор, вата, спирт, эфир, йод. Ход работы. Дающий кровь садится боком к столу и кладет руку на стол ладонью кверху. Кожу концевой фаланги IV пальца тщательно протирают спиртом, а затем эфиром. Перед проколом кожа должна быть сухой. Сдавливают мякоть концевой фаланги с боков и быстрым резким движением стерильного скарификатора прокалывают кожу. Глубина прокола должна быть такой, чтобы кровь выступала без надавливания. Первую каплю крови стирают, следующую используют для анализа. Капля не должна растекаться по коже. Рекомендации к оформлению работы. Обьяснитс преимущество IV пальца для взятия крови.
Работа 29. Получение плазмы и сыворотки крови
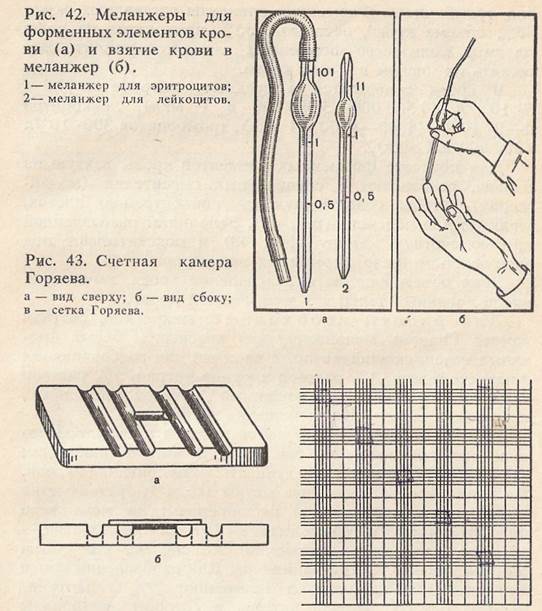
Получение плазмы. Ряд исследований как в клинике, так и в эксперименте проводится с плазмой крови. Например, изучается свертывающая система крови в тестах определения времени рекальцификации плазмы, толерантности плазмы к гепарину и т. д. Для работы необходимо: стеклянный стаканчик, пробирки, весы для уравновешивания пробирок, центрифуга, пенициллиновые флаконы, стеклограф, цельная кровь; 3,8% раствор цитрата натрия. Ход работы. Кровь кролика собирают в стеклянный стаканчик с 3,8% раствором цитрата натрия (соотношение консервант/кровь—1:9). Кровь разливают по центрифужным пробиркам и уравновешивают их. Центрифугируют при 1000 об/мин 20 мин. Надосадок (плазму) переносят в пенициллиновые флаконы и используют для дальнейших исследований. Рекомендации к оформлению работы. Запишите основные константы плазмы крови. Получение сыворотки. Сыворотка крови необходима при выполнении многих физиологических, биохимических, иммунологических и других исследований, например определения группы крови, получения иммуноглобулинов и т. д. Для работы необходимо: пробирки, пастеровские пипетки, весы для уравновешивания пробирок, центрифуга, пенициллиновые флаконы, стеклограф, цельная кровь. Ход работы. Кровь кролика собирают в несколько центрифужных пробирок и «обводят» пастеровской пипеткой, отслоив от стенки пробирки. Процедуру периодически повторяют. Ставят пробирки в холодильник при температуре 4° С на 60 мин. Уравновешивают пробирки и центрифугируют 20 мин при 1000 об/мин. Сыворотку крови переносят в пенициллиновые флаконы. Рекомендации к оформлению работы. Объясните отличие сыворотки от цельной крови и плазмы крови. Работа 30. Наблюдение буферных свойств сыворотки крови (опыт Фриденталя) Кровь высших животных и человека отличается строгим постоянством активной реакции. Величина рН в среднем составляет 7,36 и колеблется в очень узких границах, не выходя за пределы 7,3—7,4, т. е. слабо щелочной реакции. Постоянство рН крови сохраняется, несмотря на непрерывное поступление в кровь кислых и щелочных продуктов обмена. Особенно много образуется в тканях кислых веществ (угольная кислота, молочная кислота и др.). Известно, что для того чтобы сделать реакцию сыворотки щелочной, к ней приходится прибавить в несколько десятков раз (40—70) больше едкого натра, чем к дистиллированной воде. Чтобы сделать реакцию кислой, к сыворотке надо прибавить в несколько сотен раз (300— 400) больше хлористоводородной кислоты, чем к дистиллированной воде. Точной мерой буферной емкости крови по Ван-Слайку является количество грамм-эквивалентов сильной щелочи или сильной кислоты, которое нужно прибавить к 10 мл крови для того, чтобы изменить ее рН на единицу. Постоянство рН крови обеспечивается целым рядом регуляторных механизмов и в первую очередь буферными системами крови. Для работы необходимо: 2 бюретки, 2 пипетки на 5 мл, 4 стаканчика; 0,01 М раствор едкого кали; 0,1 н. раствор хлористоводородной кислоты, дистиллированная вода, индикаторы: метиловый оранжевый и фенолфталеин, сыворотка крови, разведенная в 10 раз. Xод работы. Берут 2 чистых стаканчика и наливают в один 5 мл сыворотки, а в другой 5 мл воды, прибавляют в оба стаканчика по капле метилового оранжевого и считая капли, титруют 0,1 н. раствором хлористоводородной кислоты до появления не исчезающего при взбалтывании красного окрашивания. Титрование необходимо начинать с воды, которая не обладает буферными свойствами и используется для контроля. Для простоты отсчет титрования ведется в каплях, а не в миллилитрах титрованного раствора, как обычно. Берут 2 стаканчика и наливают в один 5 мл сыворотки, а в другой 5 мл воды. Прибавляют в каждый стаканчик по капле фенолфталеина и, считая капли, титруют 0,01 М раствором едкого кали до неисчезающего в течение 1 мин слабого фиолетового окрашивания (для более точного сравнения надо поставить оба стаканчика рядом на белую бумагу). Рекомендации к оформлению работы. Определите, сколько капель щелочи пошло на титрование воды и сколько капель на титрование сыворотки. Определите, сколько капель кислоты пошло на титрование воды и сколько на титрование сыворотки. Высчитайте во сколько раз больше надо прибавить едкого кали к сыворотке, чем к воде, чтобы сделать реакцию щелочной. Высчитайте, во сколько раз больше нужно прибавить хлористо-водородной кислоты к сыворотке, чем к воде, чтобы сделать реакцию кислой (учтите, что сыворотка разведена в 10 раз). Назовите буферные системы, которые имеются в крови. Напишите уравнения реакции нейтрализации в сыворотке крови хлористоводородной кислоты и едкого кали. Кровь состоит из жидкой части — плазмы и взвешенных в ней форменных элементов: эритроцитов, лейкоцитов, тромбоцитов. Форменные элементы составляют около 45% объема крови, остальные 55% приходятся на долю плазмы. Количество форменных элементов принято выражать их числом в 1 мкл крови. В крови содержится в среднем эритроцитов 4,5— 5*1012/л (4 500 000—5 000 000 в 1 мкл), лейкоцитов 4—9- 109/л (4000—9000 в 1 мкл), тромбоцитов 300- 109/л (300 000 в 1 мкл). Для подсчета форменных элементов кровь, взятую из пальца, разбавляют в специальных смесителях (меланжерах), чтобы создать нужную концентрацию клеток, удобную для подсчета (рис. 42). Заполняют разбавленной кровью счетную камеру (рис. 43) и подсчитывают под микроскопом число форменных элементов. Зная объем камеры и разбавление крови, вычисляют число кровяных телец в 1 мкл цельной крови.
Работа 31. Подсчет форменных элементов крови в камере Горяева
Для работы необходимо: микроскоп, счетная камера Горяева, меланжеры для красных и белых кровяных телец, скарификатор, 2 чашечки для разбавляющих жидкостей, вата, 3% раствор хлорида натрия, 5% раствор уксусной кислоты, подкрашенный метиленовой синью, спирт, йод, эфир. Работу проводят на человеке. Меланжер представляет собой пипетку с ампулообразным расширением (см. рис. 42). В ампуле находится стеклянная бусинка для лучшего размешивания крови. На капилляре нанесены две метки: 0,5 и 1; третья метка стоит за ампулообразным расширением: на меланжере для эритроцитов и тромбоцитов — 101, для лейкоцитов — 11. Последние метки указывают, во сколько раз объем ампулы больше объема капилляра. Для разбавления крови для подсчета эритроцитов применяют 3% гипертонический раствор хлорида натрия, в котором эритроциты сморщиваются; для подсчета лейкоцитов применяют 5% раствор уксусной кислоты, подкрашенный метиленовой синью. Кислота разрушает оболочки форменных элементов, а краска окрашивает ядра белых клеток. При этом эритроциты становятся невидимыми и не мешают подсчету лейкоцитов. Счетная камера (см. рис. 43) представляет собой толстое предметное стекло, в средней части которого имеются 4 желобка. Между ними образуются 3 узкие пластинки. Средняя пластинка ниже боковых на 0,1 мм и разделена пополам поперечным желобком. По обе стороны от желобка расположены сетки. Так как высота боковых пластинок на 0,1 мм больше средней, то при наложении на них покровного стекла над сеткой образуется камера глубиной в 0,1 мм. Сетка Горяева (см. рис. 43, в) состоит из 225 больших квадратов (15X15). Каждый третий квадрат разделен дополнительно поперечными и продольными линиями на 16 маленьких квадратиков. Таких больших квадратов, разделенных на маленькие, в сетке 25. Сторона маленького квадратика равняется 1/20 мм, площадь 1/20X1/20= = 1 /400 мм 2, так называемый «объем малого квадратика» равен 1/400X1/10=1/4000 мм3. Ход работы. 1. Перед началом работы необходимо разобраться в устройстве сетки счетной камеры. Для этого помещают камеру под микроскоп и сначала под малым, а затем под большим увеличением рассматривают сетку, находят малые квадратики и большие квадраты (см. рис. 43, в). 2. В специальные чашечки наливают растворы для разбавления крови: для эритроцитов—3% раствор хлорида натрия и для лейкоцитов — 5% раствор уксусной кислоты, подкрашенный метиленовой синью. 3. Кровь набирают в меланжеры. Кровь берут из IV пальца левой руки. Первую выступившую каплю стирают ватным тампоном. Во вторую каплю крови погружают кончик меланжера для эритроцитов, который при этом держат горизонтально, и набирают кровь до метки 0,5, следя, чтобы в капилляр не попали пузырьки воздуха. Быстро, пока кровь не свернулась, переносят кончик меланжера в 3% раствор хлорида натрия и набирают его до метки 101, т. е. разводят кровь в 200 раз. После этого смеситель переводят опять в горизонтальное положение и кладут на стол. Тем же способом набирают кровь в меланжер для лейкоцитов до метки 0,5 и уксусную кислоту до метки 11, т. е. разводят кровь в 20 раз. Подсчет эритроцитов. Берут заполненный меланжер для эритроцитов и, зажав концы его III и I пальцами, в течение 1 мин встряхивают его. Тотчас после тщательного перемешивания крови, выпустив предварительно наружу 1—2 капли, наносят небольшую капельку на сетку камеры, предварительно путем притирания плотно закрытую покровным стеклышком. Излишек раствора при этом стекает в желобки. Если капля слишком велика, то жид-, кость может попасть на боковые пластинки камеры и высота слоя будет больше 0,1 мм. В этом случае камеру следует промыть дистиллированной водой, насухо вытереть марлей и заполнить снова. Разведенную кровь следует еще раз перемешать. Заполнив камеру, ставят ее под микроскоп и, если форменные элементы расположены равномерно (что является показателем хорошего перемешивания крови), приступают к подсчету. Считать эритроциты удобнее при большом увеличении (окуляр X 7, объектив X 40). Чтобы получить удовлетворительные данные, необходимо подсчитать число эритроцитов в 5 больших квадратах, расположенных в разных местах сетки, например по диагонали. Рекомендуется вначале на листе бумаги нарисовать пять больших квадратов, разделить их на 16 маленьких и в каждый маленький квадратик вписать найденное число эритроцитов. Во избежание двукратного подсчета клеток, лежащих на границах между малыми квадратиками, руководствуются правилом Егорова: «Относящимися к данному квадратику считаются эритроциты, лежащие как внутри квадратика, так и на его левой и верхней границе. Эритроциты, лежащие на правой и нижней границе в данном квадратике, не обсчитываются». Подсчитав таким образом число эритроцитов (А) в 5 больших квадратах (что составляет 80 маленьких), находят среднее арифметическое число эритроцитов в одном маленьком квадратике А/80. Зная, что объем части камеры над одним маленьким квадратиком равен 1/4000 мм1, умножают найденное число на 4000. Получается число эритроцитов в 1 мкл разведенной крови. Умножив на разведение — 200, получают количество эритроцитов в 1 мкл цельной крови. Таким образом, формула для вычисления количества эритроцитов следующая:
где X — искомое число эритроцитов, А — число эритроцитов в 80 маленьких квадратиках.
Подсчет лейкоцитов. Берут заполненный меланжер для лейкоцитов и, перемешав его содержимое так же, как это рекомендовалось при подсчете эритроцитов, заполняют счетную камеру. Для получения точных- результатов подсчет производят в 25 больших квадратах, что составляет 400 маленьких квадратиков. Лейкоциты удобнее считать при малом увеличении (окуляр Х 15, объектив Х20). Формула для вычисления количества лейкоцитов в 1 мкл крови:
где X — искомое число лейкоцитов в 1 мкл крови; В — число лейкоцитов в 25 больших (400 маленьких) квадратах. Рекомендации к оформлению работы Запишите количество эритроцитов и лейкоцитов, содержащихся в 1 мкл исследованной крови. Объясните принцип работы со счетной камерой и формулы для расчета числа форменных элементов крови. Дата добавления: 2015-12-15 | Просмотры: 6168 | Нарушение авторских прав |