|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
УСЛОВИЯ, ОБЕСПЕЧИВАЮЩИЕ СОХРАНЕНИЕ ФУНКЦИИ ИЗОЛИРОВАННЫХ ТКАНЕЙВ следующих главах описан ряд опытов на изолированных органах и тканях. Изолированный препарат сохраняет жизнеспособность в течение многих часов, если во время эксперимента он находится в среде с соответствующими физическими и химическими характеристиками (необходимое содержание солей, определенная температура и рН, достаточный доступ кислорода). В разных экспериментах используются препараты различных тканей. Так, более простые опыты проводят на тканях лягушки: они хорошо функционируют при комнатной температуре, и кислород легко диффундирует в раствор, налитый в неглубокую ванночку с препаратом. Для других опытов используют ткани крысы, кролика, морской свинки. Для всех этих тканей разработаны специальные рецепты физиологических растворов, состав которых приводится ниже.
Методические указания по оформлению протокола. Протокол —это важная и обязательная форма самостоятельной работы студента на занятии по физиологии Правильное написание протокола важно для формирования навыков клинического мышления- будущего врача любой специальности. Протокол оформляется на каждом занятии индивидуально. Зачет в конце семестра ставится только при наличии всех протоколов. На экзамене тетрадь с протоколами предъявляется экзаменатору. Протоколы должны выполняться в отдельной тетради с полями (для заметок преподавателя), разборчивым почерком, по строго определенной форме.
Протокол опыта состоит из следующих разделов: 1. Название работы. 2. Цель работы. 3. Используемая аппаратура. 4. Ход работы и полученные результаты. 5. Выводы.
Указывается число, месяц и год написания протокола. Номер протокола — единый для всех опытов данного занятия. Цель работы — основная задача опыта, на которую в конце работы должен быть сформулирован четкий ответ. Можно опираться в этом разделе на формулировки, имеющиеся в плане занятия. Используемая аппаратура — необходимое материально-техническое оснащение работы (приборы, реактивы, животные и т. п.). Ход работы и полученные результаты: кратко, но достаточно ясно описываются основные действия при выполнении работы в объеме, необходимом для понимания полученных результатов. Помещают графики, схемы, рисунки и цифровые данные. Выводы — особенно ответственный раздел протокола. Здесь следует оценить полученные факты, используя для этого теоретический материал учебника и лекции по данному разделу. Важно проследить связь выводов с целью опыта и полученными результатами. В случае когда по ходу опыта возникают необычные явления, следует объективно отразить ход опыта в протоколе. В целом при составлении протокола следует стремиться к краткости изложения, четкости и законченности формулировок. Протокол каждого занятия принимается и подписывается преподавателем, и только после этого занятие считается полностью выполненным.
Раздел II
ОБЩАЯ ФИЗИОЛОГИЯ. ФИЗИОЛОГИЯ ВОЗБУДИМЫХ ТКАНЕЙ
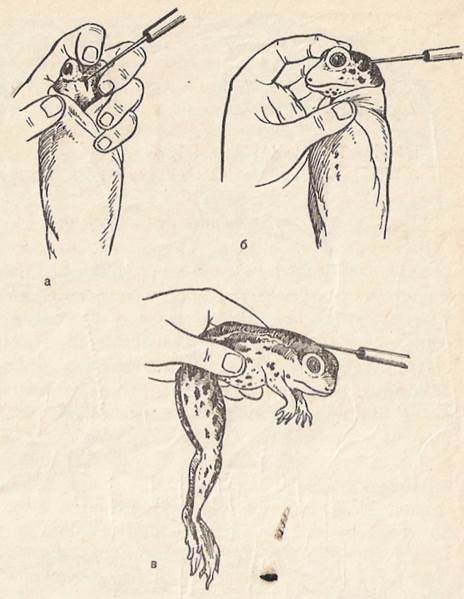
Способы обездвиживания лягушки. Многие физиологические эксперименты проводятся на лягушках. Для проведения острого опыта лягушку необходимо обездвижить. Существует несколько способов обездвиживания, одним из них является наркотизация. В качестве наркотического вещества чаще всего используют эфир. На тарелку, покрытую большой стеклянной воронкой, помещают лягушку, туда же кладут ватный тампон, смоченный эфиром. (В некоторых случаях в качестве наркотического вещества используют 10% раствор этилового спирта, который в количестве 250—300 мл наливают в эксикатор и помещают туда лягушку). Обездвижить лягушку можно путем введения, в подкожный лимфатический мешок миорелаксантов. Миорела-ксанты — вещества, которые нарушают передачу возбуждения с нерва на мышцу, в связи с чем вызывают расслабление скелетных мышц. Чаще всего обездвиживание лягушки производят путем разрушения ЦНС — спинного и головного мозга. Разрушение ЦНС производят двумя способами: с сохранением головы и путем декапитации. В обоих случаях лягушку завертывают в марлевую салфетку так, чтобы передние лапки оказались прижатыми к туловищу, а задние находились в вытянутом состоянии, голова остается свободной. При первом способе обездвиживания лягушку держат в левой руке, указательным пальцем которой сгибают голову лягушки так, чтобы между головой и позвоночником образовался некоторый угол (рис. 20, а). Затем препаровальной иглой с небольшим нажимом проводят по средней линии головы сверху вниз пока игла не соскользнет в небольшую ямку, соответствующую атлантозатылочной мембране. Проколов кожу и мембрану в этом месте, иглу вводят в полость черепа и несколькими движениями разрушают головной мозг (рис. 20, б). Затем слегка извлекают иглу, направляют ее в позвоночный канал и вращательными движениями разрушают спинной мозг (рис. 20, в). Декапитацию производят введением одной бранши ножниц в ротовую полость и отсечением челюсти и переднего отдела мозга. Разрез должен пройти сразу же за глазными буграми. В открывшийся позвоночный канал вводят препаровальную иглу и разрушают спинной мозг.
Рис. 20. Обездвиживание лягушки — спинного мозга. Объяснение в тексте. разрушение головного и
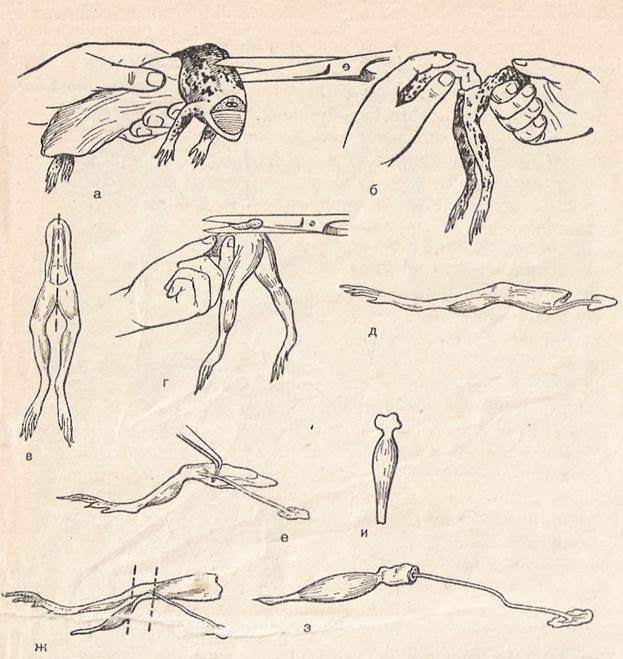
Работа 1. Приготовление нервно- мышечного препарата Для изучения физиологических свойств мышц и нервов часто используют нервно-мышечный препарат, приготовленный из задних лапок лягушки. Классическим нервно-мышечным препаратом считают икроножную мышцу и седалищный нерв, который ее иннервирует. Для работы необходимо: препаровальный набор инструментов, лоток, салфетки, операционный столик, раствор Рингера, лягушка. Ход работы. Обездвиживают лягушку, затем берут 1 -е за заднюю часть туловища и большими ножницами перерезают позвоночник на один сантиметр выше проксимального конца копчика (рис. 21, а). Далее, держа лягушку за задние лапки, ножницами разрезают кожу, мышцы, внутренности и удаляют вместе с передним отделом туловища.
Рис. 21. Этапы приготовления нервно-мышечного препарата. Объяснение в тексте.
Снимают кожу с задних лапок. Для этого берут две марлевые салфетки, одной удерживают остаток позвоночника, другой захватывают кожу и быстрым движением руки удаляют ее с лапок. Получают препарат задних лапок лягушки, который используется в некоторых экспериментах (рис. 21, б). Препарат задних лапок берут в левую руку за остаток позвоночника так, чтобы хвостовая кость (уростиль) выдавалась вверх, срезают ее ножницами (рис. 21, г). Переворачивают препарат на вентральную поверхность и под контролем зрения, чтобы не повредить нервные стволы крестцового сплетения, разрезают позвоночник и лонное сращение на две половины и получают препараты двух задних лапок (рис. 21, в, д). Один препарат помещают в стаканчик с раствором Рингера, а другой используют для приготовления нервно-мышечного препарата. Препаровку икроножной мышцы начинают с области пяточного (ахиллова) сухожилия. Под сухожилие подводят браншу ножниц, отделяют его по всей длине и перерезают ниже сесамовидной косточки. Захватив конец пяточного сухожилия пинцетом, отводят икроножную мышцу в сторону, разрывая фасции, соединяющие ее с другими тканями. При препаровке нерва переворачивают препарат дорсальной поверхностью кверху. Двумя большими пальцами рук раздвигают мышцы бедра и обнажают лежащий в глубине седалищный нерв. С помощью стеклянных крючков препарируют нерв на всем протяжении до коленного сустава. Затем берут кусочек позвоночника, отрезают его от тазовой кости и ножницами подрезают все веточки седалищного нерва. Отпрепаровав нерв до коленного сустава, перерезают конечность выше и ниже коленного сустава (рис. 21, ж) и получают нервно-мышечный препарат (рис. 21,з). Для приготовления препарата изолированной мышцы от нервно-мышечного препарата отсекают нерв (рис. 21, е). Рекомендации к оформлению работы. Зарисуйте нервно-мышечный препарат, обозначьте его части и укажите, для каких целей он используется.
Работа 2. Сравнение возбудимости нерва и мышцы (прямое и непрямое раздражение мышцы) Одним из основных физиологических свойств возбудимых тканей является возбудимость, которая у различных тканей различна. Для характеристики уровня возбудимости служит порог раздражения, т. е. минимальная сила раздражителя, при действии которой возникает ответная реакция. В экспериментальных условиях для определения возбудимости мышцы применяют прямой метод ее раздражения, т. е. раздражение, наносимое непосредственно на мышцу. Возбудимость нерва исследуют раздражением нерва, иннервирующего данную мышцу, т. е. методом непрямого раздражения мышцы.
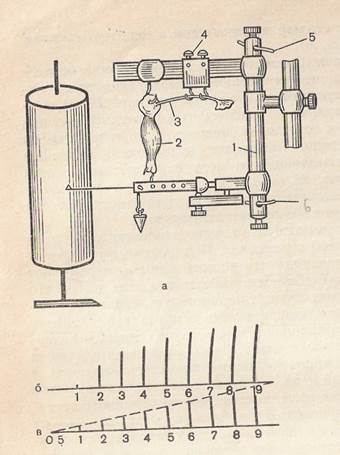
Рис. 22. Зависимость амплитуды сокращения изолированной икроножной мышцы лягушки от силы раздражителя.
а — схема установки для фиксации и стимуляции мышцы; 1 — вертикальный миограф; 2 — икроножная мышца; 3 — двигательный нерв; 4 — электроды для стимуляции нерва; 5 — клеммы для подключения стимулятора; б — запись мышечных сокращений; 1 — минимальное (пороговое сокращение); 2—6— суб-максимальные сокращения; 7—9 — максимальные сокращения; в — схема возрастания силы стимулов (от 0,5 до 9 условных единиц). За единицу взята амплитуда порогового стимула (1); 0,5 — подпороговый ращражитель; 1 — пороговый раздражитель; 2—6 субмаксимальные раздражители; 7 — максимальный раздражитель; 8—9 — сверхмаксимальные раздражители. Для работы необходимо: вертикальный миограф, стимулятор, раздражающие электроды, кимограф, универсальный штатив, набор препаровальных инструментов, лоток, пипетка, марлевые салфетки, раствор Рингера, лягушка. Ход работы. Готовят нервно-мышечный препарат. Икроножную мышцу укрепляют в миографе, для чего крючком, фиксированным на верхнем кронштейне миографа, прокалывают сумку коленного сустава, а пяточное сухожилие также с помощью крючка укрепляют на нижнем кронштейне миографа. К верхнему кронштейну миографа с помощью специальной муфты крепят раздражающие электроды, на которые помещают нерв нервно-мышечного препарата (рис. 22, а). Электроды соединяют с клеммами стимулятора. Ручки регулировки амплитуды устанавливают на нуле. Подавая на нерв одиночные стимулы с постоянной длительностью, например 0,5 мс, постепенно увеличивают амплитуду и находят ту минимальную силу раздражителя, которая вызывает едва заметное сокращение мышцы — это и будет порог раздражения для нерва. Для определения порога раздражения мышцы на нее наносят прямое раздражение через проводящую цепь миографа, соединенного со стимулятором. Порог раздражения находят так же, как при непрямом раздражении. Рекомендации к оформлению работы. Зарисуйте схему установки для прямого и непрямого раздражения мышцы, запишите результаты опыта и дайте сравнительную оценку возбудимости нерва и мышцы.
Работа 3. Зависимость амплитуды сокращения изолированной скелетной мышцы от силы раздражителя (минимальные, субмаксимальные, максимальные сокращения)
Скелетная мышца на раздражители пороговой силы отвечает минимальным пороговым сокращением. Если силу раздражителя постепенно увеличивать (рис. 22, в), то амплитуда сокращений скелетной мышцы также будет постепенно возрастать от пороговых до субмаксимальных и максимальных сокращений, после чего увеличение силы раздражителя не вызывает дальнейшего увеличения амплитуды сокращения. Такая реакция скелетной мышцы обусловлена ее строением. Она состоит из множества мышечных волокон, имеющих различную возбудимость и, следовательно, вовлечение их в реакцию идет постепенно: на пороговую силу раздражителя реагируют мышечные волокна с самой высокой возбудимостью, т. е. имеющие самый низкий порог раздражения. По мере увеличения силы раздражителя в сократительный процесс постепенно вовлекаются волокна, имеющие меньшую возбудимость. При максимальной силе раздражителя происходит сокращение всех мышечных волокон, составляющих данную мышцу, и поэтому амплитуда сокращений мышцы больше не увеличивается, несмотря на увеличение силы раздражителя. Для работы необходимо: вертикальный миограф, универсальный штатив, стимулятор, кимограф, препаровальный набор инструментов, лоток, пипетка, марлевые салфетки, раствор Рингера, лягушка. Ход работы. Готовят препарат икроножной мышцы лягушки, укрепляют его в миографе, соединенном со стимулятором. Писчик миографа приближают к кимографу, находят порог раздражения для мышцы, который определяют по ее минимальному сокращению. Далее, увеличивая силу раздражителя, записывают сокращение мышцы на кимографе. После каждого сокращения, вращая кимограф рукой, перемещают место записи на 0,5 см. Силу тока увеличивают до тех пор, пока не получат 2—3 сокращения одинаковой амплитуды (рис. 22, б). Рекомендации к оформлению работы. Вклейте полученную кимограмму в тетрадь, обозначьте на ней минимальные, субмаксимальные, максимальные сокращения. Объясните, почему скелетная мышца именно так реагирует на раздражители нарастающей силы.
Работа 4. Построение кривой «сила — время» •икроножной мышцы лягушки Раздражающее действие постоянного тока на ткань зависит не только от его силы, но и времени, в течение которого он должен действовать, чтобы возникла ответная реакция. Минимальная сила тока, способная вызвать возбуждение при неограниченно долгом действии на ткань, называется реобазой. Минимальное время, в течение которого должен действовать ток в одну реобазу, чтобы вызвать возбуждение, называется полезным временем. Для работы необходимо: хронаксиметр, электроды (специальные), ванночка, залитая парафином, булавки для фиксации лягушки, лист миллиметровой бумаги (15X20 см), физиологический раствор, лягушка. Ход работы. Обездвиживают лягушку. Кладут ее в ванночку спинкой кверху. Вводят в рот пассивный электрод (пластинку), смоченный физиологическим раствором, активный электрод (иглу) вкалывают в икроножную мышцу. Ставят переключатель хронаксиметра в положение «реобаза» и ступенчато увеличивают напряжение тока. Резко замыкая ключ, находят пороговую силу тока — реобазу (о пороге судят по минимальному местному сокращению икроножной мышцы). Записывают найденную величину реобазы в вольтах (В). Затем ставят переключатель в положение «хронаксия» и, подбирая емкости конденсаторов, определяют пороги длительности для напряжений, равных 1; 1,3; 2; 4; 10; 20 реобазам. Рекомендации к оформлению работы. На основании полученных данных постройте на миллиметровой бумаге кривую зависимости порога от длительности раздражения. На оси абсцисс отложите длительность пороговых стимулов в миллисекундах (мс), по оси ординат — напряжение в вольтах. Отметьте на графике реобазу. Сделайте вывод о зависимости между пороговой силой раздражителя и временем его действия.
Работа 5. Определение двигательной хронаксии у человека
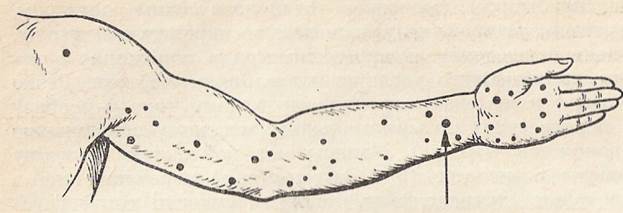
Для характеристики возбудимости тканей важно учитывать не только пороговую силу раздражителя, но и время действия раздражителя на ткань. В связи с этим для полной характеристики возбудимости ткани в физиологию и клинику было введено понятие «хронаксия». Это условная величина, отражающая минимальное время, в течение которого ток, равный удвоенной реобазе, должен действовать на ткань, чтобы вызвать ее возбуждение. Для работы необходимо: хронаксиметр, специальные электроды, марлевая салфетка, физиологический раствор. Исследование проводят на человеке. Ход работы. Индифферентный электрод (анод) укрепляют на внутренней поверхности предплечья, под электрод кладут смоченную физиологическим раствором марлевую салфетку. Находят двигательную точку. Для этого прибор устанавливают в режиме «хронаксия», включают напряжение 40—50 В и емкость конденсатора 0,5— 1 мкФ. Активным электродом (катодом), хорошо смоченным физиологическим раствором, находят двигательную точку мышц сгибателя пальцев на противоположной руке (внутренняя область предплечья, нижняя треть — рис. 23). Переключают прибор в режим «реобаза».
Рис. 23. Схема расположения двигательных точек мышц руки. Стрелкой указана двигательная точка общего сгибателя пальца. Прикладывают активный электрод к найденной двигательной точке, находят пороговую величину напряжения — реобазу. Определение начинают с раздражения слабым током, постепенно увеличивая его до появления сокращения мышцы сгибателя. На шкале напряжения тока отмечают величину реобазы. Затем переключают прибор в режим «хронаксия». При напряжении тока, равном двум реобазам, определяют хронаксию. Рекомендации к оформлению работы. Объясните, о каких свойствах возбудимых тканей позволяет судить хронаксия, сравните определенные величины реобазы и хронаксии со стандартными параметрами.
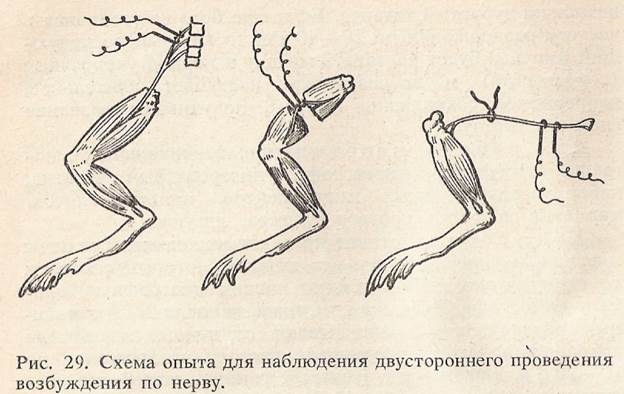
Работа 6. Биоэлектрические явления в возбудимых тканях
Биоэлектрические явления в возбудимых тканях могут быть обнаружены биологическими пробами и электрофизиологическими методами. Первый опыт Гальвани. Для работы необходимо: биметаллический пинцет, набор препаровальных инструментов, лоток, универсальный штатив, марлевые салфетки, раствор Рингера, лягушка. Ход работы. Готовят препарат двух задних лапок лягушки и подвешивают его на штативе. Берут биметаллический пинцет, одна бранша которого сделана из меди, а другая — из железа. Медную браншу подводят под нервные сплетения, а другую прикладывают к мышцам лапки. Наблюдают сокращение мышц лапок. Рекомендации к оформлению работы. Зарисуйте схему опыта, сделайте вывод о причине сокращения мышц.
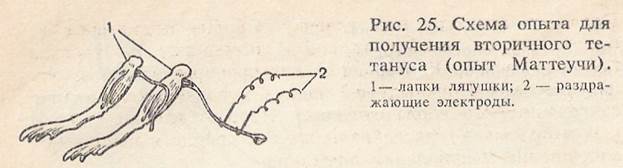
Второй опыт Гальвани (сокращение без металла).
Вторым опытом Гальвани впервые было доказано существование в тканях «животного электричества», которое возникает между поврежденной и неповрежденной поверхностями мышцы. Если эти два участка соединить нервом нервно-мышечного препарата, то возникает ток покоя, который раздражает нерв и вызывает сокращение мышцы. Для работы необходимо: набор препаровальных инструментов, лоток, пипетка, стеклянный крючок, марлевые салфетки, раствор Рингера, лягушка. Ход работы. Готовят препарат задней лапки лягушки. Затем тщательно препарируют седалищный нерв и отсекают его у позвонков. В нижней трети бедра пересекают мышцы и стеклянным крючком быстро набрасывают седалищный нерв таким образом, чтобы он одновременно коснулся поврежденной и неповрежденной поверхности мышц бедра (рис. 24). При этом происходит сокращение мышц голени. Рекомендации к оформлению работы. Зарисуйте схему опыта, в выводе объясните причину сокращения мышц лапки. Опыт Маттеучи. Раздражение нерва токами действия скелетной мышцы (вторичный тетанус). Маттеучи в 1840 г. показал, что сокращение мышцы нервно-мышечного препарата может наступить, если нерв этого препарата набросить на сокращающиеся мышцы другого нервно-мышечного препарата. На основании этого было сделано заключение, что в мышце при ее возбуждении возникают токи, которые могут стать раздражителем для другого нервно-мышечного препарата. Эти токи были названы токами действия. Для работы необходимо: набор препаровальных инструментов, лоток, стимулятор, электроды, стеклянный крючок, пробковая пластинка, раствор Рингера, лягушка.
Ход работы. Обездвиживают лягушку и готовят два препарата задних лапок лягушки. Затем стеклянным крючком препарируют седалищные нервы у обоих препаратов до коленного сустава, удаляют бедренную кость и мышцы бедра, оставив голень и стопу. Нерв одного препарата оставляют с кусочком позвоночника, а у другого кусочек позвоночника удаляют. Обе лапки укладывают на. пробковую пластинку. Нерв одного нервно-мышечного препарата (с кусочком позвоночника) с помощью стеклянного крючка помещают на электроды, которые соединены со стимулятором. На мышцы этого препарата в продольном направлении набрасывают нерв второго нервно-мышечного препарата (рис. 25). Нерв первого нервно-мышечного препарата подвергают ритмическому раздражению. Наблюдают тетаническое сокращение обеих лапок. При выполнении работы необходимо особенно''бережно относиться к препаровке нерва, следить, чтобы в ходе приготовления препарата он не подсыхал. Непосредственно перед экспериментом поверхность мышцы первого нервно-мышечного препарата и нерв второго нервно-мышечного препарата следует подсушить полоской фильтровальной бумаги. Рекомендации к оформлению работы. Зарисуйте схему опыта, в выводе объясните причину возникновения вторичного тетануса. Раздражение нерва нервно-мышечного препарата токами действия сердца лягушки (опыт Келликера и Мюллера). При сокращении сердечной мышцы в ней возникают токи действия, которые достаточно велики, чтобы вызвать раздражение нерва нервно-мышечного препарата. Для работы необходимо: набор препаровальных инструментов, лоток, часовое стекло, стеклянный крючок, пипетка, марлевые салфетки, лигатура, раствор Рингера, лягушка. Ход работы. Обездвиживают лягушку, вскрывают грудную полость, обнажают сердце и снимают перикард. Лигатуру подводят под дуги аорты и перевязывают их. Подводят лигатуру под уздечку. Сердце поднимают за обе лигатуры, изолируют его и помещают на часовое стекло в раствор Рингера. Готовят препарат задней лапки лягушки, как в предыдущей задаче, кусочек позвоночника от седалищного нерва отсекают. Нерв стеклянным крючком набрасывают на сокращающееся сердце и наблюдают сокращение мышц лапки лягушки. Рекомендации к оформлению работы. Зарисуйте схему опыта в тетради протоколов опытов, в выводе укажите причину сокращения мышц лапки лягушки.
Работа 7. Регистрация мембранного потенциала исчерченного мышечного волокна с помощью микроэлектрода
В состоянии покоя между наружной и внутренней поверхностью мембраны клетки существует разность потенциалов, которая получила название мембранного потенциала. Для измерения величины мембранного потенциала микроэлектрод вводят внутрь клетки и с помощью усилителя постоянного тока регистрируют разность потенциалов между внутренней частью клетки и окружающей ее средой. О существовании разности потенциалов свидетельствует скачок потенциала, который возникает в момент прокола мембраны клетки микроэлектродом. Этот скачок потенциала вызывает смещение луча осциллографа от изоэлектрической линии. Для работы необходимо: экранированная камера, микроманипулятор, бинокулярный микроскоп, усилитель биопотенциалов, осциллограф, цифровой вольтметр, микроэлектроды, заполненные 3 М растовором хлорида калия, индифферентный хлорсеребряный электрод, система для наружной перфузии мышцы, ванночка для препарата, лоток, набор препаровальных инструментов, марлевые салфетки, раствор Рингера, лягушка. Ход работы. Готовят препарат портняжной мышцы лягушки и укрепляют его с помощью лигатур в ванночке, включают проток раствора Рингера через ванночку. Подсоединяют индифферентный электрод и микроэлектрод ко входу микроэлектродного усилителя. Погружают кончик микроэлектрода в раствор и осуществляют балансировку усилителя. Цифровой вольтметр должен показывать 0,000 В. Далее устанавливают развертку осциллографа 1 см/10 с, а чувствительность усилителя 10 мВ/см. С помощью микроманипулятора вводят микроэлектрод в одно из поверхностных мышечных волокон. В момент прокола мембраны наблюдается скачок на экране осциллографа на величину, соответствующую значению мембранного потенциала. Цифровой вольтметр показывает величину потенциала покоя в милливольтах. Рекомендации к оформлению работы. Измерьте величину потенциала покоя в 10 волокнах, рассчитайте среднее значение мембранного потенциала.
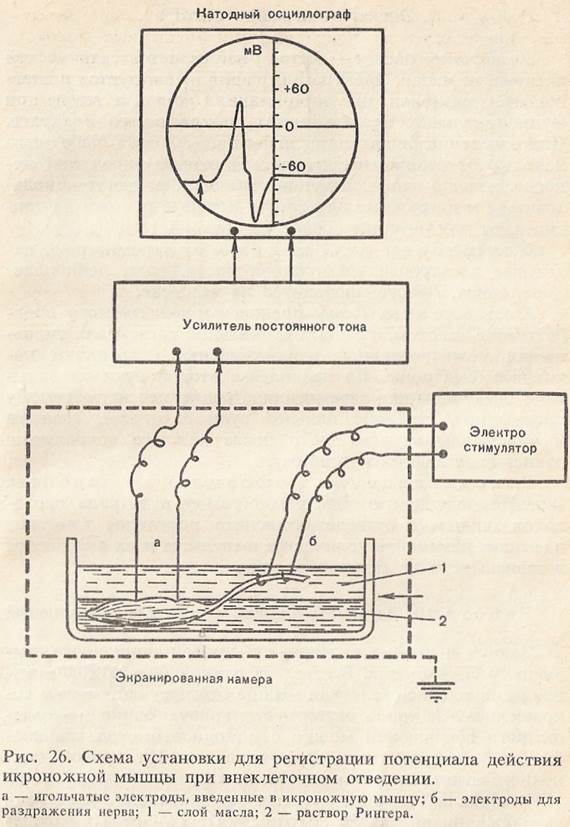
Работа 8. Регистрация потенциала действия (ПД) скелетной мышцы при внеклеточном отведении
При действии на возбудимую ткань раздражителя пороговой силы возникает возбуждение, которое сопровождается изменением мембранного потенциала. Такое изменение мембранного потенциала при возбуждении получило название потенциала действия. Потенциал действия (ПД) можно зарегистрировать при внутриклеточном и внеклеточном отведении. Для работы необходимо: электрофизиологическая установка, состоящая из экранированной камеры, осциллографа, усилителя биопотенциалов, катодного повторителя, электростимулятора; стеклянные микроэлектроды, препаровальный набор инструментов, лоток, ванночка, марлевые салфетки, парафиновое масло, раствор Рингера, лягушка.
Ход работы. В парафиновую ванночку, находящуюся в экранированной камере, помещают нервно-мышечный препарат (рис. 26). На оба конца ванночки закрепляют биполярные серебряные электроды. На дно ванночки укладывают серебряный электрод в виде пластинки. Нерв должен лежать в растворе Рингера, поверх которого наливают тонкий слой парафинового масла. Приподняв конец нерва, укладывают его на электроды, находящиеся в слое масла. Данные электроды являются раздражающими, они подключаются к стимулятору. Отводящие игольчатые электроды вводят непосредственно в икроножную мышцу и соединяют со входом усилителя осциллографа. Подав раздражающий импульс, наблюдают на экране осциллографа двухфазный потенциал действия, определяют его амплитуду. Потенциалу действия предшествует появление артефакта раздражения. Расстояние на экране осциллографа от артефакта раздражения до первого компонента ПД будет соответствовать времени проведения возбуждения по препарату. Рекомендации к оформлению работы. Зарисуйте схему установки и потенциал действия икроножной мышцы, обозначьте его фазы.
Работа 9. Электромиография (ЭМГ)
Электромиография — метод регистрации электрической активности мышц. Электромиография используется в диагностических целях, при заболеваниях мышц, а также при функциональных исследованиях двигательного аппарата. Для отведения биопотенциалов мышц человека чаще всего используют накожные электроды, которые укрепляют непосредственно над исследуемой мышцей, но могут использоваться и погружные электроды, которые похожи на тонкие иглы для внутримышечных инъекций. Для работы необходимо: электромиограф, накожные электроды, электродная паста, вата, лейкопластырь, спирт. Работа проводится на человеке. Ход работы. Кожу предплечья испытуемого обрабатывают спиртом, а затем специальной пастой для уменьшения межэлектродного сопротивления. Укрепляют накожные электроды. На предплечье второй руки накладывают электроды для заземления. Предлагают испытуемому производить сгибание пальцев руки с легким, средним и максимальным усилием и после каждого сокращения записывают электромиограмму. Рекомендации к оформлению работы. Вклейте полученную электромиограмму в тетрадь протоколов опытов, в выводе объясните появление биотоков в мышце, изменение количества импульсов и их амплитуды в зависимости от активности мышц.
Работа 10. Запись и анализ мышечных сокращений
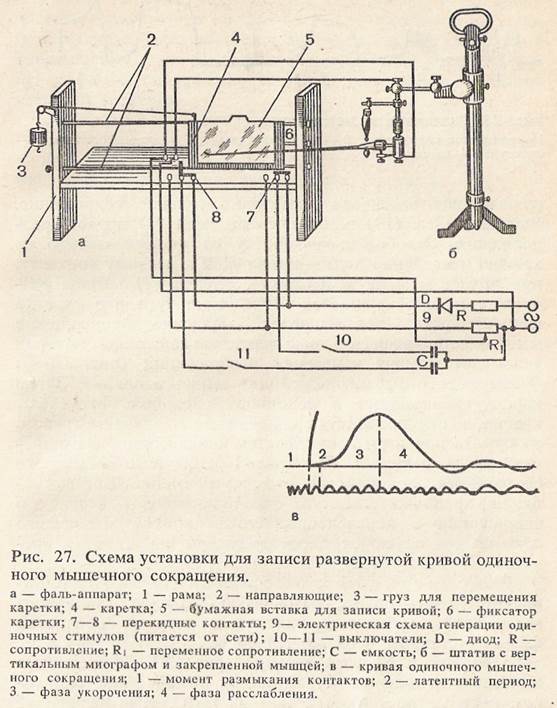
Запись и анализ развернутой кривой одиночного мышечного сокращения. В ответ на одиночное кратковременное раздражение скелетная мышца отвечает одиночным сокращением.
Записать развернутую кривую одиночного мышечного сокращения можно с помощью быстро вращающегося кимографа или фаль-аппарата. На кривой одиночного мышечного сокращения можно выделить три фазы: 1 — латентный период (время от момента нанесения раздражения до начала сокращения); 2 — фаза сокращения, 3 — фаза расслабления. Для икроножной мышцы лягушки весь одиночный цикл сокращения длится 0,11 — 0,12 с, латентный период—0,01 с, фаза сокращения — 0,05 с, фаза расслабления — 0,05—0,06 с. Для работы необходимо: фаль-аппарат, вертикальный миограф, универсальный штатив, набор пре- паровальных инструментов, пипетка, лоток, отметчик времени, марлевые салфетки, раствор Рингера, лягушка. Ход работы. Готовят препарат икроножной мышцы лягушки и укрепляют его в вертикальном миографе. С помощью винта миографа устанавливают рычажок миографа в горизонтальном положении, рамку фаль-аппарата отодвигают вправо и закрепляют крючком (рис. 27, а, б). Включают в сеть фаль-аппарат и с помощью потенциометра (R) подбирают такую силу раздражения, на которую мышца развивает достаточно сильное сокращение.
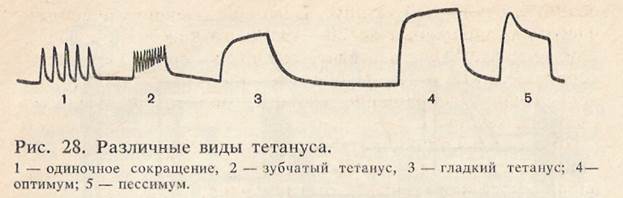
Выключателем (10) замыкают контакты (7) первого раздражения. Освобождают каретку от удерживающего ее крючка и медленно подводят ее рукой к первому контакту, при этом в момент замыкания контакта (7) мышца раздражается и сокращается. Вследствие того что каретка фаль-аппарата перемещается медленно, сокращение мышцы записывается в виде вертикальной линии, которая указывает момент нанесения раздражения (рис. 27, в). Одновременно с этим происходит запись изолинии. Затем каретку возвращают в исходное положение, отпускают крючок и она приводится в движение падающим грузом, на бумаге при этом записывается кривая одиночного мышечного сокращения. Под кривой одиночного мышечного сокращения записывается отметка времени. Для вычисления продолжительности фаз одиночного мышечного сокращения с определенных точек кривой мышечного сокращения опускают перпендикуляры на отметку времени. Рекомендации к оформлению работы. Зарисуйте схему опыта, развернутую кривую одиночного мышечного сокращения вклейте в тетрадь, обозначив фазы сокращения и их длительность. Зубчатый и гладкий тетанус (рис. 28). В организме мышцы сокращаются под влиянием ритмических импульсов, которые поступают к ним из ЦНС. Импульсы идут к мышцам с высокой частотой, которая превышает длительность одиночного мышечного сокращения, в результате чего происходит суммация сокращений, которая выражается в длительном и сильном сокращении всей мышцы, получившем название тетануса. Получить тетанус и проанализировать механизм его возникновения можно в условиях эксперимента. Если на мышцу наносить ритмические стимулы с частотой 10—20 Гц, то каждый последующий импульс совпадает с фазой расслабления и тогда возникает зубчатый тетанус. Если еще больше увеличивать частоту раздражения до 20—40 Гц, то каждый последующий импульс будет заставать мышцу в период укорочения (сокращения) и в результате наступает длительное, непрерывное сокращение мышцы, получившее название гладкого тетануса. Для работы необходимо: вертикальный миограф, стимулятор, кимограф, универсальный штатив, набор препаровальных инструментов, пипетка, лоток, марлевые салфетки, раствор Рингера, лягушка. Ход работы. Готовят препарат икроножной мышцы лягушки и укрепляют его в миографе, который соединен со стимулятором. Приближают писчик миографа к барабану кимографа. Включив кимограф, наносят 2—3 одиночных раздражения и записывают одиночные мышечные сокращения. Затем, увеличивая частоту раздражения до 10—20 Гц, записывают зубчатый тетанус, еще более увеличивая частоту до 20—40 Гц записывают гладкий тетанус. Рекомендации к оформлению работы. Вклейте полученные кимограммы в тетрадь, сравните амплитуду одиночного сокращения и тетанического, объясните условия возникновения зубчатого и гладкого тетануса. Оптимум и пессимум силы и частоты раздражения. Н. Е. Введенским было показано, что при действии на мышцу ритмических раздражений амплитуда тетанического сокращения будет различной, она будет зависеть от частоты наносимых раздражений. Это объясняется тем, что при действии на мышцу ритмических раздражений, каждое предыдущее раздражение приводит к изменению возбудимости мышцы и поэтому влияет на величину последующей ответной реакции. Существуют определенные оптимальные, т. е. наилучшие значения частоты и силы раздражения, при которых возникает тетанус максимальной амплитуды. При значительном увеличении силы и частоты раздражения амплитуда тетануса уменьшается — это будет пессимум частоты и силы раздражения. Для работы необходимо: вертикальный миограф, стимулятор, кимограф, универсальный штатив; набор препаровальных инструментов, лоток, марлевые салфетки, раствор Рингера, лягушка.
Ход работы. Готовят препарат икроножной мышцы лягушки и укрепляют его в миографе, который соединен со стимулятором, приближают писчик миографа к кимографу. Находят величину стимула, вызывающего максимальное одиночное сокращение мышцы. Затем находят оптимальную частоту, которая вызывает возникновение гладкого тетануса максимальной амплитуды. Для неутомленного нервно-мышечного препарата лягушки эта частота приближается к 40—50 Гц. На медленно вращающемся кимографе записывают в течение 5—6 с тетанус, возникающий при оптимальной частоте раздражения. Затем резко увеличивают частоту и силу раздражения, не прекращая записи миограммы. Амплитуда сокращения резко снижается. Это будет пессимум частоты и силы раздражения. Рекомендации к оформлению работы. Полученные кимограммы вклейте в тетрадь, объясните механизм оптимума и пессимума.
Дата добавления: 2015-12-15 | Просмотры: 2818 | Нарушение авторских прав |