|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Алгоритм обследования больных с критической ишемией конечностиИсследование крови: • полный общий анализ крови; • вязкость плазмы; • липидный профиль (холестерин, триглицериды, липопротеиды высокой плотности); • определение количества тромбоцитов; • уровень сахара крови; • суточный профиль сахара крови; • протромбиновый индекс; • уровень фибриногена; • электрофорез протеинов крови. • ЭКГ с нагрузкой (если существует возможность данного исследования без использования нижних конечностей); • эхокардиография; • рентгенография грудной клетки. • измерение сегментарного артериального давления на нижних конечностях с определением лодыжеч-но-плечевого индекса (ЛПИ) (недостоверен у больных с диабетом из-за медиосклероза артерий среднего диаметра); • спектральный анализ доппле-ровского сигнала с периферических артерий нижних конечностей; • дуплексное сканирование артерий нижних конечностей; • дуплексное сканирование бра-хиоцефальных артерий (особое зна-
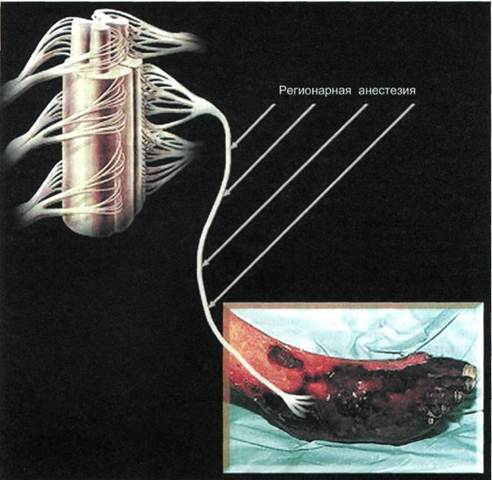
Рис. 7.22. Методика транс-кутанного определения Р02. чение придается исследованию бифуркаций общих сонных артерий); • рентгеноконтрастная ангиогра Исследование микроциркуляции: • транскутанное измерение напряжения кислорода в первом межпальцевом промежутке в положении конечности лежа и сидя; • видеокапилляроскопия ногтевого ложа пораженной конечности; • лазерная флоуметрия дисталь-ных отделов стопы. При наличии язвенно-некротических дефектов на стопе: • определение вида флоры и чувс При наличии сахарного диабета: • определение уровня гликолизи-рованного гемоглобина; • определение регионарного систолического давления на пальцах стопы; • рентгенография стопы. тромбангиитом: • определение уровня С-реактивного белка; • определение показателей гуморального иммунитета (циркулирующие иммунные комплексы, IgG и IgM). Комплекс проведенных диагностических мероприятий определяет выбор вида лечения больного с критической ишемией нижней конечности. Лечение. При лечении больных с критической ишемией конечностей, особенно до выполнения радикальных вмешательств, показаны такие мероприятия, как борьба с ишеми-ческим отеком, болью покоя и трофическими язвами. При наличии боли покоя больные опускают конечность. При этом необходимо выбрать наиболее оптимальное ее положение, чтобы не провоцировать увеличение отека, так как он, сдавливая капилляры, ухудшает микроцирку- ляцию и усиливает ишемию конечности [Fagrell В., 1977]. Консервативные мероприятия эффективны у больных с критической ишемией лишь в 15—20 % случаев. Поэтому при определении лечебной тактики у больных с критической ишемией конечности прежде всего необходимо решить вопрос о возможности реконструктивной операции. Реконструктивная сосудистая операция показана больным с критической ишемией конечности там, где имеются адекватные пути оттока, однако ранний тромбоз трансплантата может ухудшить ишемию конечности и привести к ампутации на более высоком уровне, чем предполагалось ранее. Сочетание безуспешной восстановительной операции и последующей ампутации сопровождается более высокой смертностью, чем при первичной ампутации. Поэтому показания к реконструктивной сосудистой операции у больных с критической ишемией конечности должны ставиться очень строго, с оценкой как общего, так и местного статуса. К основным видам хирургического лечения критической ишемии конечностей относят ангиопластику и реконструктивные сосудистые операции. Чрескожная ангиопластика со стентированием может применяться при наличии стенозов и окклюзии подвздошных артерий либо бедрен-но-подколенного сегмента длиной до 10 см. Если длина стенозов и окклюзии превышает 10 см или они расположены дистальнее бедренно-подколенного сегмента, чрескожную ангиопластику у больных с критической ишемией можно выполнять лишь в тех случаях, когда проведение реконструктивной сосудистой операции невозможно [Zeitler E., 1985]. В ближайшем послеоперационном периоде после чрескожной ангиопластики частота неудовлетворительных результатов в среднем на 10—20 % больше, чем у больных со II степенью ишемии конечности. Проходимость через год после проведения ангиопластики сохранялась у 58 % и через 5 лет — у 33 % больных. При ишемии II степени эти показатели составляют соответственно 74 и 52 % [Johnston K.W. et al., 1987]. После выполнения чрескожной ангиопластики у 2,3 % больных с критической ишемией наблюдаются различные осложнения. Частота осложнений зависит от локализации и протяженности артериальной окклюзии. При вмешательствах на артериях таза число осложнений составляет 1,9 %, на бедренно-подко-ленном сегменте — 2,7 %, при коротких обструкциях — 2,3 %, при стенозах и окклюзиях протяженностью более 10 см — 6,7 %. Наиболее распространенными осложнениями при чрескожной ангиопластике являются кровотечения и тромбоэмболии [Zeitler E., 1985]. Хорошие результаты дает выполнение аспирационной тромбэктомии, так как при этой процедуре снижается риск механического повреждения артериальной стенки [Guenther R.W., Vorwek D., 1990]. При артериальных тромбозах с успехом применяют регионарный тром-болизис. В зону тромботической окклюзии устанавливают катетер, по которому производят внутриартери-альную инфузию в тромботические массы фибринолитических препаратов. После растворения тромбов при необходимости возможно проведение баллонной вазодилатации [Родионов СВ., 1992; Eikelboom В., 1990]. Несмотря на значительные успехи в развитии эндовазальных методов лечения артериальных обструкций, ведущую роль в лечении критической ишемии конечностей играют реконструктивные сосудистые операции. Это объясняется тем, что больные с критической ишемией имеют, как правило, множественные и протяженные стенозы и окклюзии [Bell P.R.F., 1988]. Стенозы и окклюзии аорты и подвздошных артерий обычно являются частью многоуровневого поражения артерий при критической ишемии нижних конечностей. Однако выполнения даже одного аортобифемо-рального шунтирования без реконструкции дистального сосудистого русла часто бывает достаточно для спасения конечности при критической ишемии [Bell P.R.F., 1990]. Аортобифеморальное шунтирование, выполненное у больных с критической ишемией, дает хорошие отдаленные результаты. Так, через год после операции у 90 % оперированных больных реокклюзий не наблюдалось, через 5 лет эти показатели составляли от 74 до 90 %, через 10 лет — от 59 до 69 %. Смертность больных, перенес После выполнения бедренно-под-коленного шунтирования с наложением дистального анастомоза выше щели коленного сустава реокклюзий не наблюдалось у 75 % больных при использовании в качестве протеза аутовены и у 65 % больных при применении синтетического протеза через 5 лет. В случаях наложения дистального анастомоза ниже коленного сустава эти показатели составили 70 и менее 60 % соответственно тельно ограничены в связи с характерными для этого состояния поражениями дистального сосудистого русла. В таких случаях у части больных возможна операция артери-ализации венозного кровотока стопы [Покровский А.В. и др., 1990]. Эта операция оказывается эффективной более чем у 85 % пациентов, исходно обреченных на первичную ампутацию конечности. Изолированная поясничная сим-патэктомия не является средством спасения конечности при критической ишемии, но может быть использована для уменьшения боли покоя. У некоторых пациентов с критической ишемией конечности она может привести к потеплению стопы и некоторому субъективному улучшению, хотя и не исключает ампутацию. Для определения показаний к поясничной симпатэктомии у пациентов с критической ишемией конечности необходимо ориентироваться на показатели ишемической пробы — прирост линейной скорости кровотока на 50 % и более по общей бедренной артерии. В случае невозможности проведения хирургического вмешательства или же в качестве дополнения к нему проводят консервативную терапию, которая включает антикоагулянтную терапию, гипербарическую оксиге-нацию, системный и регионарный тромболизис, гемодилюцию и применение вазоактивных препаратов, включая простаноиды. За рубежом было проведено множество исследований и опубликован ряд работ по использованию таких простаноидов, как Pgl2 и PgEl, для лечения тяжелых форм ишемии конечности. Широкое распространение получил препарат проставазин (вазапростан) фирмы "Шварц Фарма" (Германия), основным действующим компонентом которого является простагландин Е1. Препарат назначают как внутривенно, так и внутриартериально. Для внутривенного введения обычно применяют дозу 60 мкг (3 ампулы) 1 раз в день или по 40 мкг (2 ампулы) 2 раза в день в течение 3—4 нед. Для лечения используют также ультрафиолетовое и лазерное внутривенное облучение крови [Петухов Е.Б. и др., 1989; Швальб И.Г. и др., 1990]. При этом отмечается снижение активности перекисного окисления липидов и тромбоцитарной агрегации. А.Е.Барсуков (1989) рекомендует применять комплексные методы лечения — ультрафиолетовое облучение крови, гипербарическую окси-генацию и гемосорбцию. Использование гипербарической оксигенации при критической ишемии конечностей основано на том, что ингаляции кислорода под давлением 3 атм повышают его содержание в плазме крови. Это приводит к увеличению поступления кислорода в ишемизированные ткани в связи с его легкой диффузией в интерсти-циальную жидкость [Verstraete M., Verhaeghe R., 1990]. Однако убедительных данных, подтверждающих существенный эффект гипербарической оксигенации при лечении больных с критической ишемией, не получено. Кроме того, это лечение часто приводит к еще большему нарастанию ишемии конечности и ухудшению общего состояния больных. Проведение постоянной эпиду-ральной спинномозговой электростимуляции может уменьшить боль покоя и улучшить микроциркулятор-ный кровоток (рис. 7.23). Имеются сообщения о том, что у 80 % больных, которым проводили эпидураль-ную спинномозговую электростимуляцию, удалось сохранить конечность через 1 год после окончания процедуры, и у 56 % больных — через 2 года [Jacobs M.J. et al, 1990].
Рис. 7.23. Постоянная эпидуральная спинномозговая электростимуляция. Первичная ампутация конечности при критической ишемии должна выполняться после неудачной попытки консервативной терапии лишь в тех случаях, когда невозможны какие-либо реваскуляризующие операции, а также у больных с обширным некрозом тканей на голени и стопе, когда существует угроза развития тяжелой интоксикации. Могут возникнуть также ситуации, когда необходимо решить вопрос, что лучше — выполнить первичную ампутацию или произвести повторную реконструктивную операцию, имеющую мало шансов на успех [Harris P.L. et al., 1990]. Пациенты с ампутированной конечностью имеют неблагоприятный прогноз, касающийся как реабилитации, так и выживаемости. Только 70 % культей на уровне ниже коленного сустава заживают первичным натяжением, 15 % — вторичным, и у 15 % больных требуется реампутация выше коленного сустава. Необходимость в ампутации другой конечности возникает в 30 % случаев. Госпитальная смертность при ампутации ниже и выше коленного сустава со- ставляет 8 и 18 % соответственно. Приблизительно 40 % больных умирают в течение 2 последующих лет после ампутации на уровне бедра. Способность к самостоятельному передвижению достигается менее чем у 50 % пациентов после ампутации ниже и у 25 % — выше коленного сустава. В некоторых случаях первичная ампутация конечности может быть более целесообразной, чем хирургические процедуры с малым шансом на успех. Решать эту трудную задачу должен консилиум специалистов, занимающихся проблемой критической ишемии. Показания к первичной ампутации конечности при критической ишемии: ▲ неэффективность консерватив ▲отсутствие возможности проведения ангиопластики и реконструктивной сосудистой операции из-за тяжелого поражения путей оттока; ▲ распространение гангрены на ▲ тяжелое общее состояние больного, связанное с основным заболеванием и сопутствующей патологией. Таким образом, первичную ампутацию конечности следует выполнять при невозможности ревас-куляризации и наличии гнойно-некротических изменений конечности. Ампутация конечности должна сопровождаться соответствующей реабилитацией, направленной на поддержание физической активности пациента и социальную адаптацию. Для лечения критической ишемии нижних конечностей используют как хирургические, так и консервативные методы. Лечение проводят в специализированном стационаре. Диагностические мероприятия должны быть направлены на выявление любой возможности, которая позволила бы выполнить сосудистую реконструктивную операцию; процент ее успеха в спасении конечности приближается к 90, тогда как консервативная терапия оказывается эффективной менее чем у 20 % больных. Литература Савельев B.C., Кошкин В.М. Критическая ишемия нижних конечностей. — М.: Медицина, 1997. - 160 с. Second European Consensus Document on Chronic Critical Leg Ischaemiae // Europ. J. Vase. Surgery. - 1992. - Vol. 6. - Suppl. A. Дата добавления: 2015-02-06 | Просмотры: 1516 | Нарушение авторских прав |