 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Виды и основные проявления атипизма опухолевых клеток
Упрощение структурно-химической организации клеток (анаплазия): - морфологическая анаплазия - биохимическая - энергетическая - функциональная - иммунологическая а) морфологическая тканевая - соотношение стромы и паренхимы нарушены клеточная - разные размеры, форма клеток, миграция ядрышка, нарушение структуры поверхности клеток. б) биохимическая анаплазия: набор изоферментов уменьшен активность ферментов снижена изоферментное упрощение (монотонизация) в) энергетическая анаплазия энергия за счет гликолиза как анаэробного, так и аэробного Превалируют синтетические процессы - снижение белка за счет продуктов разрушения клеток. Нарушение соотношения гистонов и негистоновых белков. Много ферментов синтеза РНК на денатурированной матрице ДНК. г) функциональная анаплазия Функция либо понижена, либо повышена. Гипо- ли гипертиреоз - пример. д) иммунологическая анаплазия: органоспецифические антигены межорганные антигены 1. Антигенное упрощение - резко уменьшено количество органоспецифических антигенов (нем. Вейлер). 2. Антигенная дивергенция - синтез. В опухолевых клетках гетерогенных антигенов (другого органа; Вейлер и Оленов). 3. Антигенная реверсия - синтез в опухолевых клетках эмбриональных антигенов (Абеленов и Татаринов - в гепатоме найден a-феропротеин; эмбриональный преальбумин в гепатоме мыши). 3. Наследуемость изменений - раковая клетка при размножении дает себе подобные. 4. Способность к метастазированию - образование вдали от первичного опухолевого узла вторичного опухолевого зачатка.
Патогенез опухолей. Современные представления о молекулярно-генетических механизмах неопластической трансформации. Современная трактовка концепции онкогена. Роль мутаций, вирусов и эпигеномных нарушений в механизмах превращения протоонкогена в онкоген.
Молекулярно-генетические механизмы опухолевой трансформации клетки Современная концепция канцерогенеза получила название концепции онкогена. Основополагающие положения ее были сформулированы еще в 1981-1985 гг. Этому предшествовали сложные поиски ведущего патогенетического звена в механизме опухолевой трансформации клетки. Все исследователи второй половины 20-го столетия считали, что данный процесс осуществляется на молекулярно-генетическом уровне, но суть его трактовали по-разному.
Мутационная концепция канцерогенеза Нормальная клетка превращается в опухолевую в результате структурных изменений в генетическом материале, т.е. мутаций. В этом заключается суть мутационной концепции. Различают три ее варианта. Первый вариант концепции (Т. Bovery, 1914) касается хромосомных аббераций и геномных мутаций, затрагивающих значительную часть генома. Второй вариант (Н.Н. Петров, К.Н. Bayer, 1924) учитывает еще и точечные или генные мутации. Третий вариант касается возможности участия в канцерогенезе мутации регуляторных генов. О возможной роли мутационных механизмов в канцерогенезе свидетельствуют следующие факты: Мутагенность подавляющей части (90 %) известных канцерогенов и канцерогенность большинства (у 85-87 % исследованных образцов) мутагенов. Обнаружение в клетках ряда опухолей человека и животных так называемых маркерных хромосом (например, филадельфийской хромосомы примиелоцитарном лейкозе человека). Резкое увеличение заболеваемости лейкозом и опухолевой болезнью людей с различного рода генетическими дефектами (при болезни Дауна, синдромах Клайнфельтера, Шерешевского-Тернера и др). Эпигеномная концепция канцерогенеза Согласно этой концепции (Ю.М. Оленов, А.Ю. Броновицкий, B.C. Ша-пот), в основе превращения нормальной клетки в злокачественную лежат стойкие нарушения регуляции генной активности, а не изменения структуры генетического материала. Под влиянием химических и физических канцерогенов, а также онкогенных вирусов происходит сдвиг в строго специфичной для каждой ткани регуляции генной активности: дерепрессируются группы генов, которые в данной ткани должны быть зарепрессированы и (или) блокируются активные гены. В результате клетка в значительной мере утрачивает присущую ей специфику, становится нечувствительной или малочувствительной к регуляторным влияниям целостного организма, неуправляемой. С точки зрения эпигеномной концепции канцерогенеза можно объяснить ряд особенностей неоплазмы: изоферментное упрощение, антигенную реверсию, выработку некоторыми опухолями гормонов, не присущих клеткам гомологичной ткани и др. Вирусо-генетическая концепция канцерогенеза Данную концепцию предложил Л.А. Зильбер (1948). Она заключается в следующем. Опухолевая трансформация клетки происходит в результате привнесения в ее генетический материал новой генетической информации онкогенными вирусами. Главным свойством последних является их способность разрывать цепочку ДНК и объединяться с ее обрывками, т.е. с клеточным геномом. Проникнув в клетку, вирус, освободившись от белковой оболочки, под влиянием содержащихся в нем ферментов встраивает свою ДНК в генетический аппарат клетки. Привнесенная вирусом новая генетическая информация, меняя характер роста и «поведение» клетки, превращает ее в злокачественную. G. Temin (1963) открыл явление обратной транскрипций: списывание генетической информации возможно не только в одном направлении (ДНК-РНК-белок), но и в обратном (от РНК к ДНК). Обнаружение в РНК-содержащих вирусах фермента ревертазы, или обратной транскриптазы, обеспечивающего процесс обратной транскрипции, позволило понять механизм действия и РНК-вирусов. Они синтезируют ДНК-овую копию своей РНК, которая и встраивается затем в геном клетки. В процессе обратной транскрипции на концах ДНК-вой копии формируются одинаковые последовательности — большие терминальные повторы (LTR), играющие роль в трансформации нормальной клетки в опухолевую. Современная концепция онкогена Альтернативные точки зрения относительно природы неопластической трансформации в 70-е годы значительно сблизились, поскольку появились неопровержимые факты участия в канцерогенезе и мутационных, и эпигеномных, и вирусно-генетических механизмов, последовательно включающихся в процесс опухолевой трансформации. Стало аксиомой представление о многоэтапности процесса канцерогенеза, решающей предпосылкой которого является нерегулируемая экспрессия трансформирующего гена - онкогена, предсущест-вующего и геноме. Впервые онкогены были обнаружены с помощью трансфекции («переноса генов») в вирусах, вызывающих опухоли у животных. Затем с помощью данного метода было установлено, что в организме животных и человека содерпотенциальные онкогены – протоонкогены, экспрессия которых и обуславливает трансформацию нормальной клетки в опухолевую. Согласно современной концепции онкогена мишенью для изменений, обусловливающих начаяо опухолевого роста, являются протоонкогены, или потенциальные онкогены, существующие в геноме нормальных клеток и обеспечивающие yсловия для нормальной жизнедеятельности организма. В эмбриональный период они обеспечивают условия для интенсивного размножения клеток и нормального развития организма. В постэмбриональном периоде функциональная их активность в значительной степени снижается — большая часть их оказывается в репрессированном состоянии, а остальные обеспечивают лишь периодическое обновление клеток. Механизмы превращения протоонкогена в онкоген Превращение протоонкогена в активно действующий онкоген обеспечивается следующими механизмами.
2. Вставка в геном клетки энхансера (enchancer — усилитель) — участка ДНК, способного активизировать работу структурного гена, находящегося не только в непосредственной близости от него, но и на расстоянии многих тысяч пар нуклеотидов или даже встроенного в хромосому после него. Свойствами усилителя обладают подвижные гены, LTR ДНК-копий. В случае, проиллюстрированном рис. 2, LTR провируса не может работать как промотор (см. рис. 1, Б) и выступает в роли энхансера, в результате чего ген туе активизируется и транскрибируется. 3. Хромосомные абберации с явлениями транслокации, роль которых в механизмах опухолевой трансформации клетки можно проиллюстрировать следующим примером.
Точечные мутации протоонкогена, к примеру, C-H-raS, согласно имеющимся сведениям, отличается от нормального гена (C-H-raS) всего одной аминокислотой, но тем не менее обусловливает снижение гуанозинтрифосфатазной активности в клетке, что может вызвать рак мочевого пузыря у человека. Амплификация (умножение) прогоонкогенов, обладающих в норме небольшой следовой активностью, обусловливает увеличение их общей актив ности до уровня, достаточного для инициации опухолевой трансформации. Известно, что в икринке шпорцевой лягушки около 5 млн копий гена туc. После оплодотворения и дальнейшего деления яйцеклетки число их прогрессирующе уменьшается. В каждой клетке будущего головастика в эмбриональный период развития содержится не более 20—50 копий тус-гена, обеспечивающих быстрое деление клеток и рост эмбриона. В клетках же взрослой лягушки выявляются лишь единичные гены туc, в то время как в раковых клетках той же лягушки число их вновь достигает 20-50. 6. Трансдукция неактивных клеточных генов (протоонкогенов) в геном ретровируса и последующее их возвращение в клетку: считается, что онкоген опухолеродного вируса клеточного происхождения; при инфицировании животных или человека таким вирусом «похищенный» им ген попадает в иной участок генома, что и обеспечивает активизацию некогда «молчавшего» гена.
Дата добавления: 2014-12-11 | Просмотры: 1265 | Нарушение авторских прав |

 1. Присоединение к протоонокгену промотора — участка ДНК, с которым связывается РНК-полимераза, инициирующая транскрипцию гена, в том числе и онкогена, располагающегося непосредственно за ним (рис.1). Такого рода участки (промоторы) содержатся в больших терминальных повторах (LTR) ДНК-копий РНК-содержащих вирусов. Роль промотора могут выполнять и транспозирующие элементы генома — мобильные генетические элементы, способные перемещаться по геному и встраиваться в различные его участки.
1. Присоединение к протоонокгену промотора — участка ДНК, с которым связывается РНК-полимераза, инициирующая транскрипцию гена, в том числе и онкогена, располагающегося непосредственно за ним (рис.1). Такого рода участки (промоторы) содержатся в больших терминальных повторах (LTR) ДНК-копий РНК-содержащих вирусов. Роль промотора могут выполнять и транспозирующие элементы генома — мобильные генетические элементы, способные перемещаться по геному и встраиваться в различные его участки.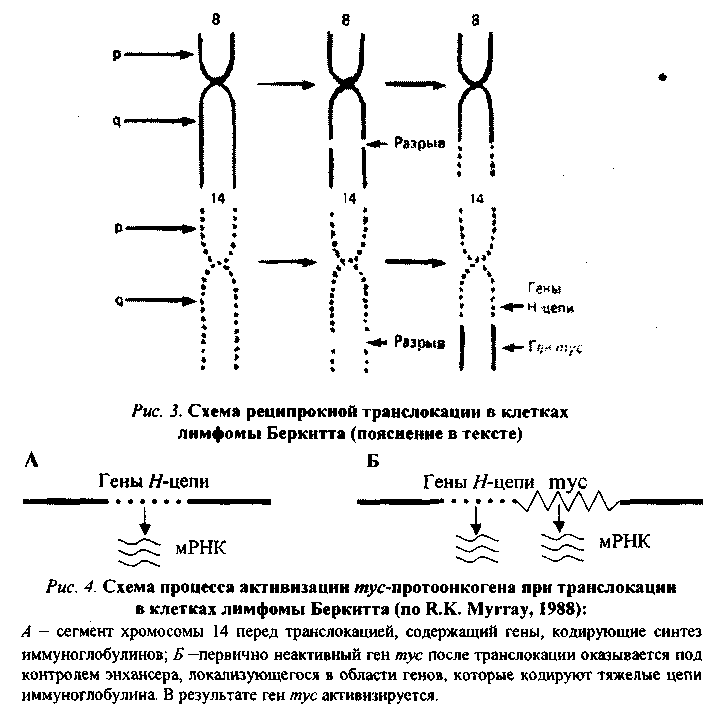 При лимфоме Беркитта конец (q-плеча хромосомы 8, отделившись от нее, переходит к хромосоме 14: гомологичный фрагмент последней перемещается к хромосоме 8; а неактивный ген туе (протоонкоген), находившийся в том ее сегменте, который попадает на хромосому 14, встраивается вслед за активными генами, кодирующими тяжелые цепи молекул иммуноглобулинов, и активизируется (рис. 3, 4). Явления реципрокной транслокации между 9-й и 22-й хромосомами имеют место в 95 % случаев миелоцитарного лейкоза. Хромосома 22 с укороченным в результате такой транслокации одним плечом получила название Филадельфийской.
При лимфоме Беркитта конец (q-плеча хромосомы 8, отделившись от нее, переходит к хромосоме 14: гомологичный фрагмент последней перемещается к хромосоме 8; а неактивный ген туе (протоонкоген), находившийся в том ее сегменте, который попадает на хромосому 14, встраивается вслед за активными генами, кодирующими тяжелые цепи молекул иммуноглобулинов, и активизируется (рис. 3, 4). Явления реципрокной транслокации между 9-й и 22-й хромосомами имеют место в 95 % случаев миелоцитарного лейкоза. Хромосома 22 с укороченным в результате такой транслокации одним плечом получила название Филадельфийской.