|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
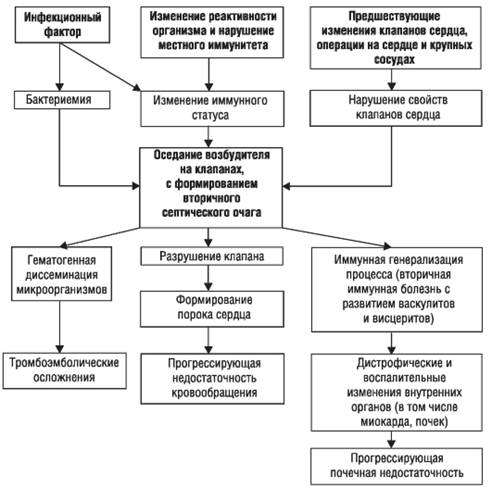
ИНФЕКЦИОННЫЙ ЭНДОКАРДИТИнфекционный эндокардит (ИЭ) - полипозно-язвенное поражение клапанного аппарата сердца или пристеночного эндокарда (реже эндотелия аорты или крупной артерии), вызванное различными патогенными микроорганизмами или грибами и сопровождающееся тромбоэмболиями, а также системным поражением сосудов и внутренних органов на фоне измененной реактивности организма. Термин «инфекционный эндокардит» в настоящее время вытеснил ранее использовавшиеся термины «бактериальный эндокардит», «затяжной септический эндокардит», так как лучше отражает причину заболевания, вызываемого самыми различными микроорганизмами - бактериальными агентами, риккетсиями, вирусами и грибами. Наиболее часто заболевают ИЭ лица в возрасте 20-50 лет, мужчины несколько чаще, чем женщины. Особенность «современного» ИЭ состоит в высокой частоте возникновения заболевания в пожилом и старческом возрасте (более 20% всех случаев), увеличении числа больных с первичной формой болезни (более 50%), возникновении новых клинических вариантов течения и в значительном изменении свойств возбудителя. Этиология Среди возбудителей, наиболее часто вызывающих ИЭ, обнаруживают кокковую микрофлору - стрептококки (зеленящий стрептококк ранее выделяли в 90% случаев), стафилококки (золотистый, белый) и энтерококки. Значительно реже причиной болезни бывает грамотрицательная микрофлора - кишечная палочка, синегнойная палочка, протей и клебсиелла. В последние годы большую роль стали играть патогенные грибы, протей, сарцины, бруцеллы, вирусы. У ряда больных истинного возбудителя заболевания не обнаруживают (частота получения отрицательного результата при посеве крови колеблется в пределах 20-50%). Обнаружение возбудителя зависит от многих факторов: качества бактериологического исследования, длительности предшествующей антибактериальной терапии и особенностей возбудителя. Источники инфекции и бактериемии при ИЭ могут быть самыми разными. • Операции в полости рта. • Операции и диагностические процедуры на органах мочеполовой системы. • Инфекционное поражение кожи. • Оперативное вмешательство на сердечно-сосудистой системе (в том числе протезирование клапанов). • Длительное пребывание катетера в вене. • Частые внутривенные вливания и эндоскопические методы исследования. • Хронический гемодиализ (артериовенозный шунт). • Наркомания (внутривенное введение наркотиков). ИЭ может развиться на интактных клапанах (первичный эндокардит), а также на фоне ранее существовавших (врожденных и приобретенных) изменений сердца и его клапанного аппарата (вторичный ИЭ). Имеет значение в развитии ИЭ и ряд медицинских манипуляций (оперативные вмешательства в полости рта, катетеризация мочевого пузыря, ректороманоскопия, установка внутривенного катетера). Наконец, имеет также значение ряд состояний, сопровождающихся снижением иммунитета: сахарный диабет, токсикомания (в том числе алкоголизм), ВИЧ-инфекция, лечение мощными иммунодепрессантами. В настоящее время приобрел большое значение ИЭ наркоманов. Патогенез Механизм развития заболевания сложен и изучен недостаточно, но основные моменты развития ИЭ не вызывают сомнения (рис. 2-2). При существовании в организме очага инфекции под влиянием различных эндогенных и экзогенных факторов, изменяющих реактивность и иммунный статус организма, развивается бактериемия. Микроорганизмы из крови попадают на клапаны сердца, где в дальнейшем формируют вторичный очаг инфекции. Их фиксации и размножению на эндокарде, приводящем к образованию вторичного септического очага, способствуют дополнительные факторы. Вероятно, имеет значение предшествующее изменение ткани и поверхности клапана, а также присутствие на нем тромботических масс (часто - с развитием абактериального эндокардита), образующихся под влиянием прямого повреждающего действия струи крови, движущейся с большой скоростью или под большим давлением (в условиях имеющегося порока сердца). Деформация клапанов вследствие большого градиента давления, узости отверстия и изменения скорости кровотока создает условия, способствующие внедрению инфекционных агентов в эндокард с образованием инфекционного очага. При поражении ранее интактного клапана происходят изменения, нарушающие нормальные свойства отдельных участков этого клапана в виде отечности, экссудативных или пролиферативных процессов («интерстициальный вальвулит» - доклиническая фаза). Подобная ситуация возможна и при повреждении интимы крупных сосудов. Происходит снижение иммунитета (в основном клеточного) с развитием вторичных иммунных нарушений (наряду с бактериальными антигенами существуют и антигены тканевого происхождения, что приводит к образованию иммунных комплексов, которые циркулируют в крови и оседают на различные органы и ткани). Патогенез представлен на рис. 2-2.
Рис. 2-2. Патогенез инфекционного эндокардита Классификация • I. По клиническому течению: - острый (заболевание длится не более 1-1,5 мес); - подострый (заболевание длится 3-4 мес); - затяжной (заболевание длится многие месяцы). • II. По клинико-морфологической форме: - первичный (на интактном сердце) - более 50%; - вторичный на фоне: ревматических пороков сердца; пролапса митрального клапана; врожденных пороков сердца; ГКМП; постинфарктной аневризмы; артериовенозных аневризм; оперированного сердца и сосудов; шунтов при хроническом гемодиализе. В клинической картине заболевания принято выделять группы симптомов, обусловленных различными патогенетическими механизмами. • Симптомы, обусловленные инфекционно-токсическим воздействием, протекают с интоксикацией различной степени выраженности и с повышением температуры тела. Рост бактерий сопровождает формирование вегетаций с разрушением клапанов (развитие порока сердца). Происходит также генерализация процесса за счет гематогенного распространения инфекции. Отрыв фрагментов клапанных микробных вегетаций способствует заносу инфицированных эмболов в различные участки сосудистого русла и усугубляет септические проявления. Одновременно эмболы, попадая с током крови в различные органы, вызывают развитие тромбоэмболических осложнений, проявляющихся симптомами инфаркта почки, миокарда, селезенки, сосудов глаз, кожи и др. • Симптомы, обусловленные иммуновоспалительными механизмами, связаны с иммунной генерализацией процесса. Микроорганизмы, фиксированные на клапанах, вызывают длительную аутосенсибилизацию и гиперергическое повреждение органов и тканей организма. В этой стадии выявляют циркулирующие в крови и фиксированные в тканях (сердце, почки, печень, сосуды) иммунные комплексы. Иммунные и аутоиммунные нарушения обусловливают развитие васкулитов и висцеритов (иммунокомплексный нефрит, миокардит, гепатит, капиллярит и др.). В ряде случаев иммунные нарушения, называемые вторичными, могут развиваться с самого начала болезни, по существу в продромальный период. • При дальнейшем прогрессировании болезни могут развиваться дистрофические изменения органов с их функциональной недостаточностью (наибольшее значение имеют сердечная и почечная недостаточность, часто приводящая к смерти больных). Клиническая картина Проявления ИЭ весьма разнообразны и могут быть представлены в виде ряда синдромов. • Синдром воспалительных изменений и септицемии (лихорадка, озноб, геморрагические высыпания, изменение острофазовых показателей крови: лейкоцитоз со сдвигом влево, увеличение СОЭ, СРБ, повышение содержания фибриногена, а2-глобулинов, положительная гемокультура). • Интоксикационный синдром (общая слабость, выраженная потливость, головные боли, миалгии и артралгии, снижение аппетита, бледность кожного покрова с желтушным оттенком). • Синдром клапанных поражений (формирование порока сердца, чаще аортального или митрального, прежде не измененных клапанов или присоединение новых поражений клапанов к ранее существовавшим). • Синдром лабораторных иммунных нарушений (циркулирующие в крови иммунные комплексы, фиксированные иммунокомплексные депозиты в почках, миокарде и сосудах; гипергаммаглобулинемия; РФ; противотканевые антитела). • Синдром тромбоэмболических осложнений (очаговый нефрит, ИМ, селезенки, кишечника, тромбоэмболии в мозг, сетчатку глаза, сосуды нижних конечностей и т.д.). • Синдром иммунных поражений органов и систем (диффузный гломерулонефрит, миокардит, гепатит, васкулит и др.). Степень выраженности указанных синдромов различна. Она определяется не только периодом болезни, но и характером течения ИЭ, на который влияет вид возбудителя. Стафилококковый эндокардит характеризуется высокой активностью процесса, тяжелым общим состоянием, гектической лихорадкой, развитием гнойных осложнений. Грибковые эндокардиты, как правило, сопровождаются эмболической окклюзией крупных артерий, особенно нижних конечностей. «Классическая» картина заболевания характерна для ИЭ, вызванного зеленящим стрептококком. На первом этапе диагностического поиска обращают внимание на жалобы, обусловленные инфекцией и интоксикацией, тромбоэмболическими осложнениями, поражением сердца, вовлечением в патологический процесс других органов и систем. Наиболее существенным для последующего диагноза следует считать одновременное наличие жалоб, указывающих на инфекционный процесс и поражение сердца. В анамнезе обычно выявляют указания на перенесенный в прошлом ревматизм, наличие приобретенного или врожденного порока сердца, а также эпизоды «немотивированной» длительной лихорадки или субфебрилитета. Начало заболевания часто связано с острой инфекцией или обострением хронической инфекции, а также с рядом врачебных манипуляций (экстракция зубов, аборты, тонзиллэктомия, катетеризация мочевого пузыря, сосудов, операции на сердце и т.д.). Особенно характерно сочетание повышения температуры тела с ознобами и потливостью. Степень повышения температуры тела может быть различной: при остром течении отмечают повышение до 39 °С, тогда как при подостром и затяжном течении температура может быть субфебрильной. Вместе с тем у больных, длительно болеющих и имеющих сердечную или почечную недостаточность, при рецидивах болезни и несомненной активности процесса температура тела может быть нормальной. Кроме того, можно выявить жалобы, обусловленные и сердечной недостаточностью (на фоне длительно существовавшего порока сердца), а также жалобы, связанные с тромбоэмболическими осложнениями (в особенности тромбоэмболии мелких мезентериальных сосудов, почечных артерий и селезенки). В анамнезе больных могут быть эпизоды длительного лечения антибиотиками (это бывает при рецидиве ИЭ у больных, ранее уже подвергавшихся лечению). В случае типичного течения болезни уже на этом этапе можно заподозрить ИЭ. У ряда больных на первом этапе характер заболевания (ИЭ или какое-то иное заболевание) остается неясным и может быть установлен в дальнейшем лишь с учетом результатов последующих этапов диагностического поиска. На втором этапе диагностического поиска наибольшее значение для постановки правильного диагноза имеет обнаружение: • поражения клапанов сердца (возникновение патогномоничных для ИЭ симптомов аортальной или митральной недостаточности и дополнительных шумов, а также изменение аускультативной картины ранее существовавших пороков сердца); • поражения кожи и слизистых оболочек: цвет кожного покрова типа «кофе с молоком», геморрагии, положительные симптомы Гехта (щипка) и Кончаловского-Румпеля-Лееде (жгута), а также узелки Ослера - болезненные гиперемированные плотные узелки на ладонной поверхности и кончиках пальцев, признак Лукина-Либмана (пятна Лукина) - геморрагия на переходной складке конъюнктив; • весьма типичный симптом ИЭ - снижение массы тела, иногда значительное, на 15-20 кг; • увеличения селезенки и печени (спленомегалию часто обнаруживают при ИЭ и почти никогда - при ревматизме). Пальцы в виде «барабанных палочек» - симптом, не имеющий в настоящее время большого диагностического значения, так как его регистрируют чрезвычайно редко (ранее - в 30-50% случаев). Тем не менее его обнаружение - лишний довод в пользу постановки диагноза ИЭ. При пороке сердца (в особенности при вторичных ИЭ) можно обнаружить признаки хронической сердечной недостаточности. Другая причина их появления - развитие миокардита, что проявляется глухостью сердечных тонов, систолическим шумом, относительной недостаточностью митрального клапана и дилатацией полостей сердца. В редких случаях развивается перикардит (нерезкий шум трения перикарда, обусловленный фибринозными наложениями). При физическом обследовании можно выявить повышение АД, вызывающее подозрение на развитие диффузного гломерулонефрита. У части больных выявляют нарушения ЦНС (парезы, гиперкинезы, патологические рефлексы и др.) как проявление васкулитов или эмболии в мозговые сосуды. При исследовании органов дыхания можно выявить инфарктную пневмонию. С учетом выявленных симптомов на этом этапе поиска диагноз ИЭ представляется весьма вероятным, особенно при характерном анамнезе. У лиц, не имеющих характерного анамнеза, выявленных симптомов также бывает достаточно, чтобы заподозрить ИЭ. На втором этапе наиболее частой диагностической ошибкой служит оценка того или иного синдрома в качестве проявлений самостоятельного заболевания: например, при выраженных изменениях в анализе мочи ставят диагноз гломерулонефрита (как самостоятельного заболевания) и пр. Естественно, это возможно при недостаточном учете всей клинической картины и отсутствии связи ведущего синдрома с другими проявлениями болезни. На третьем этапе диагностического поиска проводят исследования, подтверждающие предварительный диагноз ИЭ и позволяющие сформулировать окончательный развернутый диагноз. • Лабораторно-инструментальные исследования предусматривают: - повторные попытки обнаружения возбудителя болезни при многократных посевах крови; - подтверждение и (или) установление воспалительного характера патологического процесса (выявление острофазовых показателей крови); - обнаружение иммунологических изменений; - уточнение характера поражения различных органов и систем; - получение прямых диагностических признаков инфекционного поражения эндокарда. • Получение положительной гемокультуры - наиболее важный диагностический признак ИЭ. Для подтверждения диагноза требуется не менее 2-3 анализов. Единичная положительная гемокультура должна интерпретироваться с большой осторожностью вследствие возможности случайного загрязнения. Большое значение имеют техника забора и посева крови, время посева (желательно на высоте лихорадки), использование обогащенных сред. Отрицательная гемокультура не исключает ИЭ. Переоценивать роль посевов крови нельзя, так как имеет значение только положительный результат в сопоставлении с клинической картиной. • В клиническом анализе крови наиболее важным для диагностики является повышение СОЭ до 50 мм/ч и более. В дебюте ИЭ выявляют лейкоцитоз со сдвигом лейкоцитарной формулы влево, позже могут обнаруживаться лейкопения и гипохромная анемия. • При биохимическом анализе крови выявляют увеличение содержания фибриногена, а2-глобулинов и резкое увеличение уровня у-глобулинов - до 30-40%. Кроме гипергаммаглобулинемии, показателями иммунологических изменений служат обнаружение ЦИК, снижение титра комплемента, появление ревматоидного (антиглобулинового) фактора, усиление реакции бластной трансформации лимфоцитов с фитогемагглютинином и бактериальными антигенами, выявление противотканевых антител. Как правило, при ИЭ в отличие от ревматизма титры антистрептолизина-О и антигиалуронидазы соответствуют норме. • Анализ мочи позволяет обнаружить гломерулонефрит, манифестирующий протеинурией, цилиндрурией и гематурией. При высокой протеинурии можно предположить развитие амилоидоза (редко встречающееся осложнение ИЭ). Повышение содержания билирубина, трансаминаз указывает на поражение печени. • Рентгенологическое, электро- и фонокардиографическое исследование помогает уточнить характер клапанного поражения сердца. • Прямой признак ИЭ - вегетации на клапанах сердца, которые можно обнаружить во время ЭхоКГ (особенно при использовании чреспищеводной регистрации с помощью специального датчика). Таким образом, на заключительном этапе диагностического поиска у большинства больных можно с уверенностью диагностировать ИЭ. В некоторых случаях для установления окончательного диагноза требуется динамическое наблюдение. Диагностика Распознавание ИЭ при развитой клинической картине заболевания не представляет существенных трудностей. В современной клинической практике применяют критерии, разработанные в 1994 г. D. Durack и модифицированные в 2000 г. • Большие критерии: - положительный посев крови: положительная гемокультура: типичные для ИЭ возбудители в двух посевах крови - зеленящие стрептококки, Streptococcus bovis, микроорганизмы группы HACEK, Staphylococcus aureus или внебольничные энтерококки при отсутствии первичного очага; или микроорганизмы, которые могут вызвать ИЭ: по крайней мере, два положительных посева крови, взятой с интервалом более 12 ч, или все три посева, или большинство из более чем четырех посевов крови (первый и последний образцы взяты с интервалом, по крайней мере, 1 ч); Или однократный положительный посев крови на Coxiella burnetii или титр IgG антител 1 фазы >1\800; - признаки поражения эндокарда: эхокардиографические признаки ИЭ - вегетации, абсцесс или частичный отрыв искусственного клапана; возникновение регургитации. • Малые критерии. - предрасположенность: заболевания сердца, предрасполагающие к развитию ИЭ, внутривенная наркомания; - лихорадка >38 °С; - сосудистые нарушения: артериальные эмболии, септический инфаркт легкого, микотические аневризмы, внутричерепное кровотечение, кровоизлияния в конъюнктиву; - иммунологические нарушения: гломерулонефрит, узелки Ослера, пятна Рота, РФ; - бактериологические изменения: положительный посев крови, не соответствующий большим критериям, или серологические признаки инфицирования возможным возбудителем ИЭ. ИЭ диагностируют при обнаружении двух больших, одного большого и трех малых или пяти малых критериев. Диагноз ИЭ возможен при обнаружении одного большого и одного малого или трех малых критериев. Трудности диагностики обусловлены стертым и атипичным течением ИЭ. Если вторичный септический очаг локализован не в сердце, а в интиме крупных артерий, то исчезает такой важный диагностический признак, как формирование порока сердца. С учетом этого необходимо оценивать комплекс других диагностически значимых симптомов ИЭ. Определенные сложности возникают в диагностике на ранних этапах, особенно при первичном ИЭ, начало которого очень напоминает другие заболевания. Следует помнить о разнообразных вариантах начала ИЭ. • Типичное постепенное начало заболевания (субфебрильная температура тела, слабость, недомогание, головная боль, артралгии). В таких случаях ИЭ следует дифференцировать от ревматизма; при развитии аортальной недостаточности - от висцерального сифилиса. • Начало болезни по типу острого инфекционного заболевания: высокая температура тела с проливным потом и ознобом. Следует проводить дифференциальную диагностику с гриппом, брюшным тифом, малярией и другими инфекциями. • Болезнь начинается с развития тромбоэмболии (наиболее часто в мозг, селезенку, почки). ИЭ необходимо дифференцировать от инсульта. Наиболее часто ИЭ проявляется тромбоэмболиями в мозг у пожилых людей. Дифференциальную диагностику проводят с почечной коликой при эмболии в почки. • При возникновении симптомов острого гломерулонефрита (ОГН) в начале заболевания (гематурия, протеинурия, отеки, гипертензия) необходим учет диагностически значимых симптомов ИЭ (шум регургитации, данные ЭхоКГ, положительная гемокультура и др.). • Гематологическая маска ИЭ, выражающаяся в анемии, увеличении селезенки, требует проведения дифференциальной диагностики с целым рядом болезней системы крови. ИЭ наркоманов характеризуется: • наиболее частым поражением трикуспидального клапана; • наиболее распространенными возбудителями - белым и золотистым стафилококком, реже - грамотрицательной микрофлорой; • картиной прогрессирующей правожелудочковой недостаточности; • тромбоэмболией легочной артерии; • рецидивирующим течением. Некоторые признаки ИЭ (особенно вторичного) схожи с таковыми ОРЛ. Признаки, позволяющие дифференцировать ИЭ и ОРЛ (О.М. Буткевич и др., 1993): • ознобы; • увеличение селезенки; • положительная гемокультура; • лихорадка выше 38 °С; • узелки Ослера и кожный васкулит; • вегетации на клапанах; • анемия; • повышение активности щелочной фосфатазы нейтрофилов. Формулировка развернутого клинического диагноза должна отражать: • клинико-морфологическую форму ИЭ (первичный или вторичный); • этиологию (если удается повторно получить положительную гемокультуру); • характер клапанного поражения; • наиболее важные органные поражения с указанием выраженности функциональных расстройств (сердечная, почечная недостаточность, анемия и пр.); • осложнения (тромбоэмболии и пр.). Лечение При лечении больных ИЭ следует руководствоваться рядом правил: • использовать антибиотики, активные в отношении потенциальных и установленных возбудителей; • применять бактерицидные антибиотики, так как в вегетациях микроорганизмы находятся в низкой метаболической активности; • использовать антибиотики, обладающие синергизмом; • вводить антибиотики парентерально для получения более высоких и предсказуемых сывороточных концентраций; • антимикробная терапия должна быть длительной для обеспечения стерилизации вегетаций клапанов; • антибиотическую терапию следует начинать как можно раньше. Следует различать эмпирическую антибиотикотерапию ИЭ и антибиотикотерапию ИЭ установленной этиологии (известна бактериальная микрофлора). • Эмпирическая антибиотическая терапия ИЭ - ИЭ подострого течения: бензилпенициллин по 12-24 млн ЕД/сут в равных дозах каждые 4 ч в течение 4 нед; или ампициллин 175 мг/кг в сутки внутривенно в равных дозах каждые 4 ч в течение 4 нед + гентамицин 3 мг/кг в сутки внутривенно или внутримышечно в 2-3 введения в течение 2 нед; или ванкомицин по 15 мг/кг внутривенно каждые 12 ч в течение 4-6 нед + гентамицин 3 мг/кг внутривенно или внутримышечно в 2-3 дозах в течение 2 нед. • При ИЭ установленной этиологии (зеленящий стрептококк с различной вирулентностью) используют также бензилпенициллин в высоких дозах в сочетании с гентамицином или антибиотики группы цефалоспоринов III поколения (цефриаксон), аминогликозидов (тобрамицин); препараты вводят, как правило, внутривенно или внутримышечно (не менее 4 нед). - При ИЭ нестрептококковой этиологии целесообразно применять комбинированную терапию: бензилпенициллин чаще всего комбинируют с аминогликозидами (гентамицином). Гентамицин применяют в дозе 240-320 мг/сут (по 3-5 мг/кг) в виде курсового лечения: препарат вводят в течение 8 дней, затем 5-7 дней перерыв, повторное введение препарата в течение 8 дней, снова перерыв, при необходимости проводят третий курс. Цель прерывистого лечения - предупреждение нефротоксического, гепатотоксического действия препарата. У больных пожилого и старческого возраста суточная доза не должна превышать 240 мг. Вместо гентамицина может быть применен препарат этой же группы - сизомицин (по 2 мг/кг). Все препараты этой группы противопоказаны при почечной недостаточности и заболеваниях слухового нерва. Тем не менее комбинация бензилпенициллина с аминогликозидами - одна из наиболее эффективных при лечении ИЭ. - При ИЭ стафилококковой этиологии весьма эффективны полусинтетические пенициллины, устойчивые к ферменту пенициллиназе, продуцируемой стафилококком. Наиболее часто используют оксациллин (10- 20 г/сут), а также ампициллин, ампициллин + оксациллин по 10-16 г/сут. Эти препараты сочетают с гентамицином. При отсутствии эффекта от лечения следует назначать антибиотики цефалоспоринового ряда: цефотаксим по 6-8 г внутривенно или внутримышечно равными дозами каждые 6-8 ч (в течение 6 нед) в сочетании с амикацином (по 1-1,5 г внутримышечно равными дозами каждые 8-12 ч в течение 14 дней с интервалом 14 дней); цефалотин в дозе 8-12 г внутривенно или внутримышечно равными дозами каждые 6 ч в течение 6 нед. - При энтерококковой инфекции - бензилпенициллин 20-30 млн ЕД внутривенно или внутримышечно каждые 4 ч в течение 6 нед в сочетании со стрептомицином по 1 г внутримышечно равными дозами каждые 12 ч в течение 4 нед. При недостаточном эффекте от данной комбинации препаратов назначают ампициллин по 8-12 г внутримышечно равными дозами каждые 6 ч в течение 6 нед с гентамицином в обычных дозах. - Лечение грибкового ИЭ проводят амфотерицином (по 30-55 мг/сут). Курс - не менее 40-50 дней. Используют также флуконазол. - В качестве антибиотиков резерва используют доксициклин и фузидовую кислоту (по 2-3 г/сут). К основным антибиотикам, применяемым при ИЭ, относят также рифампицин (в дозе 600-1200 мг в капсулах и внутривенно), действующий на стафилококки и стрептококки. Препарат оказывает сенсибилизирующее действие, поэтому всегда лучше проводить один длительный курс лечения, чем повторные короткие курсы. Чаще применяется как резервный препарат при неэффективности других антибиотиков. Отмену антибиотиков производят сразу, без постепенного уменьшения дозы. После отмены антибактериальных препаратов при хорошем самочувствии и благополучных лабораторных показателях больного наблюдают в стационаре еще 7-10 дней для исключения развития ранних рецидивов. Если в процессе лечения развивается резистентность микроорганизмов к проводимой терапии (что проявляется возвратом симптомов: вновь повышается температура тела, появляются ознобы, слабость, повышается СОЭ), то следует резко повысить дозу применяемых антибиотиков либо сменить препарат. Следует отметить, что существует ряд факторов, обусловливающих резистентность к проводимой антибиотикотерапии. Это позднее начало лечения (в связи с трудностями диагностики); особая вирулентность микрофлоры; наличие микробных ассоциаций (патологический процесс вызывается не одним микроорганизмом); пожилой возраст больных; поражение нескольких клапанов одновременно; эндокардит трехстворчатого клапана; ИЭ, развивающийся у больных, имеющих протезы клапанов или подвергающихся гемодиализу. Глюкокортикоиды применяют в настоящее время для лечения ИЭ нечасто. Следует отметить, что при лечении ИЭ глюкокортикоиды показаны при резко выраженных иммунных сдвигах: высоком уровне ЦИК в крови, концентрации IgM и IgА, васкулите, артрите, миокардите, а также в случае высокой аллергической чувствительности к антибиотикам. Назначают обычно небольшие дозы (15-20 мг преднизолона в сутки). Лечение глюкокортикоидами необходимо проводить обязательно в сочетании с антибиотиками и заканчивать его за 1 нед до отмены антибиотиков. Из препаратов иммунотерапии применяют противостафилококковый иммуноглобулин человека в сочетании с антибактериальной терапией (5 вливаний на курс), что может обеспечить при стафилококковом ИЭ наступление стойкой ремиссии, которую иногда не удается получить при применении одних антибиотиков. В ряде случаев эффективны сеансы плазмафереза, во время которых удаляют из крови различные иммунные комплексы. В случае необходимости назначают симптоматическое лечение: • при сердечной недостаточности - мочегонные средства и ингибиторы АПФ; • при тромбоэмболии - фибринолитики и антикоагулянты, хирургическое удаление эмбола; • при анемии - препараты железа; • при кахексии - анаболические стероиды; • при повышении АД - антигипертензивные препараты и т.д. В последние годы применяют хирургическое лечение ИЭ, показаниями к которому служат: • устойчивость к антибиотикам различных групп в течение 3-4 нед; • прогрессирующая сердечная недостаточность вследствие клапанной деструкции (но не миокардита); • выделение возбудителей, устойчивых к антибактериальной терапии (грибы, синегнойная палочка и др.); • эндокардит протеза; • абсцессы миокарда, клапанного кольца, внутрисердечные гнойные фистулы; • крупные (более 10 мм), рыхлые, подвижные вегетации на клапанах или хордах, угрожающие развитием тромбоэмболий, обнаруживаемые с помощью чреспищеводной ЭхоКГ; • повторяющиеся эмболии. Операция состоит в замене пораженного клапана протезом (при непрерывной антибиотикотерапии). Летальность при неотложной замене аортального клапана довольно высока (около 30%), тогда как при плановой операции она значительно ниже (9%). Исходы и эволюция инфекционного эндокардита • Ближайшие исходы: - полное выздоровление (с формированием порока сердца или реже без него) - 70-80%; - смерть на ранних этапах болезни от прогрессирования инфекции - 10%; - летальные эмболии - 10-20%; - переход в хроническое течение, возможны рецидивы болезни: V ранние рецидивы - наиболее опасны, возникают в течение первых 1-3 мес (отмечают в 10-15% случаев); V поздние рецидивы - возникают в более продолжительные сроки, обычно - после ремиссии патологического процесса. • Отдаленные исходы: - смерть при прогрессировании сердечной недостаточности (60-65%); - формирование хронического нефрита и смерть от прогрессирующей почечной недостаточности (10-15%). Прогноз Раннее начало лечения антибиотиками в оптимальных дозах может полностью подавить воспалительный процесс. Так, выздоровление от ИЭ, вызванного зеленящим стрептококком, отмечают у 80-90% больных. Однако при других возбудителях прогноз хуже. Так, при стафилококковом и особенно грибковом ИЭ летальность достигает 70-90%, поэтому если говорить об отдаленных результатах лечения, то полное выздоровление отмечается лишь у 1/3 больных. Прогноз при аортальной локализации эндокардита хуже, чем при митральной. При врожденных пороках ближайший и отдаленный прогноз лучше, чем при приобретенных. Профилактик а У больных пороками сердца и другими заболеваниями, которые могут осложняться ИЭ, необходима тщательная санация инфекционных очагов, раннее и энергичное лечение любой интеркуррентной инфекции. Следует профилактически использовать лечение антибиотиками короткими курсами у лиц с повышенным риском развития ИЭ (экстракция зубов, снятие зубных камней, тонзиллэктомия, удаление катетера после урологических операций, ФГДС, колоноскопия и пр.). Согласно международным рекомендациям существует схема профилактических мер при разных инвазивных вмешательствах. • При манипуляциях в полости рта (зубы, миндалины, придаточные пазухи носа), фибробронхоскопии, эзофагоскопии: - при отсутствии аллергических реакций к бензилпенициллину назначают внутрь амоксициллин по 2,0 г за 1 ч до предполагаемого вмешательства; если прием внутрь по каким-либо причинам невозможен, то амоксициллин или ампициллин вводят внутривенно в дозе 2,0 г за 0,5-1 ч до предполагаемого вмешательства; - при наличии аллергических реакций к бензилпенициллину за 1 ч до предполагаемого вмешательства назначают внутрь клиндамицин в дозе 600 мг или азитромицин, кларитромицин в дозе 500 мг). • При манипуляциях в урогенитальной области или фиброгастроскопии (колоноскопии): - при отсутствии аллергических реакций к бензилпенициллину: в группе больных высокого риска - ампициллин или амоксициллин по 2,0 г внутривенно + гентамицин в дозе 1,5 мг/кг внутривенно за 0,5-1 ч до вмешательства, через 6 ч после вмешательства - ампициллин или амоксициллин по 2,0 г внутрь; в группе больных умеренного риска - ампициллин или амоксициллин 2,0 г внутривенно за 0,5-1 ч до вмешательства (или амоксициллин 2,0 г внутрь); - при аллергической реакции к бензилпенициллину: в группе больных высокого риска - ванкомицин по 1,0 г более чем за 1-2 ч до процедуры + гентамицин по 1,5 мг/кг внутримышечно; в группе больных умеренного риска - ванкомицин по 1,0 г более чем за 1-2 ч до процедуры без гентамицина.
Дата добавления: 2014-05-16 | Просмотры: 2033 | Нарушение авторских прав |