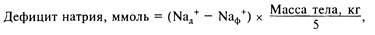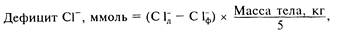|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
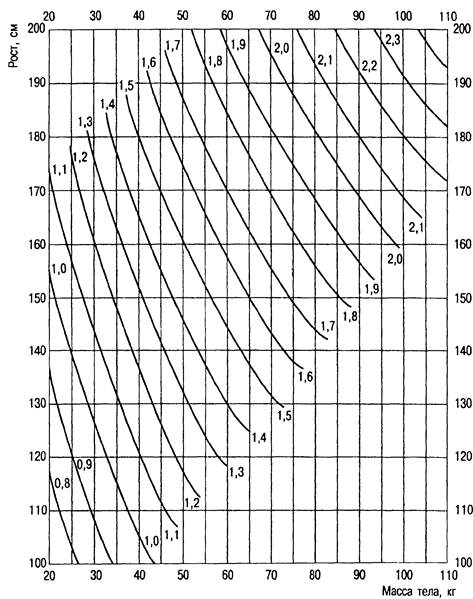
НАРУШЕНИЯ БАЛАНСА ЭЛЕКТРОЛИТОВНарушения баланса катионов и анионов, выполняющих важные функции, вызывают значительные сдвиги во внутренней среде организма. Изменения концентрации электролитов в жидких средах обусловливают изменения осмоляльности, способствуют патологическому перемещению жидкости из одного водного раздела в другой, нарушают функции органов и систем, приводят к сдвигам КОС и биоэлектрического, мембранного потенциала. Нарушения баланса натрия. Концентрация натрия в плазме равна 135—147 ммоль/л, в клетках — 10 ммоль/л. Суточная потребность в натрии составляет 50—70 ммоль/м2 или 50—70 мл 5,8 % раствора NaCl на 1 м. Определение площади поверхности тела представлено на рис. 20.3. Содержание натрия в организме 100 г/70 кг.
Рис. 20.3. Номограмма для определения площади поверхности тела у взрослых по росту и массе методом Дюбуа. Гипонатриемия — уменьшение уровня натрия плазмы ниже 135 ммоль/л. Дефицит натрия не следует смешивать с понятием «гипонатриемия». Последняя может отмечаться при сниженном, нормальном или повышенном содержании натрия в организме. Причинами дефицита натрия служат патологические потери его из желудочно-кишечного тракта (рвота, диарея, длительное зондирование, кишечные свищи); потери с мочой (поражение канальцев почек, форсированный диурез); потери через кожу (обильное потение); недостаточное поступление натрия; нарушения центральных механизмов регуляции (нарушение образования АДГ, надпочечниковая недостаточность). Потери натрия происходят, как правило, вместе с потерями других ионов: хлоридов, гидрокарбоната, сульфата и калия. Снижение концентрации натрия плазмы при его нормальном содержании в организме может быть вызвано гипергидратацией и гемодилюцией. Этот так называемый дефицит натриевой концентрации не является истинным дефицитом натрия. При дефиците натрия уменьшается объем внеклеточной жидкости. Вследствие гипонатриемии снижается осмоляльность плазмы, и происходит гипергидратация клеток. Симптомы недостаточности натрия не следует смешивать с дегидратацией. Различие можно установить, ориентируясь на клинические признаки. При умеренном дефиците натрия (0,5 г NaCl на 1 кг) наблюдаются усталость, апатия, головокружение, возможность обморока в вертикальном положении. При более выраженном дефиците натрия (1 г/кг) — тошнота, рвота, гипорефлексия, гипотония, ступор, кома и судороги. Лечение дефицита натрия во многом сходно с таковым при гипоосмоляльной гипонатриемии (см. выше). Для коррекции дефицита натрия используют формулу:
где Naд+ — должная концентрация натрия, Nаф+ — фактическая концентрация натрия в плазме; (масса тела, кг): 5 — объем внеклеточной жидкости. Гипернатриемия — увеличение уровня натрия плазмы выше 147 ммоль/л. Причинами могут быть олигурия, значительные потери гипотонической жидкости, избыточное поступление натрия, первичный альдостеронизм, синдром Кушинга, прием кортикостероидов и АКТГ, ограничение введения жидкости. В клинической картине преобладают явления, обусловленные гиперосмоляльностью плазмы: жажда, гипертермия, отечность, повышение АД. В тяжелых случаях — мозговые симптомы, сердечная недостаточность и клеточная дегидратация. Лечение. См. Гиперосмолярная гипернатриемия. Нарушения баланса калия. Концентрация калия в плазме — 3,8—5,2 ммоль/л, в клеточной жидкости 120—160 ммоль/л. 98 % калия находится в клетках и лишь 2 % — внеклеточно. Общее содержание калия в теле взрослого человека массой 70 кг равно 150 г. Уровни калия во внеклеточной и внутриклеточной жидкостях должны постоянно поддерживаться, чтобы не вызвать функциональных нарушений сердечной и нейромышечной систем. Суточная потребность калия — 50—70 ммоль/м2, 40 ммоль/1000 ккал. В норме широкие вариации ежедневного потребления калия полностью компенсируются соответствующим выделением калия почками. Высокая клеточная концентрация калия сопровождается более быстрым его выделением и наоборот. На распределение калия между внутриклеточной и внеклеточной жидкостью влияют многие факторы. Альдостерон и инсулин способствуют повышению содержания клеточного калия. Ацидоз вызывает сдвиг уровня внутриклеточного калия во ВнеКЖ, а алкалоз — обратный сдвиг. Стресс, катаболизм белка сопровождаются освобождением внутриклеточного калия и переходом его во ВнеКЖ. Концентрация калия в моче зависит от его количества, распределяющегося для резорбции в дистальных канальцах, от количества, выделяющегося в тубулярный люмен, от степени окисления мочи и от уровня АКТГ. Во время лечения диуретиками (фуросемид, этакриновая кислота, тиазид или маннитол) большое количество натрия распределяется в дистальные канальцы и под влиянием альдостерона этот натрий реабсорбируется, в то время как калий теряется с мочой. Во время инфузий растворов, содержащих свободный калий, назначение раствора хлорида натрия также стимулирует калийурез. Уровень калия в плазме в отсутствие кислотно-основного дисбаланса и других факторов, вызывающих изменения баланса калия, может быть использован как критерий общего содержания калия в организме. Ориентировочно можно допустить, что снижение калия в сыворотке на 1 ммоль/л соответствует потере 200—300 ммолей калия из клеточного пространства. Этот расчет не следует применять для определения избытка калия при гиперкалиемии. Гипокалиемия — уменьшение концентрации калия плазмы ниже 3,8 ммоль/л. Истинный дефицит калия (калиевое истощение) может не соответствовать данным исследованиям калия в плазме. Тем не менее результаты динамического определения этого показателя и клинические данные позволяют установить нарушения баланса ионов. Механизм калиевого истощения включает в себя недостаточное поступление этого иона, почечное выделение калия и его наружные потери. В условиях нормального метаболизма снижение уровня калия может возникать только при его недостаточном поступлении. Причинами калиевого истощения могут быть потери из желудочно-кишечного тракта (рвота, постоянная аспирация, кишечные свищи, понос, язвенный колит, перитонит), потери с мочой (заболевания почек, сопровождающиеся полиурией, осмотический диурез, назначение диуретиков); первичный или вторичный альдостеронизм (синдром Бартера, синдром Лиддла), нарушения гуморальной регуляции (гиперкортицизм, синдром Кушинга, лечение гормонами), перемещение калия во внутриклеточное пространство после лечения глюкозой и инсулином (подтверждается снижением уровня калия плазмы), метаболический алкалоз, дефицит магния, недостаточное поступление калия в организм. Выведение калия почечными канальцами патогномонично для канальциевого ацидоза. Гипокалиемию могут вызвать некоторые антибиотики (карбинециллин в больших дозах, амфотерицин В, возможно, гентамицин). Нормальный уровень калия в плазме у больного с ацидозом, как правило, свидетельствует о дефиците калия. При умеренной гипокалиемии и дефиците калия внешние клинические симптомы могут отсутствовать. При прогрессировании дефицита калия клинические проявления связаны с изменениями в трансмембранном потенциале и возбудимости нейромышечных тканей. Вначале больной жалуется на мышечную слабость, особенно в мышцах ног. При более выраженной гипокалиемии и дефиците калия развивается генерализованная слабость скелетных мышц. Мышечная слабость может продолжаться вплоть до общей арефлексии, паралича и смерти от недостаточности дыхательных мышц. Особенно опасна острая гипокалиемия, при которой указанные симптомы могут быстро прогрессировать. При остром дефиците калия возможны паралитическая непроходимость кишечника, рабдомиолиз и миоглобинурия. Гипокалиемия и дефицит калия обычно сопровождаются сердечными нарушениями, связанными с изменениями проводимости (брадикардия, суправентрикулярные и вентрикулярные нарушения). На ЭКГ определяются типичные изменения: уплощение и инверсия зубца Г, увеличение выступа зубца U и прогиб сегмента ST. Дефицит калия усиливает кардиотоксическое действие препаратов наперстянки. Клинические симптомы могут быть связаны как со снижением уровня калия в плазме, так и с общим уменьшением содержания его в организме. Быстрое снижение уровня калия в плазме до 2,2 ммоль/л способно вызвать остановку сердца. Важным почечным механизмом калиевого истощения является снижение концентрирующей способности почек, приводящее к полиурии, никтурии и полидипсии. Более выраженные симптомы дефицита калия наблюдаются при сопутствующем метаболическом ацидозе. При метаболическом алкалозе общее состояние больного и мышечный тонус нарушаются меньше. Лечение. Следует помнить, что гипокалиемический синдром легче предупредить, чем лечить. Постоянное наблюдение за уровнем калия в плазме и другими электролитами, выявление калиевых потерь позволяют вовремя начать профилактическое лечение. При отсутствии энтерального пути усвоения необходимо обеспечить суточную потребность калия, равную 50—70 ммоль/м2. При выявленном дефиците калия и гипокалиемии первичная задача заключается в осторожной коррекции дефицита калия и предупреждении его дальнейшего дисбаланса. Лечение проводят с помощью внутривенных инфузий поляризующих калиевых коктейлей, имеющих в своем составе калий, глюкозу и инсулин. Обычно требуется от 100 до 150 ммоль калия в сутки. Скорость введения не должна превышать 20 ммоль калия в час. Необходимо проводить кардиомониторинг, постоянные измерения уровня калия в плазме. Если не нарушена функция желудочно-кишечного тракта, то хлорид калия назначают в виде добавок в дневной рацион питания (эликсир или таблетки). Максимальное количество калия, вводимое внутривенно, не должно превышать 200 ммоль в сутки, при этом следует соблюдать большую осторожность, наблюдать за ЭКГ, чтобы избежать токсического эффекта калия. Нередко требуется коррекция не только калия, но и других веществ. Одновременное развитие гипокалиемии и гипокальциемии маскируется нейромышечными нарушениями, характерными для каждого из этих ионов. Поэтому проводят коррекцию одновременно калия и кальция. Гиперкалиемия — увеличение концентрации калия в плазме выше 5,2 ммоль/л. Причинами гиперкалиемии могут быть почечная недостаточность, олигурия и анурия любого происхождения, недостаточность надпочечников, массивные травматические повреждения тканей, быстрое переливание консервированной крови, усиленный распад белков (катаболизм) и мобилизация гликогена из клеток (гликогенолиз), интоксикация препаратами наперстянки, ацидоз, гиперосмолярность жидких сред, дефицит инсулина, избыточное введение калия. Как и при гипокалиемии, клинические симптомы гиперкалиемии появляются в результате нарушений функции поперечно-полосатой мускулатуры: слабость, повышение тонуса мышц вплоть до мышечного паралича. К наиболее существенным признакам гиперкалиемии относятся сердечные аритмии. Самые ранние изменения на ЭКГ заключаются в появлении высокоамплитудного зубца Т, затем — расширении комплекса QRS и удлинении интервала P—R. При более тяжелой гиперкалиемии появляются блокады сердца, исчезает зубец Р, наблюдается слияние QRS и зубца Т. Вслед за этим наступают желудочковая фибрилляция и асистолия. Остановка сердца возможна, если концентрация калия в плазме равна или превышает 7 ммоль/л. Наиболее опасны быстрые изменения концентрации калия в плазме. Метаболический ацидоз способствует развитию гиперкалиемии. Опасность гиперкалиемии возрастает при гипонатриемии и гипокальциемии. Лечение. Выраженная интоксикация сердечной мышцы наиболее эффективно снимается назначением кальция. Для этого 10—20 мл 10 % раствора глюконата кальция вводят внутривенно в течение 1—5 мин под контролем ЭКГ. Лактат натрия или бикарбонат повышают рН внеклеточной жидкости и способствуют переходу калия в клетки. Таким же действием обладает глюкоза или декстроза. Если олигурия не связана с органической почечной недостаточностью, то на фоне инфузионной терапии (глюкоза, гидрокарбонат и хлорид натрия) назначают диуретики. В случаях выраженной кардиотоксичности и почечной недостаточности показан перитонеальный диализ или гемодиализ. Нарушения баланса кальция. Концентрация общего кальция в крови 2,2—2,6 ммоль/л, кальция ионизированного — 1,14—1,3 ммоль/л, 99 % кальция находится в скелете, его общее содержание в организме человека массой 70 кг составляет 1000—1500 г. Общая концентрация кальция в сыворотке крови представлена суммой трех компонентов: Са2+, связанный с белком, в основном с альбуминами; Са2+, связанный с другими веществами (например, фосфат); Са2+, ионизированный. Почти 50 % общего кальция находится в ионизированном состоянии, и эта форма отвечает за регулирование нейромышечной функции. В клетках кальций не содержится. Ежедневная потребность взрослого в кальции составляет 7,5—20 ммоль/м2 и находится в зависимости от энергии (2,2—4 ммоль/1000 ккал). Если невозможно прямое определение концентрации ионизированного кальция, определяют уровень связывающего его белка. При алкалозе уровень ионизированного кальция снижается, при ацидозе — повышается. Нарушение баланса кальция происходит вследствие нарушений взаимодействия паратиреоидного гормона (ПТГ), кальцитонина и витамина D. Гипокальциемия — уменьшение концентрации кальция в плазме ниже 2,2 ммоль/л, точнее — его ионизированной части (ниже 1,1 ммоль/л). Снижение уровня кальция наблюдается при острой или хронической почечной недостаточности (как результат задержки фосфата почками), дефиците витамина D, нарушениях кишечной абсорбции его, понижении функции ПТГ. Гипокальциемия может возникать при переливании большого количества цитратной крови, панкреатите, после обширных операций на органах желудочно-кишечного тракта, невозмещенных потерях и парентеральном питании. Основным признаком гипокальциемии является повышение нейромышечной возбудимости, приводящее к тетании. Возможны онемение и покалывание пальцев и ногтей, спазм свода стопы, судороги мышц («рука акушера», «конская стопа»), ларингоспазм, боли в животе, головная боль, головокружение, пароксизмальная тахикардия, психические нарушения, наклонность к спазмофилии и другие признаки. На ЭКГ — удлинение инервала QT. Лечение. При гипокальциемии необходимо внутривенное введение 10 % раствора хлорида кальция или глюконата кальция в дозе 10 мл, чтобы корректировать острые симптомы. При продолжающейся гипокальциемии растворы кальция вводят повторно, иногда многократно. Следует помнить о повышении чувствительности сердца к кальцию при дигиталисной терапии (возможно появление желудочковых экстрасистол, фибрилляции желудочков и остановки сердца в систоле). При хронической форме гипокальциемии назначают соли кальция и витамин D внутрь. Гиперкальциемия — увеличение концентрации кальция в плазме более 2,6 ммоль/л. Причины — различные заболевания (новообразования костей, гиперпаратиреоидизм), длительный период иммобилизации, уменьшение объема внеклеточной жидкости, истощение фосфата, чрезмерное введение кальция или витамина D. Клиническая симптоматика гиперкальциемии включает в себя изменения и нарушения функций некоторых органов и систем: почечной, скелетно-мышечной, сердечно-сосудистой и ЦНС, нарушается функция желудочно-кишечного тракта. Эти признаки включают нефролитиаз, азотемию, снижение концентрирующей способности почек, мышечную слабость, апатию, снижение мозговой способности. Нередко появляются боли в животе, тошнота и рвота, анорексия, парез кишечника. Могут быть артериальная гипертензия, укорочение интервала QT и расширение зубца Т на ЭКГ. Лечение. Необходимо помнить, что повышение уровня кальция в крови выше 3,7 ммоль/л опасно для жизни. Проводят лечение основного заболевания, корригируют дисбаланс электролитов, восстанавливают объем внеклеточной жидкости, применяют диуретики (лазикс или этакриновую кислоту), растворы хлорида и сульфата натрия, увеличивают почечную экскрецию кальция. При интоксикации применяют витамин D и препараты коры надпочечников. Введение неорганического фосфата снижает уровень кальция в крови. Иногда положительный эффект может быть получен при назначении кальцитонина. При почечной недостаточности применяют гемодиализ. Нарушения баланса магния. В норме концентрация магния в плазме равна 0,8—1,2 ммоль/л. Общее содержание магния в теле взрослого человека массой 70 кг составляет 20—28 г. 50 % магния находится в костной и хрящевой ткани, остальная часть — преимущественно в клетках. Лишь очень небольшое количество содержится во внеклеточной жидкости. Ежедневная потребность взрослого человека составляет 5—15 ммоль/м2 магния. На каждые 1000 ккал необходимо 2,5—4 ммоля магния. Недостаточность магния в организме не всегда подтверждается уменьшением его уровня в плазме. Гипомагниемия и дефицит магния. Концентрация магния в плазме ниже 0,8 ммоль/л называется гипомагниемией. В тех случаях, когда снижение концентрации магния в плазме сопровождается общим дефицитом этого иона, возникают характерные симптомы. Причины дефицита магния: заболевания желудочно-кишечного тракта (диарея, кишечные свищи, перитонит), почек (полиурическая стадия острой почечной недостаточности, форсированный диурез), хронический алкоголизм, цирроз печени, острый панкреатит, гиперпаратиреоидизм, недостаточное поступление магния. Дефицит магния характеризуется изменчивостью клинической картины. Выделяют церебральную форму (депрессия, страх, нервозность, гиперрефлексия, оглушенность, потеря сознания), висцеральную форму (ларинго- и бронхоспазм, дискинезия желчных путей, спазм сфинктера Одди и анального сфинктера, судорожные сокращения желудка, тошнота, рвота, диарея), сердечно-сосудистую форму (стенокардия, тахикардия, гипотензия) и мышечно-тетаническую форму (парастезии, судороги лица, затылка, жевательной мускулатуры, плеча, голени, стопы, тетанус). Остро возникающий дефицит магния может быть причиной сердечной недостаточности, аритмий и внезапной смерти. Гипомагниемия вызывает рефракторную желудочковую фибрилляцию и препятствует восполнению запасов внутриклеточного калия. Лечение. Для профилактики и лечения дефицита магния применяют 25 % раствор сульфата магния. 1 мл 25 % раствора сульфата магния содержит 2 ммоль магния. Для профилактики дефицита магния следует вводить ежедневно по 3—12 мл 25 % раствора сульфата магния. Для коррекции дефицита магния вводят до 30 ммоль магния в сутки. При фибрилляции желудочков и желудочковой тахикардии, связанных с дефицитом магния, доза сульфата магния составляет 1—2 г в разведении на 100 мл 5 % раствора глюкозы. Этот раствор вводят в течение 1—2 мин, в менее экстренных случаях — в течение 5—60 мин; поддерживающая доза вводится со скоростью 0,5—1,0 г/ч в течение 24 ч. Гипермагниемия — повышение концентрации магния в плазме более 1,2 ммоль/л. Причины: почечная недостаточность, катаболизм белка, диабетический кетоз, избыточное введение. Симптомы: гипотензия, сонливость, гипорефлексия, угнетение дыхания, кома, остановка сердца. Лечение. Проводят лечение основного заболевания, вводят жидкость, восстанавливают водный и электролитный баланс, при отсутствии противопоказаний назначают диуретики. Положительный эффект можно получить при введении 10—20 мл 10 % раствора глюконата кальция внутривенно. Если нет эффекта от кальциевой терапии, назначают прозерин в дозе 0,5—1 мг подкожно, внутримышечно или внутривенно в зависимости от показаний.
Нарушение баланса фосфора — гипофосфатемия. У взрослых людей нормальная концентрация неорганического фосфора в сыворотке крови, представляемого как фосфаты, составляет 0,87—1,45 ммоль/л с некоторым снижением в пожилом и старческом возрасте. В организме взрослого человека содержится 500—800 г фосфора, что составляет 1 % от массы тела, 80—88 % его находится в скелете, 10—15 % — в соединительной ткани и только около 1 % или менее — во внеклеточной жидкости. Соотношение внутриклеточной и внеклеточной концентрации приблизительно 100:1. В организме человека фосфор существует в органической и неорганической формах. Основная органическая составная фосфора есть в структуре каждой клетки. Внутриклеточный неорганический фосфор, являющийся малой частью общего фосфора, обеспечивает образование сложного субстрата для синтеза энергии, включающего в себя АТФ. Суточная потребность в фосфоре — 0,15 ммоль/кг. Обычно взрослый человек получает с пищей 1000—1200 мг фосфора в сутки, хотя это количество широко варьирует в зависимости от рациона. Биологическая роль фосфора огромна. Фосфор вовлечен в энергетический обмен организма, участвует в переносе энергии. В критических ситуациях, когда возрастает потребность тканей в энергии и кислороде, происходят изменения в фосфорном обмене, что сопровождается усиленным транспортом энергии и кислорода к тканям. Фосфор важен для структурной целостности клеток, синтетических и метаболических процессов; он регулирует активность большого количества ферментов; соединяясь с кальцием, образует нерастворимые соли, необходимые для образования костей; является частью мочевого буфера, что обеспечивает экскрецию связанных кислот; а также участвует в процессах иммунитета и свертывания крови. В основе гипофосфатемии лежат три основных механизма: перемещение фосфатов в клетки и кости, уменьшение интестинальной фосфорной абсорбции или увеличение потерь фосфора из кишечника, увеличение экскреции фосфатов с мочой вследствие уменьшения их реабсорбции в почках. Перемещение фосфатов в клетки возникает при парентеральном назначении растворов глюкозы или фруктозы, особенно при длительном непрерывном введении. Недостаточное поступление фосфора чаще всего наблюдается при длительном парентеральном питании, выраженном истощении, при заболеваниях и дисфункциях желудочно-кишечного тракта. Рвота, диарея, длительная назогастральная аспирация также могут быть причиной тяжелой гипофосфатемии. Увеличение экскреции фосфатов с мочой возникает при объемной нагрузке и применении диуретиков. Снижение концентрации калия, кальция и магния в сыворотке крови сопровождается гипофосфатемией. Сдвиг фосфатов в клетки и нарушение почечной реабсорбционной способности наблюдаются при ацидозе. У больных с тяжелыми ожогами задерживается большое количество солей и воды. По мере выздоровления и при резком повышении диуреза происходит потеря фосфора. При анаболических процессах фосфор активно включается в состав клеток, переходя во внутриклеточную среду. Септицемия грамотрицательной флорой часто сопровождается снижением концентрации фосфора в крови. Снижение почечной фосфатной реабсорбции и уменьшение интестинальной абсорбции фосфатов и кальция характерны для дефицита витамина D. Увеличение внутриклеточного фосфатного сдвига часто наблюдается у больных с диабетическим кетоацидозом, когда в фазе декомпенсации внутриклеточный фосфор и калий проходят в экстрацеллюлярный сектор и выделяются почками при осмотической полиурии, приводя к потере жидкости, калия и фосфора. Хронический алкоголизм и алкогольная абстиненция — частые причины снижения сывороточной концентрации фосфора. В многочисленных публикациях показано, что большая хирургия связана с изменениями баланса фосфора в организме. Авторы едины во мнении, что хирургическое вмешательство приводит к гипофосфатемии, которая развивается во время операций и продолжается в послеоперационном периоде. Причина хирургической гипофосфатемии окончательно не выяснена. В некоторых случаях гипофосфатемия приобретает характер тяжелого патофизиологического синдрома и сопровождается высокой летальностью. Из наиболее значимых клинических проявлений гипофосфатемии можно выделить следующие: 1) гипоксия органов и тканей в связи с нарушением транспорта кислорода, необходимого для выработки энергии. Особую угрозу это представляет для функции ЦНС; 2) нарушения деятельности ЦНС (парастезии, тремор, атаксия, страх, спутанность сознания вплоть до комы); 3) возможность сердечной недостаточности в связи с угнетением сократительной способности миокарда; 4) возможность дыхательной недостаточности в связи с нарушением функции диафрагмы и дыхательных мышц; 5) нарушения свертывающей системы крови (в эксперименте показано, что гипофосфатемия приводит к нарушениям функции тромбоцитов, ретракции сгустка крови, увеличению скорости исчезновения тромбоцитов из кровотока). Можно предположить, что гипофосфатемия является одним из этиологических факторов ДВС-синдрома. Лечение. В случае тяжелой гипофосфатемии рекомендуется только внутривенное введение растворов фосфора. Поскольку гипофосфатемия часто сочетается с гипокалиемией и гипомагниемией, используются фосфатные растворы, содержащие калий, натрий и магний, хотя чаще используются фосфорно-натриевые. Дефицит магния корригируется назначением 25 % раствора сульфата магния. Готовые гипертонические парентеральные растворы, содержащие фосфор, должны быть разведены перед употреблением. Начальная доза 0,08 % ммоль/кг, если гипофосфатемия недавняя и неосложненная, и 0,16 ммоль/кг, если длительная. Первоначальные дозы могут быть увеличены от 25 до 50 %, если имеются симптомы гипофосфатемии; либо снижены при гиперкальциемии. Каждая доза должна быть введена внутривенно в течение 6 ч. Для возмещения дефицита фосфата при гипофосфатемии в рамках парентерального питания может быть использован ампулированный глицерофосфат натрия («Фрезениус»). 1 мл этого концентрированного раствора содержит смесь глицерол-1(2)-дигидрофосфата солей динатрия в воде для инъекций. Каждый миллилитр раствора содержит 2 ммоль натрия и 1 ммоль фосфата. Перед употреблением ампулированный глицерофосфат натрия должен быть разведен. Для внутривенной инфузии он смешивается с основным инфузионным раствором. Дозировка — в соответствии с потребностью и с учетом номограммы. Средняя доза для взрослых составляет 20—40 мл/сут. Добавку (разведение) производят с соблюдением мер предосторожности, стерильно, непосредственно перед началом инфузии. Инфузия должна заканчиваться через 6—8 ч после смешивания. Смешивание возможно с растворами, содержащими кальций и магний. Глицерофосфат натрия не должен вводиться неразбавленным. Для контроля эффективности фосфатной терапии необходим регулярный и тщательный анализ уровня фосфата в сыворотке и моче. Лечение проводится ежедневно до возмещения фосфата. Глицерофосфат натрия противопоказан при гиперфосфатемии, гипернатриемии и почечной недостаточности. Нарушения баланса хлора. В норме концентрация хлора в плазме равна 100—106 ммоль/л. Общее содержание хлора в организме примерно равно 100 г. Хлор преимущественно содержится во внеклеточной жидкости. Ежедневная потребность в хлоре составляет 50—70 ммоль/м2. Хлор выделяется с мочой и потом. Увеличение его потерь может быть при рвоте, полиурии, значительной потливости. Содержание хлора регулируется альдостероном. Уменьшение концентрации хлора в плазме сопровождается увеличением гидрокарбонатного буфера и алкалозом. Это состояние может сопровождаться судорогами. Гиперхлоремия возникает при общей дегидратации, обусловленной недостатком свободной воды; при избыточном поступлении, например при переливании большого количества растворов, содержащих большую по сравнению с плазмой концентрацию хлора. Расчет дефицита хлора, как и дефицита натрия, можно определить по формуле:
где Сlд — должная концентрация, С1ф — фактическая концентрация хлора. Коррекцию дефицита хлора проводят преимущественно растворами натрия хлорида, при дефиците калия добавляют растворы КС1. При повышенной концентрации хлора в плазме введение растворов, содержащих хлор, прекращают. Вводят преимущественно безэлектролитные растворы, снижая до нормы осмолярность плазмы. Дата добавления: 2014-12-12 | Просмотры: 1193 | Нарушение авторских прав |