|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
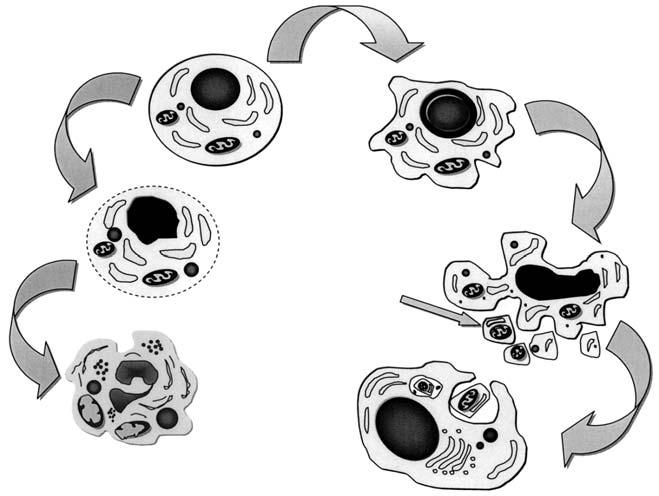
Некроз и апоптоз
Нормальная клетка
Апоптозное тельце
Фагоцит
Некроз
Апоптоз
При апоптозе повреждение ДНК, недостаток факторов роста, воздействие на рецепторы, нарушение метаболизма ведут к акти-вации внутренней самоуничтожающей программы (схема 2.4). Синхронно с уплотнением хроматина под влиянием эндонуклеаз начинается деградация ДНК до фрагментов в 180—200 пар осно-ваний. Эндонуклеазы расщепляют двойную цепочку ДНК между нуклеосомами. В результате активации цитоплазматических про-теаз происходит разрушение цитоскелета, межклеточных контак-тов, связывание белков и распад клетки на апоптозные тельца. Быстрое распознавание и фагоцитоз апоптозных телец указыва-ют на наличие на их поверхности специфических рецепторов, облегчающих адгезию и фагоцитоз. Важнейшим свойством апоп-тоза считается сохранение внутриклеточного содержимого в мембранных структурах, что позволяет осуществить элимина-цию клетки без развития воспалительного ответа. Характерные признаки апоптоза связаны с характером воздействия и типом клеток.
К о н д е н с а ц и я х р о м а т и н а обусловлена расщеплением ядерной ДНК, которое происходит в участках связей между нуклео-сомами и приводит к образованию фрагментов. Такие фрагменты создают характерную для апоптоза картину ядра в отличие от некро-за, при котором ядро выглядит пятнистым. Эта интернуклеосомаль-ная фрагментация ДНК развивается с участием кальций-чувстви-тельной эндонуклеазы. Эндонуклеаза постоянно присутствует в некоторых типах клеток, например тимоцитах, в других клетках фермент образуется перед началом апоптоза.
Н а р у ш е н и е о б ъ е м а и р а з м е р о в к л е т о к объясняют активностью трансглютаминазы. Этот фермент вызывает перекрест-ное связывание цитоплазматических белков, образующих оболочку под плазматической мембраной.
Ф а г о ц и т о з а п о п т о з н ы х т е л е ц макрофагами и другими типами клеток обеспечивается рецепторами. Одним из таких рецеп-торов у макрофагов является витронектиновый рецептор α vβ3-инте-грин, обеспечивающий фагоцитоз апоптозных нейтрофилов.
Одной из важных особенностей апоптоза является его з а в и с и - м о с т ь о т а к т и в а ц и и г е н о в и с и н т е з а б е л к а. Индукция апоптоз — специфических генов обеспечивается за счет специаль-ных стимулов, таких как белки теплового шока и протоонкогены.
Н е к о т о р ы е г е н ы (онкогены и супрессорные гены) и г р а ю т р е г у л я т о р н у ю р о л ь в и н д у к ц и и а п о п т о з а. Например, онкоген р53 стимулирует апоптоз в норме.
Механизм запуска апоптоза и внутриклеточной передачи сигна-ла от рецепторной системы, приводящий к запуску генетической программы самоуничтожения клетки, связан с системой рецепторов ФНОα (ФНОα-R1)/Fas.
Гены семейства Bcl-2 — Bcl-2, Bcl-XL, Bcl-w и др. — ингибируют апоптоз, а Bax, Bik, Bad, Bid, Bcl-Xs способствуют его индукции. Эти белки в разных сочетаниях служат агонистами и антагонистами друг другу, образуя гомо- и гетеродимеры. Протеины семейства Bcl-2 локализуются на мембранах митохондрий, эндоплазматической сети и ядра. Механизмы действия Bcl-2, вероятно, связаны с регуляцией
транспорта Са2+ и каспазами. Помимо семейства Bcl-2, другие онко-гены также участвуют в регуляции апоптоза.
Онкоген р53 играет важную роль в управлении клеточным цик-лом, подавляя его до начала репликации ДНК. При повреждении ДНК повышенный синтез р53 вызывает апоптоз клетки.
Апоптоз ответственен за многочисленные физиологические
и патологические процессы, идущие в организме: 1) удаление клеток в процессе эмбриогенеза (включая имплантацию, органогенез и ин-волюцию); 2) гормон-зависимую инволюцию клеток у взрослых, на-пример, отторжение клеток эндометрия в процессе менструального цикла, атрезию фолликулов в яичниках во время менопаузы, регрес-сию лактирующей грудной железы после прекращения кормления ребенка; 3) уничтожение клеток в пролиферирующих клеточных по-пуляциях, таких как эпителий крипт тонкой кишки; 4) смерть кле-ток в опухолях; 5) смерть аутореактивных клонов Т-лимфоцитов; 6) патологическую атрофию гормон-зависимых тканей, например, атрофию простаты после кастрации и исчезновение лимфоцитов в тимусе после введения глюкопротеидов; 7) патологическую атро-фию паренхиматозных органов после перекрытия протока, напри-мер: поджелудочной железы, околоушной слюнной железы, почки; 8) смерть клеток, вызванную цитотоксическими Т-клетками, на-пример, при отторжении трансплантата; 9) гибель клеток при неко-торых вирусных заболеваниях, например, при вирусном гепатите, при котором фрагменты клеток при апоптозе известны как тельца
Каунсильмена; 10) смерть клеток, вызванную различными слабыми повреждающими воздействиями, которые в больших дозах приводят к их гибели (термальные воздействия, радиация, цитотоксические противоопухолевые препараты и, возможно, гипоксия). Субклеточные изменения при повреждении клеток. Гетерофагия
и аутофагия. Лизосомы содержат различные гидролитические фер-менты, в том числе кислую фосфатазу, глюкуронидазу, сульфатазу, рибонуклеазу, коллагеназу и др. Эти ферменты синтезируются в ше-роховатой эндоплазматической сети, а затем упаковываются в ком-плексе Гольджи. На этой стадии их называют первичными лизосомами. Первичные лизосомы сливаются с окруженными мембраной ваку-олями, содержащими продукты переваривания, и образуют фаго-лизосомы. Лизосомы участвуют в утилизации фагоцитированного материала. Ге т е р о ф а г и я представляет собой феномен, посредством которого материал извне захватывается клеткой с помощью эндо-цитоза. Поглощение частиц называется фагоцитозом, а растворен-ных мелких макромолекул — пиноцитозом. Гетерофагия характерна для фагоцитирующих клеток, таких как нейтрофилы и макрофаги. В качестве примеров гетерофагоцитоза можно привести поглощение бактерий нейтрофильными лейкоцитами и удаление апоптозных клеток и телец макрофагами. Слияние фагоцитарной вакуоли с ли-зосомой заканчивается растворением захваченного материала. При а у т о ф а г и и внутриклеточные органеллы и порции цито-золя вначале отделяются от цитоплазмы в аутофагические вакуоли, образованные из свободных от рибосом мембран шероховатой эндо-плазматической сети, которые затем сливаются с первичными лизо-сомами или элементами комплекса Гольджи, образуя аутофаголизо-сому. Аутофагия — распространенный феномен, направленный наудаление разрушенных органелл поврежденной клетки. Он особен-но развит в клетках, атрофирующихся в результате недостаточного питания или гормональной инволюции. Ферменты лизосом способны разрушать большинство белков и углеводов, хотя некоторые липиды все равно остаются неперева-ренными. Лизосомы с непереваренными остатками встречаются в клетках в виде остаточных телец. Гранулы пигмента липофусцина представляют собой непереваренный материал, который образовался после внутриклеточного перекисного окисления липидов. Некото-рые нерастворимые пигменты, такие как частицы угля, попадающие из атмосферы, или пигмент, вводимый при татуировке, могут нахо-диться в фаголизосомах макрофагов десятилетиями.
В лизосомах накапливаются также вещества, которые клетки не могут адекватно метаболизировать. При болезнях накопления, для которых характерен дефицит ферментов, разрушающих макромоле-кулы, происходит ненормальное накопление этих веществ в лизосо-мах клеток всего тела, особенно в нейронах, что приводит к разви-тию тяжелых заболеваний.
Дисфункция митохондрий играет важную роль при остром повреж-дении клетки. Различные изменения количества, размеров и формы митохондрий наблюдаются в патологических условиях. Например, при гипертрофии и атрофии наблюдается увеличение и уменьшение количества митохондрий, соответственно. Митохондрии могут быть очень крупными и принимать различную форму (мегамитохондрии), например, в печени при алкогольной болезни. При некоторых врож-денных метаболических заболеваниях скелетных мышц — митохонд-риальных миопатиях — дефекты метаболизма митохондрий сочетают-ся с увеличением их количества. Причем митохондрии часто бывают необычно крупными, имеют аномальные кристы и содержат кристал-лоиды. Кроме того, некоторые опухоли (слюнных желез, щитовидной
и околощитовидной желез, почек), т.н. онкоцитомы, состоят из кле-ток с множеством вытянутых митохондрий.
Аномалии цитоскелета встречаются при различных заболеваниях.В норме цитоскелет состоит из микротрубочек, тонких актиновых нитей, толстых миозиновых нитей и различных промежуточных филаментов. Аномалии цитоскелета делятся на дефекты функций клетки (локомоторная и движение внутриклеточных органелл) и на-копления фибриллярного материала внутри клетки.
Миофиламенты и микротрубочки необходимы для различных стадий миграции лейкоцитов и фагоцитоза. Поэтому именно с недо-статочностью цитоскелета связаны некоторые дефекты движения лейкоцитов в ответ на повреждающие стимулы или неспособность таких клеток осуществлять адекватный фагоцитоз. Некоторые лекар-ства, такие как цитохалазин В, тормозят функцию микрофиламентов
и таким образом нарушают фагоцитоз. Дефекты в организации мик-ротрубочек могут тормозить подвижность сперматозоидов, вызывая стерильность у мужчин, а также приводить к неподвижности ресни-чек дыхательного эпителия, что препятствует очищению дыхатель-ных путей от бактерий и способствует развитию бронхоэктазов.
При некоторых типах повреждений клеток наблюдается накоп-ление промежуточных филаментов. Например, тельца Маллори, или алкогольный гиалин, представляют собой эозинофильные включе-ния в клетках печени, характерные для алкогольной болезни. Такие
включения состоят, главным образом, из промежуточных филамен-тов. Нейрофибриллярные включения в мозгу при болезни Альцгей-мера содержат белки и нейрофиламенты и отражают повреждение цитоскелета нейронов.
Старение клеток. С возрастом прогрессивно страдает ряд функ-ций клеток: снижаются окислительное фосфорилирование в мито-хондриях, синтез ферментов и рецепторов клеток; стареющие клетки обладают сниженной способностью к поглощению питательных веществ и восстановлению хромосомных повреждений (схема 2.5). Морфологические изменения в стареющих клетках включают не-правильные и дольчатые ядра, полиморфные вакуолизированные митохондрии, уменьшение эндоплазматической сети и деформацию комплекса Гольджи. Одновременно происходит накопление пигмен-та липофусцина. Схема 2.5 Дата добавления: 2015-12-15 | Просмотры: 934 | Нарушение авторских прав |