|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ИММУННАЯ СИСТЕМАВсе представленные на рисунке элементы иммунной системы подробно рассмотрены в других разделах. Здесь выделены только особенности, связанные с нервной и эндокринной системами. Цитокины. Наиболее наглядно связь между иммунной и нервной системами иллюстрируется тем, что ФНО, ИЛ-1, ИФ вызывают лихорадку. Большие дозы многих цитокинов также вызывают сонливость и общее недомогание. Цитокины, особенно ИЛ-2 и ИЛ-6, обнаружены в мозге. ФНО и ИЛ-1 индуцируют секрецию АКТГ гипофизом, возможно, через гипоталамус. Лимфоидные органы. Нейроны, заканчивающиеся в тимусе и лимфатических узлах, прослеживаются по симпатическим нервам до спинного мозга. Лимфоциты. Установлено, что лимфоциты несут рецепторы к эндорфинам, энкефалинам, веществу Р, а также сами секретиру-ют эндорфины и гормоны, например АКТГ. Иммунный ответ ингибируется гидрокортизоном и гормонами половых желез и при стрессовых, особенно неизбежных, ситуациях (экзамены, тяжёлые переживания и т.д.). Известно, что гипноз снижает немедленные и замедленные реакции кожной гиперчувствительности. Действительно ли эти случаи объясняются действием кортикостероидов, пока остаётся спорным. Аутоиммунитет. Очень многие аутоиммунные заболевания (см. рис. 36) поражают эндокринные органы. Особенно сильно поражается щитовидная железа, в которой аутоантитела могут как мимикрировать, так и блокировать стимулирующее действие ТСГ. 25. АНТИМИКРОБНЫЙ ИММУНИТЕТ. ОБЩАЯ СХЕМА
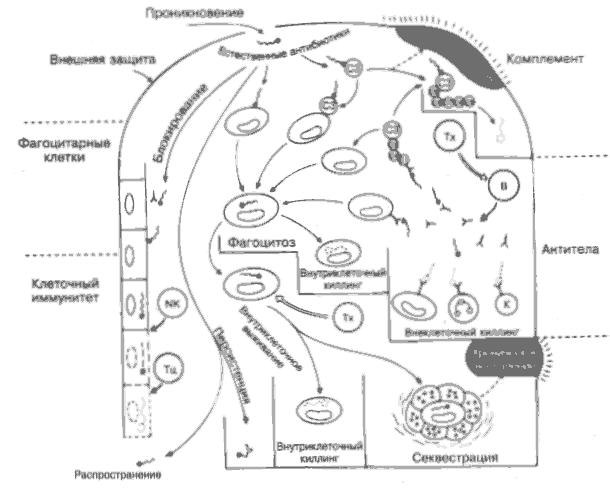
Следует подчеркнуть, что иммунная система высокоэффективна в распознавании чужеродных субстанции, но совершенно беспомощна в определении степени опасности, которую они могут представлять для организма. Кроме того, могут быть нежелательные побочные эффекты, например сильный иммунный ответ против чужеродной, но непатогенной структуры, такой, как пыльца злаковых и др. (рис 33). Предполагаемые патогенные микроорганизмы, которые преодолевают кожные или слизистые барьеры, встречаются с 4 главными распознающими системами: комплементом (на рисунке вверху справа), фагоцитарными клетками (слева), антителами (справа) и клеточным иммунитетом (слева внизу) и вместе с их часто взаимодействующими эффекторными механизмами. Если отсутствует предварительный контакт с соответствующим антигеном, то антительный и клеточный иммунный ответ начинает действовать через несколько дней после проникновения микроорганизма, тогда как фагоцитарные клетки и комплемент, постоянно присутствующие в организме, — уже через несколько минут. Существуют специализированные естественные факторы (вверху в центре), такие, как лизоцим, интерферон и др., которые действуют более или менее неспецифично и почти как антибиотики (естественные антибиотики). В общем, комплемент и антитела наиболее активны против микроорганизмов, свободно находящихся в крови или тканях, а клеточный иммунный ответ имеет дело с микроорганизмами, проникшими в клетки. Какой из механизмов окажется эффективным, во многом зависит от поведения микроорганизма. В следующих 5 разделах речь пойдёт о микроорганизмах, которые уклоняются от иммунных механизмов, подавляют их или становятся устойчивыми к ним. Проникновение. Значительная часть микроорганизмов проникает в организм через раны, укусы. Микроорганизмы, обычно обитающие на коже или слизистых оболочках кишечиика, дыхательного тракта и других тканях, по сути дела находятся вне организма. Поверхностные барьеры. Кожа и слизистые оболочки защищены кислой рН, ферментами, слизью и другими антимикробными секретами, а также антителами класса IgA (см. ниже). Естественные антибиотике Выделяемые главным образом макрофагами антибактериальный фермент лизоцим (рис. 27) и противовирусные интерфероны (рис. 23, 26) составляют важное звено естественного иммунитета. Без них инфекционных заболевании было бы значительно больше. Очевидно, что многие другие естественные антибиотики ждут своего открытия. Этот тип защиты явно ограничен в масштабах во избежание повреждений «своих» тканей. СЗ. Многие микроорганизмы непосредственно активируют СЗ-компонент комплемента по альтернативному пути, что в итоге приводит к их лизису или захвату фагоцитами. Тот же эффект наблюдается при активации СЗ антителами по классическому пути (рис. 5). Т-хелперы обычно отвечают на несущую детерминанту антигена и стимулируют В-лимфоциты к синтезу антител. Установлено, что бактерии, вирусы, простейшие и гельминты выполняют функцию сильных носителей, хотя существует небольшое количество микроорганизмов, антительный ответ на которые является Т-независимым. В-клетки. Образование антител В-лимфоцитами является почти универсальной характеристикой инфекции. Они имеют огромное диагностическое значение. Как правило, в иммунном ответе первыми появляются антитела класса IgM, затем — IgG и остальные. Высокий уровень IgM в сыворотке почти всегда указывает на начальную стадию заболевания. В слизистых оболочках наиболее эффективны антитела IgA (рис. 16). Блокирование. Антитела могут не допустить проникновения микроорганизмов или токсинов в клетку, блокируй их участки, ответственные за связывание с клеткой, как это происходит, например, со столбнячной палочкой и большинством вирусов. IgA действует главным образом по этому механизму в кишечнике. Фагоцитоз. Значительная часть микроорганизмов фагоцитируется макрофагами или полиморфно-ядерными лейкоцитами. Процесс значительно ускоряется, если микроб, предварительно опсонизированный СЗ или антителом, присоединяется к фагоцитарной клетке соответственно через СЗ- или Fc-рецепторы (рис. 8). Внутриклеточное разрушение захваченных фагоцитами микроорганизмов осуществляется лизосомальными ферментами. В определённых случаях активация макрофагов Т-клетками необходима для запуска процесса киллинга микроорганизмов (рис. 20). Внеклеточное разрушение. Моноциты, нейтрофилы и другие киллерные (К) клетки убивают покрытые антителами клетки in vitro без фагоцитоза, но неясно, насколько эта активность развита in vivo. NK — естественные киллеры. Эти клетки способны быстро убивать многие инфицированные вирусом клетки, но без специфичности,-характерной для Т-лимфоцитов. Внутриклеточная выживаемость. Некоторые вирусы, бактерии и простейшие могут выживать внутри макрофагов, где они устойчивы к киллерным механизмам. Другие микроорганизмы выживают в клетках мышц, печени, мозга и других органов, где они недоступны для антител и могут быть уничтожены только в результате клеточного иммунного ответа. Тц — цитотоксический Т-лимфоцит. Вызывает лизис «своих» клеток, изменённых вирусом и другими антигенами, а также ал-логенных, например трансплантированных, клеток (рис. 20). Тх — Т-хелпер замедленной гиперчувствительности, который через секретируемые цитокины привлекает и активирует моноциты, эозинофилы и другие клетки (рис. 20, 23). Центральная роль Т-хелперов при большинстве инфекции подтверждается тяжёлыми последствиями повреждения их, например, при СПИДе (рис. 40). Секвестрация. Микроорганизмы, которые не могут быть убиты, например, некоторые микобактерии и недеградируемые вещества, в том числе оболочки стрептококков, участвуют в образовании гранулём макрофагами, часто при помощи реакций кле-точно опосредованного иммунного ответа (рис. 20). Распространение. Выжившие микроорганизмы должны покинуть один организм и инфицировать другой, что происходит чаще всего при кашле, чихании, укусах насекомых, через фекалии и т.д. Персистенция. Некоторые микроорганизмы выработали защитные механизмы, позволяющие избегать разрушающего действия иммунных факторов. Они способны длительно находиться в организме носителя, вызывая хронические и трудноизлечимые инфекционные заболевания. Воспаление. Некоторые микроорганизмы (например, цитопатические вирусы), а также токсины способны разрушать ткани, но это несравнимо с теми повреждениями, которые наносит себе сам организм хозяина в ходе иммунного ответа на инфекцию. Острые и хронические воспаления подробно рассмотрены в других главах (рис. 6, 35). Здесь важно то, что инфекция ставит иммунную систему хозяина перед выбором: уничтожить микроорганизм любой ценой или, позволив ему жить, сберечь свои ткани. Решение этой дилеммы остается за естественным отбором. 26. ПРОТИВОВИРУСНЫЙ ИММУНИТЕТ
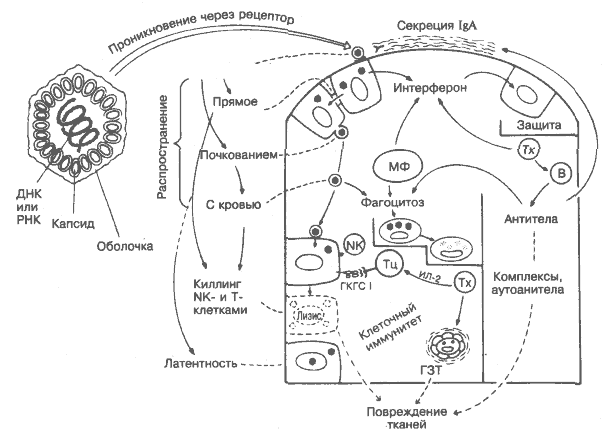
Отличительные черты вирусов — отсутствие оболочки (у части вирусов), очень малые размеры (рис. 42) и неспособность к независимому метаболизму, т.е. к репликации вне клеток хозяина. Таким образам, основа вирусной инфекции — это внутриклеточное размножение вируса со всеми, вплоть до гибели инфицированных клеток, последствиями. На рисунке вирус изображён в виде шестиугольника; в природе форма и размеры вирусов крайне разнообразны. При вирусных инфекциях интерферон, а при бактериальных лизоцим выполняют функции естественных антибиотиков (вверху справа). Проникновение некоторых вирусов и их распространение с кровью блокируются антителами (справа). Другие вирусы, распространяющиеся из клетки в клетку (слева), уничтожаются цитотоксическими Т-лимфоцитами, которые распознают изменённые «свои» молекулы ГКГС класса I, или NK-клетками, действующими быстрее, чем Т-киллеры, и эффективнее, когда на • инфицированных клетках-мишенях мало или отсутствуют молекулы ГКГС класса I. Макрофаги выполняют ряд противовирусных функции, продуцируя интерферон и осуществляя фагоцитоз. На изменённое «своё» реагируют не только Т-, но и В-лимфоциты, часто продуцируя аутоантитела (см. Аутомииунитет, рис. 36). Обычно инфекция сопровождается повреждением тканей, вызванным как самим вирусом, так и иммунным ответом на него. Вирусы жизнеспособны только в организме хозяина и обычно быстро адаптируются, снижая свою вирулентность. Но вирусы, которые хорошо адаптированы в организме животного, могут быть высоковирулентными для человека, как это случается при зоонозах (например, при инфицировании человека вирусом бешенства от собак или вирусом Марбурга от обезьян). Переходную ступень между бактериями и вирусами представляют облигатные внутриклеточные организмы, имеющие клеточную оболочку (Rickettsia, Trachoma) или без неё, но способные к внеклеточной репликации (Mycoplasma). С точки зрения иммунологии, первые ближе к вирусам, вторые — к бактериям. Рецепторы. Вирусы проникают в клетку после соединения со специфическим рецептором на её поверхности. На сегодня известно лишь несколько таких рецепторов, например, CR2-peцептор комплемента для вируса Эпстайна-Барр, ацетилхолиновый рецептор нейронов для вируса бешенства. СD4-молекула на Т-клетках для вируса иммунодефицита человека. Интерфероны — группа белков (рис. 23), продуцируемых в ответ на вирусную инфекцию, а также под влиянием липополисахарида и др. Продуцируются макрофагами (ИФ-а), фибробластами (ИФ-р) и Т-клетками (ИФ-у). Интерфероны стимулируют клетки к выделению белков, блокирующих транскрипцию информационной РНК вируса. Интерфероны влияют на деление нормальных клеток. Полученные методами генной инженерии Интерфероны могут оказаться полезными противовирусными и, возможно, противоопухолевыми лечебными средствами. Клеточный иммунный ответ, Т-киллер, NK Как показано в разделах 13, 17, 20, цитотоксические Т-лимфоциты обучены распознавать молекулы ГКГС класса I и реагировать на сочетание вирусного антигена и молекулы ГКГС класса I. Поскольку практически любой тип клеток может быть инфицирован вирусом, молекулы класса I, в отличие от молекул класса II, экспрессированы на большинстве клеток. Интересно, что роль ГКГС в клеточном иммунном ответе обнаружена при изучении именно противовирусного иммунитета у мышей. Роль ГЗТ при вирусной инфекции противоречива. Теоретически активированные макрофаги могут разрушать инфицированные вирусом клетки и вызывать повреждение тканей, но на практике трудно разделить активности Т-клеток-киллеров и Т-клеток-хелперов даже при использовании клонируемых Т-клеток. NK-клетки могут разрушать некоторые инфицированные клетки, но без ограничения по ГКГС. ВИРУСЫ Общепринятая классификация вирусов ещё не разработана. Их различают по размерам, форме, природе генома (ДНК или РНК), способу распространения (почкованием, при цитолизе клеток хозяина, непосредственно; см. рисунок). Крайне важный показатель — уничтожается вирус в результате иммунного ответа или уклоняется от него. Ниже даны характеристики некоторых наиболее распространённых вирусов. Вирусы оспы (натуральная оспа, коровья оспа). Большой ДНК-вирус; распространяется с лейкоцитами крови или локально, недоступен для антител, экспрессирует антигены на поверхности инфицированных клеток, стимулирует клеточный иммунный ответ. Тяжёлый Т-клеточный иммунодефицит (рис. 39) часто характеризуется как прогрессирующее неизлечимое заболевание при полной неспособности контролировать вирус осповакцины. Перекрёстное антигенное реагирование легло в основу применения вируса коровьей оспы для защиты людей от натуральной оспы (метод, тысячелетиями известный в странах Востока, а в Европе в 1796 г. его впервые применил Э.Дженнер). Благодаря вакцинации натуральная оспа стала первым инфекционным заболеванием, полностью исчезнувшим с лица земли. Вирусы герпеса (простого герпеса, ветряной оспы, Эпстайна-Барр, цитомегалии). Средние ДНК-вирусы, способны персистировать и при реактивации вызывать различные симптомы. Вирус ветряной оспы вызывает опоясывающий лишай; вирус Эпстайна-Барр (вирус инфекционного мононуклеоза) может вызвать опухоль (лимфома Беркитта; рис. 31). Вирус цитомегалии становится наиболее важным возбудителем оппортунистической инфекции при иммуносупрессии. Аденовирусы (инфекции глаз и горла). Средние ДНК-вирусы. Многочисленные антигенно различающиеся типы делают иммунитет неэффективным, а вакцинацию проблематичной. Миксовирусы (вирусы гриппа, эпидемического паротита, кори). Большие РНК-вирусы, распространяются почкованием. Вирус гриппа — классический пример присоединения специфическим рецептором (гемагглютинин) и антигенного разнообразия. Адаптивный иммунитет к гриппу относительно неэффективен. Вирус эпидемического паротита поражает яички и может вызвать аутоиммунные повреждения. Вирус кори, инфицируя лимфоциты, неспецифически подавляет клеточный иммунный ответ. Способен персистировать и вызывать подострый склерози-рующий панэнцефалит. Некоторые исследователи полагают, что рассеянный склероз тоже может быть заболеванием такого типа. Вирус краснухи («германская корь»). Средний РНК-вирус. Главную опасность представляет способность вируса поражать плод в первые 4 мес беременности. Ослабленные вакцины дают выраженный иммунитет. Вирус бешенства. Большой РНК-вирус. Распространяясь по периферическим нервам, поражает ЦНС. Обычно инфекция передаётся вследствие укуса собаки. Для сохранения жизни требуется немедленная пассивная иммунизация. Арбовирусы (вирус жёлтой лихорадки). Небольшие ДНК-вирусы, переносятся членистоногими. Попадая в печень, вызывают желтуху. Выраженный иммунитет и защита в ответ на вакцинацию. Энтеровирусы (вирус полиомиелита). Небольшие РНК-вирусы. Иммунная система способна различать их только на стадии проникновения (через кишечник) и после лизиса клеток. Чувствительны к антителам, включая IgA, но не к клеточному иммунному ответу. Риновирусы (вирусы обычной простуды). Небольшие РНК-вирусы. Как и в случае с аденовирусами, иммунитет неэффективен из-за слишком большого количества серотипов. Вирусы гепатита. По крайней мере 3 типа вирусов могут вызвать гепатит: А (инфекционный гепатит; РНК-вирус), В (сывороточный гепатит; ДНК-вирус) и С (ранее известный как ни А ни В; РНК-вирус). При гепатите В в сыворотке обнаруживаются аутоантитела и иммунные комплексы. Возможно вирусоносительство, особенно в тропических странах, где имеется связь с циррозом и раком печени. Длительное применение ИФ-а значительно улучшает состояние носителей. Аренавирусы (вирус лихорадки Ласса). Средний РНК-вирус. Лихорадка Ласса — болезнь крыс, часто фатальная у человека. Относится к эоонозам. Отчасти сходное заболевание — болезнь Марбурга у обезьян. Ретровирусы (опухоли). РНК-вирусы, содержат обратную транскриптазу, позволяющую встраиваться в ДНК клетки, инфицированной вирусом. К ретровирусам относятся вирусы лейкоза Т-лимфоцитов человека (HTLV) и вирус иммунодефицита человека, вызывающего СПИД, который проникает в клетки через CD4-молекулу и поражает главным образом Т-хелперы (рис. 40). Трахома. Вызывает болезнь из группы пситтакозов (инфекционное заболевание птиц, особенно попугаев). Возбудитель — Chlamidia. Чрезмерный клеточный иммунный ответ оставляет рубцы на конъюнктиве. Риккетсни — возбудители тифа и других заболеваний, способны выживать в макрофагах, как и туберкулёзные палочки. Куру — крайний вариант медленного вируса. Передаётся только при каннибализме и вызывает прогрессирующее поражение мозга. Как выяснилось, это происходит из-за очень мелких молекул (прионов), которые нарушают процесс полимеризации молекул хозяина. 27. ИММУНИТЕТ К БАКТЕРИЯМ
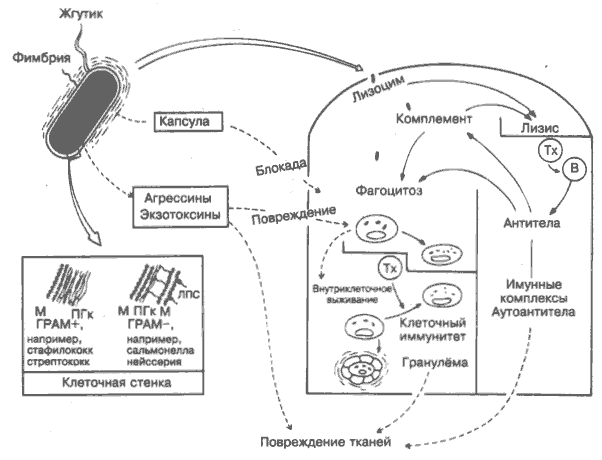
В отличие от вирусов, бактерии — клеточные организмы, вполне способные к независимому метаболизму. Тем не менее многие из них предпочитают временно или постоянно паразитировать. В экономически развивающихся странах подавляющее большинство инфекционных заболеваний вызывается бактериями и вирусами. Большая часть бактерий уничтожается в организме в результате фагоцитоза. Основные защитные механизмы бактерий (на рисунке слева внизу), помогающие им выжить, связаны с капсулой (предупреждение прилипания), клеточной стенкой или оболочкой (предупреждение переваривания) и освобождением экзотоксинов (повреждение фагоцитов и других клеток). К счастью, большинство капсул и токсинов высокоантигенны, и антитела преодолевают многие их эффекты, что положено в основу большинства антибактериальных вакцин. На рисунке процессы, благоприятные для бактерий и опасные для хозяина, показаны пунктирными линиями. Бактерии, в отличие от более высокоорганизованных организмов (от грибов до человека), являются прокариотами, поэтому их молекулы чужеродны для человека в большей степени, чем молекулы эукариотов (грибы, простейшие, гельминты). Возможно, поэтому иммунной системе человека проще специфически реагировать на бактерии, чем на более развитые ядросодержащие паразиты. Пожалуй, самое совершенное вещество, действующее на бактерии и безвредное для клеток хозяина, — естественный антибиотик лизоцим (по крайней мере, он был им до наступления эры антибиотиков, которые, как и лизоцим, открыл А. Флеминг). Как и в случае с вирусами, наиболее вирулентные и устойчивые бактериальные инфекции имеют зоонозную природу, например чума (крысы) и бруцеллёз (крупный рогатый скот). Клеточный иммунный ответ на бактерии, способные выживать в макрофагах, например на туберкулёзные палочки, обычно приводит к серьёзным повреждениям тканей (рис. 35). Не случайно кожная реакция замедленной гиперчувствительности, характеризующая Т-клеточный иммунитет, долгое время называлась бактериальной аллергией. Клеточная стенка (оболочка). На поверхности плазматической мембраны (на рисунке — М) бактерии имеют оболочку (клеточная стенка) из мукопептида пептидогликана (ПГк). Лизоцим, действуя на стенку бактерии, прерывает связи N-ацетил-мурамовой кислоты с N-ацетилглюкозамином. Кроме этого, грамотрицательные бактерии имеют вторую мембрану с липополисахаридами (ЛПС, называемый также эндотоксином). Жгутики — главное средство передвижения бактерии. Содержат высокоантигенные белки (например, Н-антигены возбудителей брюшного тифа), активно стимулирующие синтез антител. Фимбрии используются бактериями для прикрепления к клеткам. Присоединение может быть блокировано антителами (например, IgA против гонококков). Капсула. Многие бактерии вирулентны именно из-за капсул, которые защищают их от контакта с фагоцитами. Большинство капсул состоит из больших разветвлённых полисахаридных молекул, но некоторые — из белков. Интересно, что многие полисахариды капсулы и некоторые белки жгутиков являются Т-независимыми антигенами (рис. 17). Поскольку считается, что Т-независимые антитела были первыми антителами, появившимися в процессе эволюции (рис. 3), это ещё раз подтверждает, что бактерии были главным стимулом для развития антителообразуюшей системы. Примеры инкапсулированных бактерий — пневмококки, менингококки, гемофильные бактерии. Экзотоксины отличаются от эндотоксинов (ЛПС), находящихся в клеточных стенках. Грамположительные (ГРАМ+) бактерии часто секретируют белки с деструктивными свойствами против фагоцитов, локальных тканей, ЦНС и т.д. Часто экзотоксины становятся причиной летального исхода инфекции. Кроме того, существуют белки, известные как агрессины. Разрушая ткани хозяина, они способствуют распространению бактерий. Дата добавления: 2014-12-12 | Просмотры: 1122 | Нарушение авторских прав |