|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ЗАБОЛЕВАНИЯ, СВЯЗАННЫЕ С HLAСамый характерный пример — нарколепсия, наблюдаемая только у носителей DR2 антигена: впрочем, причины этого неизвестны. Интересны также артропатии крестцово-подвздошного сустава (анкилозирующий спондилит, болезнь Рейтера и др.), при которых HLA B27 аллель наблюдается в 95% случаев, т.е. почти в 20 раз чаще, чем обычно. Достаточно убедительно доказана связь многих других заболеваний, в том числе почти всех аутоиммунных, с частными антигенами или группами антигенов HLA (чаще всего D-области). Вероятнее всего, это объясняется различием в способности разных молекул HLA представлять микробные полипептиды или «свои» антигены. Возможно, имеется связь с генами других областей, особенно класса III. Тенденция некоторых HLA аллелей (например, А1 и В8) не разделяться, а оставаться сцепленными, называется неравновесным сцеплением. Возможно, такие комбинации являются жизненно важными, так как с ними может быть связана повышенная устойчивость к заболеванию или, напротив, повышенная чувствительность к нему. Вся эта область предоставляет широчайший простор для исследований. 14. Т-КЛЕТОЧНЫЙ РЕЦЕПТОР
Многие годы в иммунологии существовала ситуация, когда было известно, что Т-лимфоциты имеют на поверхности рецептор для антигена, сходный с антителами на В-лимфоцитах, но было неясно, насколько идентичны эти молекулы. Вопрос был снят в 1983-1984 гг., когда применение моноклональных антител и ДНК-зондов позволило точно установить, что и на молекулярном, и на генетическом уровне Т-клеточный рецептор уникален. Рецептор Т-лимфоцита имеет характерную для суперсемейства иммуноглобулинов структуру, а именно состоящие из доменов полипептидные цепи, соединённые дисульфидными связями. Молекула рецептора имеет 2 основные цепи (a, p или, в отдельных случаях, у, 5), состоящие из 2 доменов каждая. Кроме того, во взаимодействии Т-лимфоцита с молекулами ГКГС участвуют молекулы CD3, CD4 и CD8. В правой части рисунка представлен процесс распознавания Т-хелпером чужого антигена в ассоциации с молекулой ГКГС. Сведения об этом процессе постоянно пополняются новыми данными. Особенно эффективно в этом отношении тестирование последствий генетического удаления («нокаутирование» гена) индивидуальных компонентов различных молекул, показанных на рисунке. Необычность рецепторных белков состоит в том, что кодирующие их гены расположены на хромосоме не рядом, а через некоторые промежутки и для совмещения соответствующих генов происходит вырезание лежащих между ними сегментов ДНК, а потом РНК. Этот процесс, известный как перестройка генов, происходит только в Т-лимфоцитах, тогда как во всех других клетках гены остаются в нефункциональном состоянии зародышевой линии. Перестройка генов наблюдается в индивидуальном Т-лимфоците, что обеспечивает ему уникальный рецептор и как следствие уникальную антигенраспознаюшую способность. Аналогичный процесс происходит с генами иммуноглобулинов В-клеток (рис. 15). На этом и следующем рисунке серым цветом выделены участки генов и белков, которые, как считается, произошли из примитивного V(вариабельного)-региона (рис. 12), хотя и проявляют разную степень вариабельности. ТКР — Т-клеточный рецептор. Состоит из одной a- (м. м. 50 000) и одной b- (м. м. 45 000) цепи, каждая из которых имеет внешний (вариабельный) и внутренний (константный) домены, внутримембранный и цитоплазматический короткий участки. На ранней стадии эмбрионального развития, а также в некоторых органах (кишечник, кожа) Т-лимфоциты могут иметь альтернативные рецепторы с gd-цепями и распознавать иные антигены по сравнению с ар Т-лимфоцитами. На рис. 10 даны происходящие в тимусе процессы позитивной и негативной селекции, в результате чего развиваются индивидуальные Т-лимфоциты, распознающие собственные молекулы ГКГС вместе с чужеродным пептидом. CD3 — молекулярный комплекс, состоящий из 3 цепей: g (м. м. 25 000), d (м. м. 20 000) и e (м. м. 20 000), который играет существенную роль во всех функциях Т-клеток. Т-клеточный рецептор, CD3 и сигнальные двухцепочечные молекулы (zz и z,h) вместе образуют комплекс, взаимодействующий с антигеном (молекула ГКГС плюс пептид). Это взаимодействие ведёт к активации клетки по крайней мере через два внутриклеточных процесса, задействующих тирозинкиназу и фосфолипазу С, что в конечном счёте приводит к пролиферации клетки и высвобождению цитокинов. CD4 — одноцепочечная поверхностная молекула (м. м. 60 000) Т-хелпера, участвующая в его взаимодействии с молекулами ГКГС класса II. CD4 является рецептором, через который ВИЧ проникает в Т-клетку (рис. 40). CD8 — поверхностная молекула большинства цитотоксических Т-лимфоцитов, участвующая во взаимодействии с молекулами ГКГС класса I. CD8 человека состоит из 2 одинаковых цепей, её мышиный аналог — из 2 разных (Ly 2/3). Подчеркивая тесную связь с Т-клеточным рецептором, молекулы CD4 и CD8 иногда называют корецепторами. CD2, CD28, LFA-1 — три из многих адгезивных молекул, поддерживающие контакт Т-лимфоцита с антигенпредставляющими клетками или В-лимфоцитами (рис. 12). Особую роль играет молекула CD28, распознающая молекулу В7 как существенный костимулятор Т-клеточной активации. Считается, что в отсутствие костимуляции Т-клетка приобретает состояние неотвечаемости, которое может быть важным при развитии аутореактивности. Перестройка генов. Гены ТКР содержат до 100 V-генов и множество J-генов. Для формирования отдельной цепи необходимо, чтобы по одном гену из них соединялось с С-геном. Это осуществляется вырезанием лежащих между ними сегментов ДНК. Подобный же процесс в информационной РНК заканчивается созданием конечной VDJC РНК, кодирующей полипептидную цепь. С учётом всех возможных комбинаций a- и b-цепей общее число различающихся молекул ТКР в организме может достигать 1010. CD4- и CDS-гены хотя и имеют явное V-генное происхождение, не перестраиваются и кодируемые ими молекулы не обладают таким разнообразием. Антиген. В случае, представленном на рисунке, антиген в виде короткого пептида распознаётся молекулой ГКГС класса II и Т-клеточным рецептором (рис. 17). Достаточно полное распознавание с вовлечением взаимодействия CD4—молекула ГКГС класса II приводит к изменению молекулы CD3, в результате чего возрастает уровень внутриклеточного кальция и, возможно, других ионов. Т-лимфоцит активируется для выполнения своих запрограммированных функций. В случае активации цитотоксического Т-лимфоцита молекула CD8 связывается с молекулой ГКГС класса I, присутствующей на клетке-мишени. ИЛ-2 — интерлейкин-2. Лимфокин, необходимый для начальной пролиферации Т-клеток, также действует на В-клетки, макрофаги, эозинофилы и др. (рис. 23). Зависимость между природой активирующего сигнала и разновидностью синтезируемого цитокина пока не совсем ясна. Эксперименты с клонируемыми Т-клетками, особенно на мышах, дают основания для заключения, что некоторые CD4 Т-клетки (Т-хелперы типа 1) продуцируют главным образом ИФ-7 и другие цитокины, активирующие макрофаги, хотя клоны других CD4 Т-клеток (Т-хелперы типа 2) преимущественно вырабатывают факторы, помогающие в антителопродукции (ИЛ-4, ИЛ-5, ИЛ-6 и др.). В настоящее время такое разграничение функций CD4 Т-клеток наблюдается у человека. Суперантигены Имеется одно исключение в очень высокой специфичности взаимодействия Т-клетка—пептид—ГКГС. Некоторые вирусы и стафилококковые энтеротоксины обладают способностью связываться с b-цепью ТКР и молекулой ГКГС класса II вне пептидсвязывающего участка. В результате активируется не единственный клон Т-лимфоцитов, а целое семейство клонов, что приводит к повышенной продукции цитокинов с возможными повреждающими эффектами. 15. СИНТЕЗ И МНОГООБРАЗИЕ АНТИТЕЛ
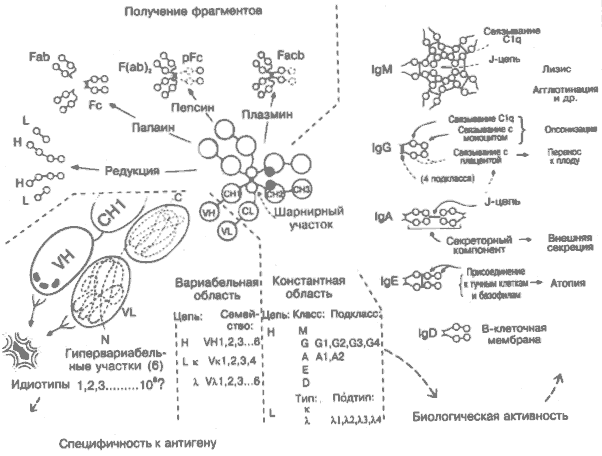
В отличие от молекул ГКГС и Т-клеточных рецепторов, антитела, т.е. молекулы иммуноглобулинов, известны уже очень давно. С момента определения их структуры прошло почти 30 лет — достаточно времени, чтобы они стали едва ли не самыми изученными молекулами в биологии. Типичная молекула иммуноглобулина (Ig) имеет несколько более сложную структуру, чем Т-клеточные рецепторы или молекулы ГКГС, и состоит из 2 лёгких и 2 тяжёлых цепей (рис. 16). Каждая цепь имеет константные и вариабельные участки, характеризующие специализацию и специфичность молекулы. Различия в константных участках тяжёлых цепей позволяют разделить молекулы Ig на классы и подклассы с различными биологическими функциями. Вариабельные области определяют специфичность антигенсвязывающего центра молекулы. При кодировании антител гены для тяжёлых и лёгких цепей совмещаются в В-лимфоците аналогично генам Т-клеточных рецепторов: перестройка генов на уровне ДНК и вырезка сегментов информационной РНК. Существенное отличие состоит в том, что для В-клеток возможны последующие соматические мутации вариабельных областей, исключённые в случае Т-клеток. После перестройки полипептидные цепи синтезируются на рибосомах наравне с другими белками, собираются и транспортируются либо на клеточную поверхность, где они выполняют функции В-клеточных рецепторов, либо в кровь, где они выполняют функции антител. Ig. К иммуноглобулинам относят все глобулины, проявляющие активность антител. Старое обозначение «гамма-глобулин» оказалось не совсем удачным, так как не все антитела обладают g-электрофоретической подвижностью. IgK, IgA,, IgH — 3 генных локуса, распложенных на разных хромосомах. Кодируют лёгкие (к,l ) и тяжёлую (Н) цепи молекулы иммуноглобулина. Типичная молекула иммуноглобулина состоит из 2 Н-цепей и 2 L-цепей (обе l.- или обе к-цепи). Зародышевая линия — все гены, участвующие в постепенном превращении первичных половых клеток в гаметы. Мутации и другие генетические изменения этих генов наследуются и предоставляют материал для естественного отбора. Изменения в генах любых других клеток (не половых) называются соматическими и потомству не передаются. Изменения ДНК В-лимфоцитов, вызывающие появление новой молекулы Ig, относятся именно к соматическим мутациям. Гены зародышевой линии обязательно присутствуют в ДНК, и многие из них кодируют антитела к распространённым бактериям. Возможно, бактериальные инфекции были одним из главных стимулов эволюции антител. V — гены вариабельной области. Количество вариантов этих генов колеблется от 2 (l-цепь мыши) до 350 (к-цепь мыши; на рисунке представлены гены человека). Наибольшее разнообразие наблюдается в 3 коротких гипервариабельных областях, кодирующих аминокислоты антигенсвязывающего участка молекулы. С — гены константной области. Кодируют единственный домен лёгкой и 3 или 4 домена тяжёлой цепи (СН1, 2. 3, 4). В зависимости от того, какой из 8 (у мыши) или 9 (у человека) генов С-области используется В-лимфоцитом, синтезированная молекула Ig будет принадлежать к различным классам и подклассам (IgM, IgG и др.; рис. 16). J — гены соединительной области. Кодируют короткий J-фрагмент антитела. Интересно, что Н- и к-цепи кодируются J-генами, расположенными рядом, а в случае l-цепи каждый С-ген имеет соответствующий ему J-генный фрагмент. У примитивных позвоночных повторы VJC-сегментов значительно снижают число возможных комбинаций. D — гены D-области. Обнаружены только в IgH-генах, за счёт которых получается дополнительная гипервариабельность. Перестройка генов — процесс, аналогичный перестройке генов ТКР в Т-лимфоците. Сначала вырезаются сегменты ДНК (интроны), лежащие между V- и J- (и D- для IgН)-генами, и отдельные V-, J- (D)-генные сегменты совмещаются. После их транскрипции на РНК уже из неё вырезается участок между V(D)J-сегментом и С-областью. Образовавшаяся информационная РНК кодирует полную V(D)JC-uenb антител. Переключение классов имнуноглобулинов — процесс дальнейшего вырезания сегментов ДНК в индивидуальных В-клетках, позволяющий одному и тому же сегменту VDJ присоединяться к разным С-генам. Образующиеся в результате различных соединений антитела имеют одинаковую специфичность, но разные константные участки, что определяет разные свойства антител. Переключение на продуцирование того или иного кл.асса или подкласса антител зависит от выделяемых Т-кяетками цитокинов. ИЛ-4 стимулирует синтез IgE, ИЛ-5 — синтез IgA, ИФ-g — синтез IgG3 и т.д. (примеры опытов на мышах). CD19 Связывание молекулы CDI9 — необходимое условие активации В-клетки. Таким образом, CD19, аналогично молекулам CD4, CD8 и CD28 Т-лимфоцита, выполняет функцию корецептора В-лимфоцита. Обнаруженный на В-клетках рецептор к комплементу CR2 — ещё один корецептор В-клеточной активации. Молекула CD19 — надёжный маркёр В-лимфоцитов, так как не экспрессируется на клетках других типов. Поли-Ig-рецептор — молекула, обнаруженная на секреторных клетках эпителия. Способствует перемещению Ig в секреты (например, слизь, молоко, желчь). Состоит из V-подобных доменов, что ещё раз иллюстрирует многофункциональность суперсемейства иммуноглобулинов. Происхождение разнообразия. Огромное число антител разной специфичности объясняется 4 факторами: 1) в результате перестройки могут быть соединены любые V-, D- и J-генные сегменты; 2) тяжёлая цепь может соединяться с лёгкой к- или ^.-цепями; 3) соединения V-D и D-J не всегда находятся точно на одном месте; 4) в V-генах отдельной В-клетки могут происходить случайные соматические мутации, вызывающие небольшие изменения активного центра молекулы. Иногда такие изменения приводят к повышенному аффинитету антител для антигена. Трудно точно определить число различных антигенсвязывающих участков, получаемых при комбинации всех 4 факторов, но, возможно, оно превышает 108. Важно, что разнообразие в ГКГС формируется совершенно иными путями. Особь имеет лишь один или два аллельных варианта каждого гена. Таким образом, особи разных видов отличаются друг от друга в большей степени по генам и молекулам ГКГС, чем по В- и Т-клеточным рецепторам. IgA, IgD — молекулы, образующие связь между клеточно-поверхностными Ig и внутриклеточными сигнальными путями активации по аналогии CD3 на Т-клетках. 16. СТРУКТУРА И ФУНКЦИИ АНТИТЕЛ
Учитывая, что антитела в сыворотке являются смесью около 100 млн мало различающихся типов молекул, легко представить, что изучение их структуры было очень нелёгкой задачей. Первым шагом в этой области было химическое расщепление молекул антител на фрагменты (на рисунке вверху слева). Более совершенные методы, такие как секвенирование аминокислотных последовательностей и рентгенокристаллография, основывались на применении полностью гомогенных (моноклональных) антител. Раньше их можно было получить в форме миеломных белков, продуцируемых опухолевыми В-лимфоцитами. С появлением метода гибридом (рис. 9) стало возможным получать моноклональные антитела разной специфичности в неограниченных количествах. Типичная молекула антитела (IgG) состоит из 12 расположенных попарно доменов, образующих 2 лёгкие (L) и 2 тяжёлые (Н) цепи, сшитые через цистеиновые остатки дисульфидными связями. Молекула имеет гибкую структуру, напоминающую по конфигурации букву Y. В каждой цепи N-концевые домены наиболее вариабельные, остальные относительно константные. Типичная молекула IgG имеет 2 антигенсвязывающих (активных) центра, каждый из которых образован 6 (по 3 на каждой цепи) гипервариабельными участками вариабельной (V)-области (слева на рисунке). В этих участках наблюдается максимум вариаций аминокислотных последовательностей. В константной (С) области варьируют в основном участки, взаимодействующие с комплементом или различными клеточными рецепторами. В правой части рисунка схематично показаны константные области 5 классов антител Ig — М, О, А, Е и D. Сочетания различных V- и С-областей дают огромное количество молекул, способных запустить любой из имеющихся эффекторных механизмов против любого антигена. Основная структура (типа IgG; м. м. около 160000) может образовывать димеры (IgA; м. м. 400 000) или пентамеры (IgM; м. м. 900 000). Существуют сравнительно недавно эволюционно сформировавшиеся межвидовые различия, особенно в подклассах тяжёлых цепей (на рисунке представлены примеры для Ig человека). В последнее время все больше внимания уделяется боковым углеводным цепям, составляющим иногда до 12% всей молекулы. Возможно, с ними связана секреция молекул. Выявлено их нарушение при некоторых заболеваниях. На рисунке молекула Ig изображена крайне схематично. На самом деле она имеет трёхмерную конфигурацию, что показано на примере связывания с антигеном в правой верхней части рис. 16. Фрагменты, полученные при химической обработке молекул Ig: Н, L: тяжёлые и лёгкие цепи, которые связаны только дисульфидными связями и легко разделяются под действием восстановителя. Fab: антигенсвязываюший фрагмент (расщепление папайном цельной молекулы). Fc: кристаллизуемый относительно гомогенный фрагмент (расщепление папаином). F(ab)s: два Fab-фрагмента, объединённых дисульфидными связями (расщепление пепсином). pFc: димер из СНЗ-доменов (расщепление пепсином). Facb: молекула Ig без СНЗ-доменов (расщепление плазмином). Цепи. Хотя тяжёлые (Н) и лёгкие (л., к) цепи кодируются генами разных хромосом, гомология последовательностей подтверждает, что все Ig-домены произошли от общей молекулы-предшественницы длиной около 110 аминокислот (рис. 12). Классы. Физические, антигенные и функциональные различия между константными областями определяют 5 основных классов тяжёлых цепей — М, G, А, Е и D и соответствующие им 5 классов иммуноглобулинов. У большинства высших биологических видов присутствуют антитела всех 5 классов. IgM. В процессе эволюции антитела класса IgM появились первыми. Они же первыми синтезируются в ответ на первичную антигенную стимуляцию (рис. 3). Так как они имеют пентамерную структуру с 10 активными центрами, то они эффективны в связывании и агглютинации микроорганизмов. IgG — антитела класса IgG при иммунном ответе появляются в сыворотке вслед за IgM. Обладают способностью активно связываться своим Fc-участком с Clq (рис. 5) и рецепторами фагоцитов (рис. 8). Поступают во внесосудистые пространства и (через плаценту) к плоду. Большинство биологических видов имеют несколько подклассов IgG (см. ниже). IgA — основные антитела, содержащиеся в секрете (слюна, пот), в лёгких, кишечнике, моче. Имеют дополнительную структуру — секреторный компонент, предохраняющий молекулу антитела от расщепления. Основная функция IgA — предотвращать проникновение антигенов с внешних поверхностей в ткани. IgE способны через Fc-фрагмент связываться с тучными клетками и стимулировать их дегрануляцию (рис. 33). IgD действуют на поверхности В-клеток, выполняя регулирующие функции. IgD мыши вместо 3 константных областей тяжёлой цепи имеет только 2. Подклассы, подтипы. Небольшие вариации в константных областях молекул одного класса определяют подклассы антител. Больше всего их у IgG. Варианты константных областей лёгких цепей иногда обозначают как подтипы. Эти варианты, присутствующие у всех представителей данного вида, называются изотипами. Различные антигены вызывают синтез различных подклассов IgG (например, у человека вирусы стимулируют синтез IgGI и IgG3, полисахариды — синтез IgG2), однако природа этой связи ещё неизвестна. Аллотипы Варианты иммуноглобулиновых молекул между отдельными представителями вида называются аллотипами. Они генетически детерминированы, возможно, регулируются генетическими факторами и связаны главным образом с С-областями. Их биологические функции пока точно не установлены. В отличие от групп крови, аллотипические детерминанты присущи отдельным В-клеткам. Закон аллельного исключения обеспечивает возможность экспрессии только одного аллотипа (алле-ля) Ig на отдельной В-клетке. Это означает, что для синтеза антител используется только один из двух наборов хромосом клетки, вероятно, тот, в котором раньше осуществилась успешная перестройка генов. Гипервариабельные области — 6 участков вариабельных областей тяжёлой и лёгкой цепей (по 3 на каждой), приблизительно равные по аминокислотному набору (нижняя левая часть рисунка). При свёртывании молекулы в b-складчатую структуру сближаются и образуют антигенсвязывающий центр. Разнообразие антигенсвязывающих участков обеспечивается за счёт огромной вариабельности кодирующих участков ДНК и необычайной подверженности генов гипервариабельных областей соматическим мутациям. Сходные последовательности позволяют объединять V-гены в семейства. Идиотипы Антигенсвязывающий участок одной молекулы антитела может быть распознан и связан другой антительной молекулой. В этом случае они называются соответственно идиотипическими и антиидиотипическими антителами. Антиидиотипические антитела присоединяются примерно к тому же участку гипервариабельной области, что и антиген. Антиидиотипические антитела образуются в норме и могут участвовать в регуляции иммунного ответа (рис. 22). Шарнирный участок. За счёт повторных пролиновых остатков в этом участке молекулы обеспечиваются гибкость и чувствительность к протеолитическому расщеплению. В IgM шарнирный участок имеет размеры нормального домена и обозначается СН2. Два других константных домена обозначаются СНЗ и СН4. То же присуще молекуле IgE. J-пепь — гликопептидная молекула, обеспечивающая полимеризацию IgA и IgM. Секреторный компонент — полипептид, происходящий из поли-Ig-рецептора (рис. 15) и включаемый в структуру IgA в эпителиальных клетках, что обеспечивает транспорт через эпителий и секрецию в кишечник, слюну, слёзную жидкость, молоко и др., где IgA является преобладающим. C1q — первый компонент классического пути активации комплемента. Шестивалентный гликопротеин, активируемый при связывании с СН2-доменом IgM и IgG некоторых подклассов (у человека IgG1 и IgG3) (рис. 5). 17. РАСПОЗНАВАНИЕ И ПЕРЕРАБОТКА АНТИГЕНА
В разделе 14 упоминался чужеродный пептид, который связывается молекулами ГКГС и распознаётся Т-клеточными рецепторами. Одним из достижений современной иммунологии стало выяснение механизмов, лежащих в основе образования и взаимодействия этого пептида с молекулами ГКГС. На рисунке приведены два различных процесса, названных как «путь класса I» (слева) и «путь класса II» (справа). Первое доказательство того, что ГКГС вовлечён в представление антигена Т-клеткам, продемонстрировано феноменом рестрикции (ограничения) по ГКГС. Оказалось, что Т-лимфоцит, специфичный к антигену и ГКГС, распознаёт одновременно обе молекулы. Позже было установлено, что цитотоксическая Т-клетка реагирует на ядерные антигены вируса, не проявляющиеся на поверхности вируса. Как может Т-клетка «видеть» такие хорошо скрытые антигены? Ответ даётся в левой половине рисунка. Пептиды, происходящие из вируса, связываются с молекулой ГКГС класса I внутри клетки, и затем комплекс транспортируется на поверхность клетки, где Т-клетка распознаёт комбинацию пептид—молекула ГКГС и при соответствующих условиях убивает клетку, инфицированную вирусом (более подробно см. рис.20). В то же время установлено, что подобный процесс происходит в профессиональных антигенпредставляюших клетках, которые активируют Т-хелперы, с тем отличием, что они содержат молекулы ГКГС класса П, транспортирующие пептиды на поверхность клетки (правая половина рисунка). В отличие от пути класса I данный процесс происходит в эндосомально-лизосомальных вакуолях, в которых нормально расщепляется чужеродный материал (рис. 8). Недавно показано, что В-лимфоциты, получающие Т-клеточную помощь, также способны перерабатывать и представлять антиген, но лишь в тех случаях, когда он поступает внутрь клетки через её поверхностные иммуноглобулины (рис. 18). Таким образом, главная функция молекул ГКГС состоит в транспортировке на клеточную поверхность фрагментов внутриклеточных белков. Т-лимфоциты распознают пептиды и в случае их чужеродности пролиферируют в клоны и оказывают помощь макрофагам или В-лимфоцитам или разрушают заражённые вирусом клетки (более подробно см. последующие рисунки). Дата добавления: 2014-12-12 | Просмотры: 1655 | Нарушение авторских прав |