|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
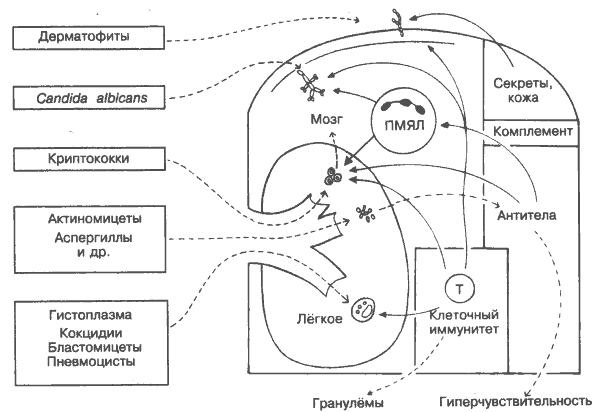
БАКТЕРИИНа рисунке бактерии приведены не в соответствии с классификацией, а в связи с их распространённостью. Некоторые виды бактерий приведены ниже. Стрептококки обычно классифицируются либо по гемолитическим экзотоксинам (a, b, g), либо по антигенам клеточных стенок (группы A-Q). Наиболее патогенны b-гемолитические стрептококки группы А. Они несут капсулы (М-белок) для прикрепления к слизистым мембранам, устойчивы к фагоцитозу, выделяют многочисленные экзотоксины (например, вызывающие симптоматику скарлатины), неперевариваемость оболочки вызывает сильный клеточный иммунный ответ, имеют антигены, перекрёстно реагирующие с сердечной мышцей (ревматическая лихорадка). Иммунные комплексы, включающие их, участвуют в поражении почек. Стафилококки — крайне разрушительные микроорганизмы, вызывающие абсцессы. Секретируют множество токсинов, в том числе антифагоцитарные факторы, включая фермент коагулазу и белок А, который блокирует опсонизацию, присоединяясь к Fc-фрагменту IgG. Пневмококки, менингококки классифицируются по антигенной структуре капсулы. Особенно вирулентны в тропических странах. Применение вакцин из полисахаридов капсулы оказывается высокоэффективным в предотвращении эпидемий. Этим инфекциям особенно подвержены больные с дефицитом антителообразования (рис. 39). Гонококки. Присоединение гонококков к слизистым оболочкам может блокироваться антителами класса IgA. В свою очередь гонококки выделяют протеазы, разрушающие IgA. Инфекция редко излечивается полностью и чаще приводит к бактерионосительству. Кроме того, гонококки — единственные бактерии, в отношении которых установлено литическое действие комплемента. Микобактерии туберкулёза и лепры имеют высокоустойчивые клеточные стенки, богатые липидами, успешно противостоящие действию лизосомальных ферментов и препятствующие слиянию фагосомы и лизосомы в фагоцитах. Клеточный иммунный ответ, переходя в хроническую стадию, вызывает многочисленные повреждения тканей и рубцевание. При лепре локализация или распространение возбудителей зависит от преобладания соответственно клеточной и антительной форм иммунного ответа. Шигеллы и возбудителя холеры обитают только в кишечнике. Патогенное действие обусловлено выделением экзотоксинов. Антитоксические вакцины создают иммунитет гораздо менее эффективно, чем естественная инфекция. Ведутся работы по созданию ослабленных штаммов методами генной инженерии (рис. 41). Сальмонеллы (например, Salmonella typhi) инфицируют кишечник. Способны выживать и развиваться в макрофагах. Столбнячная палочка выделяет экзотоксины, быстро поражающие ЦНС. Антитела (антитоксины) высокоэффективно блокируют действие токсинов. Пример того, что не требуется участия макрофагов и комплемента. Дифтерийная палочка также выделяет мощные нейротоксины, но смерть при инфекции может произойти в результате локального повреждения тканей гортани. Бледная трепонема (возбудитель сифилиса) — бактерия, которая выдерживает все формы иммунной атаки, не укрываясь в клетках хозяина. В реакции Вассермана используются аутоантитела к митохондриальному кардиолипину. Очевидно, перекрёстные реакции такого рода происходят вследствие мимикрии бактерий под антигены хозяина, которые таким образом избегают реакций со стороны иммунной системы. Продуцируемые аутоантитела способны вызвать повреждение тканей хозяина (рис. 36). Боррелии — другой вариант спирохет: обладают свойством, выявленным у некоторых вирусов и простейших, варьировать своими поверхностными антигенами, что сильно затрудняет антительный иммунный ответ. В результате инфекционное заболевание характеризуется периодическими приступами (возвратная лихорадка). 28. ИММУНИТЕТ К ГРИБАМ
Подавляющее большинство грибов — свободноживущие организмы, и лишь немногие из них способны вызывать заболевания животных и человека. Чаще всего для этого необходим длительный контакт (например, у сельскохозяйственных рабочих) или ослабленная иммунная система (например, при СПИДе). В основном грибковые инфекции довольно безобидны (например, парша). Однако некоторые грибы, обычно в виде спор проникающие через лёгкие (на рисунке в центре), могут вызывать серьёзные системные заболевания. В зависимости от степени и типа иммунного ответа развивается интенсивная реакция гиперчувствительности и происходит быстрое фатальное распространение гриба по всему организму хозяина или заболевание ограничивается поражением лёгких. Защитные механизмы грибов мало отличаются от таковых у бактерий и включают капсулу, предохраняющую грибы от фагоцитоза (например, у криптококков), резистентость к перевариванию в макрофагах (например, у гистоплазм) и способность к разрушению ПМЯЛ (например, у кокцидий). Некоторые дрожжевые клетки активируют комплемент по альтернативному пути, но неизвестно, как это сказывается на их выживаемости. С точки зрения иммунологии, из грибов наиболее интересен Candida albicans (на рисунке вверху слева) — безобидный и частый обитатель кожи и слизистых оболочек, который быстро реагирует на ослабление иммунной системы. Для его проникновения достаточно, чтобы организм был просто переутомлён, не говоря уже о дефектах ПМЯЛ и Т-клеток, старости, недоедании, иммуносупрессии, алкоголизме, диабете, недостатке железа и прочих причинах ослабления иммунитета (рис 39). Микроорганизмы, успешная жизнедеятельность которых возможна только при иммунодефиците у хозяина, называются оппортунистическими. К ним относятся не только грибы, но и некоторые вирусы (вирус цитомегалии), бактерии (синегнойная палочка), простейшие (токсоплазма), черви (нематоды). ПМЯЛ — полиморфно-ядерный лейкоцит (нейтрофил). Одна из важнейших фагоцитарных клеток. Любые нарушения в функции или количестве ПМЯЛ, вызванные генетическими причинами или индуцируемые лекарствами (стероидами, антибиотиками), создают основу для рецидивирующих грибковых и бактериальных инфекции. К функциональным дефектам относятся нарушения хемотаксиса (синдром «ленивых лейкоцитов»), неспособность к формированию нормальных фаголизосом (синдром Чедиака-Хигаси), нарушение продукции метаболитов кислорода (хронический гранулёматоз), дефицит миелопироксидазы и других ферментов. Фагоцитарная активность нейтрофилов ослабляется также в результате дефицита комплемента или антител (рис. 39). Т-клетка. Иммунодефицит по Т-лимфоцитам часто сопровождается грибковыми заболеваниями кожи, слизистых оболочек {Candida} и лёгких {Pneumocystis}. Т-лимфоциты играют важную роль в защите от грибов, но механизмы их действия ещё не установлены. Известно, что некоторые грибы уничтожаются NK-клетками (см. ниже). Гиперчувствительяость. Многие грибковые заболевания, особенно связанные с лёгкими, сопровождаются реакциями гиперчувствительности (обычно I или IV типа; рис. 33). Дерматофиты — нитевидные грибы, метаболизирующие кератин, который берут из волос, ногтей, кожи (дерматомикоз). Подвержены действию факторов сальных секретов и, вероятно, клеточного иммунитета. Candida albicans (Monilia) — дрожжеподобный гриб. Вызывает тяжёлые распространённые инфекции кожи, слизистой оболочки полости рта и других тканей у больных с иммунодефицитом, особенно с дефектами Т-клеток. Точная роль Т-клеток в подавлении инфекции не установлена. Значительного клинического улучшения и восстановления положительной кожной реакции замедленной гиперчувствительности удаётся добиться с помощью фактора переноса — экстракта из нормальных лейкоцитов. Первоначально считалось, что фактор переноса передаёт специфическую Т-клеточную отвечаемость. Теперь известно, что его эффективность не связана со специфичностью в отношении антигена. Криптококки (инкапсулированные дрожжи) имеют оболочку, успешно противостоящую фагоцитозу, если нет опсонизации антителами и/или комплементом (сравните пневмококки и др.). При иммунодефиците распространяются в мозг и мозговые оболочки, вызывая серьёзные осложнения. In vitro Криптококки могут разрушаться NK-клетками. Актиномицеты и другие спорообразующие грибы из прелого сена, соломы и др. способны достигать лёгочных альвеол и стимулировать синтез антител (классов IgG и IgE) с последующей индукцией острой гиперчувствительности («лёгкое фермера»). Аспергиллы обычно поражают больных туберкулёзом. Гистоплазма (гистоплазмоз), кокцидвв (кокцидиоз), блас-томнцен (бластомикоз) наиболее распространены в Америке. Вызывают похожие заболевания лёгких, которые в зависимости от иммунного статуса больного могут спонтанно разрешаться или приводить к хроническому гранулёматозу и фиброзу. Сходство этих инфекций с туберкулёзом и лепрой подтверждает тот факт, что течение инфекционного заболевания больше зависит от реализуемых микроорганизмом защитных механизмов (в данном случае резистентность к перевариванию макрофагами), чем от вида самого паразита. Пневмоцисты (Pneumocystis carinii). Исследования РНК показали, что эти микроорганизмы всё-таки ближе к грибам, чем к простейшим. Пневмоцистная пневмония стала одним из опаснейших осложнений при СПИДе (рис. 40), что предполагает наличие в норме супрессорного влияния Т-лимфоцитов на размножение паразита, хотя механизм этого влияния ещё неизвестен. 29. ИММУНИТЕТ К ПРОСТЕЙШИМ
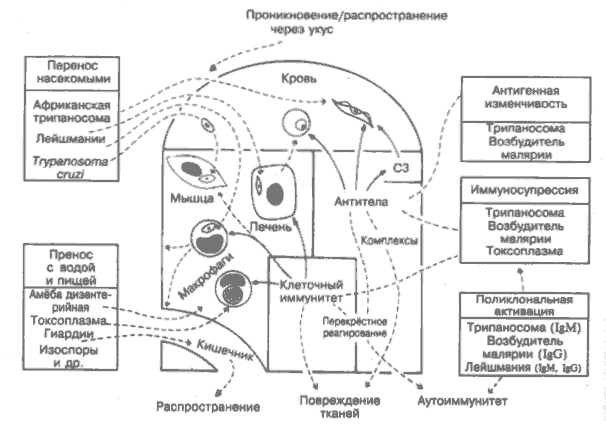
Относительно немногие (менее 20) простейшие инвазируют человека, но среди них 4 паразита представляют наибольшую опасность для него, вызывая тяжёлые заболевания: возбудители малярии, африканская и американская трипаносомы, лейшмании (на рисунке слева вверху). Простейшие используют те же защитные механизмы, что и бактерии и вирусы, но делают их более совершенными. Они распространяются на большие расстояния насекомыми-переносчиками (для сравнения — чума, тиф, жёлтая лихорадка), паразитируют внутриклеточно (для сравнения — туберкулёзная палочка, вирусы), отличаются вариабельностью антигенов (для сравнения — грипп) и обладают иммуносупрессивными свойствами (для сравнения — ВИЧ). В результате полноценный иммунитет к ним очень редок, а роль иммунной системы сводится к ограничению численности паразитов (нестерильный иммунитет) и сохранению жизни организма хозяина (а значит, и паразитов). Рациональность вакцинации соответственно низка с учётом того, что некоторые симптомы заболевания развиваются в результате иммунных повреждений, а не воздействия паразита как такового. Напротив, простейшие, поражающие кишечник (на рисунке внизу слева), вызывают достаточно лёгкие заболевания (при условии нормального функционирования иммунной системы). Однако какими бы лёгкими эти болезни ни казались, в сочетании с паразитирующими в кишечнике червями, о которых пойдёт речь в следующем разделе, они составляют серьёзную дополнительную нагрузку на здоровье в тропических странах. Африканские трипаносомы Trypanosoma gambiense и r.rtodesiense, разносимые мухой цеце, вызывают сонную болезнь и распространены в Восточной и Западной Африке. Циркулирующие в крови формы чувствительны к антителам и комплементу, но выживают в результате антигенной вариабельности поверхностного гликопротеина, контролируемого антигенпереключающим геном. Число возможных вариантов неизвестно, но велико (вероятно, около тысячи). Наряду с подавленным антительным ответом на другие антигены (в частности, вакцинальные), в организме больного присутствуют в большом количестве неспецифические IgM, в том числе и аутоантитела. Вероятно, это следствие поликлональной активации В-лимфоцитов паразитарными продуктами (для сравнения — бактериальные липополисахариды). Организм человека устойчив к трипаносомам грызунов, так как содержит нормальный сывороточный фактор — липопротеин высокой плотности, который агглютинирует их. Это хороший пример защитной роли естественного иммунитета. Плазмодии малярии Plasmodiumfalciparum (наиболее опасна), Р. malaria, P. vivax и Р. ovale переносятся комарами. При заражении проникают сначала в печень. На этой стадии вакцинация эффективна, вероятно, благодаря цитотоксическин Т-лимфоцитам. Тканевая стадия очень непродолжительна, и вслед за ней возбудители начинают циклически проникать в эритроциты. На этой стадии антитела менее эффективны вследствие вариабельности антигенов возбудителя и поликлональной продукции IgG. На некоторых экспериментальных моделях вакцинация защищает организм на эритроцитарной стадии развития и гамет. Получены обнадёживающие результаты в опытах по созданию вакцины против Р. falciparum у человека. Эритроциты человека, не имеющие антигенов групп крови Даффи или содержащие фетальный гемоглобин, естественным образом резистентны к Р. vivax и Р. falciparum. P. malaria вызывают отложение иммунных комплексов в почках. В тяжёлых случаях малярии наблюдается повышенный уровень фактора некроза опухоли (рис. 23) в результате чрезмерной активации макрофагов продуктами паразита. Сходная патология наблюдается при грамотрицательной бактериальной септицемии. Бабезии, или пироплазмы. — паразиты крупного рогатого скота, сходные с возбудителями малярии. Разносятся клещами и способны заражать человека. Вероятность заражения возрастает после удаления селезёнки и при иммуносупрессивной терапии. Применение ослабленной вакцины для лечения собак и крупного рогатого скота даёт превосходные результаты. Тейлерии (лихорадка восточного побережья) — инфекция крупного рогатого скота. Сходна с малярией, но внутриклеточная стадия развития возбудителя проходит не в печени, а в лимфоцитах. Необычность заболевания состоит ещё в том, что возбудитель разрушается цитотоксическими Т-клетками, т.е. ведёт себя как вирус. Лейшмании — многочисленные паразиты, разносимые песчаными москитами и песчаными мухами. Встречаются в основном в тропических странах, где вызывают множество заболеваний. Паразитируют внутриклеточно в макрофагах. Патология с поражением кожи или внутренних органов во многом зависит от силы клеточного иммунного ответа и/или его баланса с антителами (для сравнения — лепра). Африканский кожный лейшманиоз необычен тем, что стимулирует самоисцеление с последующей резистентностью к возбудителю. Этот вид защиты многие столетия был известен на Ближнем Востоке (лейшманизация). Эксперименты на мышах показывают, что Th1-лимфоциты опосредуют резистентность к лейшманиям, а Тh2-лим-фоциты ослабляют её. Окись азота может быть основным противопаразитарным киллерным агентом (рис. 8). Trypanosoma cruzi вызывает американский трипаносомоз, или болезнь Чагаса. Источник инфекции — дикие млекопитающие, переносчики — насекомые. Трипаносомы инфицируют множество клеток, в значительной степени мышцу сердца и ганглии вегетативной нервной системы. Предполагается, что клеточно опосредованный аутоиммунный ответ против антигенов мышцы сердца может быть причиной хронической сердечной недостаточности. Аналогична ситуация с нервной системой. Существует сходство между антигенами нервной системы и паразита. Антитела и эозинофилы убивают микроорганизмы in vitro, но перспективной представляется вакцинация только против паразита, циркулирующего в крови. Лучшим решением проблемы является преодоление нищеты, с которой обычно связано обилие переносчиков болезни. Токсоплазмы Т. gondii особенно вирулентна для плода, и больных с ослабленной иммунной системой, поражает главным образом глаза и мозг. Способна выживать в макрофагах, препятствуя образованию фаголизосом (для сравнения — туберкулёз), но клеточные иммунные реакции могут действовать на паразита в этой стадии. Токсоплазма стимулирует макрофаги и подавляет Т-лимфоциты, влияя на резистентность к другим возбудителям инфекции. Entamoeba hislolytica обычно является причиной заболевания толстой кишки (амёбная дизентерия), но может попасть с кровью в печень и другие органы и вызвать абсцессы в результате прямого лизиса клеток хозяина. Некоторые животные и, возможно, человек способны вырабатывать иммунитет определённой степени к паразиту на тканевой стадии развития, но не на стадии развития в кишечнике. Giardia, Balantidium, Cryptwporidium, Isospora и др. обычно локализуются в кишечнике, вызывая дизентерию и расстройства всасывания. При СПИДе могут вызывать серьёзные осложнения (рис. 40). 30. ИММУНИТЕТ К ГЕЛЬМИНТАМ
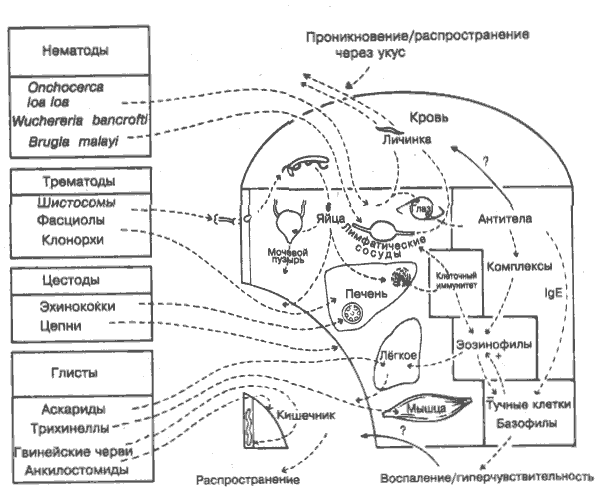
Паразитирующие черви всех 3-х классов (трематоды, цестоды и нематоды) вызывают у человека множество заболевании, наиболее неприятные из которых (на рисунке слева вверху) онхоцеркоз, слоновость и шистосомоз. Эти болезни распространены в тропических странах и переносятся насекомыми, моллюсками и др. Другие болезни (на рисунке слева внизу) распространены повсеместно и передаются с пищей, заражённой яйцами, личинками или цистами паразитов. Черви характеризуются сложным жизненным циклом и круговой миграцией, во время которой часто заселяют определённые органы. Особенность иммунного ответа на червей характеризуется определяющей ролью эозинофилов и IgE. В соответствии с этим заболевания обычно сопровождаются реакциями гиперчувствительности в коже, лёгких и других органах, причём протективная эффективность этих реакций противоречива. Поскольку в организме человека черви не воспроизводятся (в отличие от простейших, бактерий и вирусов), каждая отдельная особь защищена от действия иммунных факторов. Как и в случае с наиболее адаптированными простейшими (плазмодии малярии), действие иммунитета состоит скорее в ограничении численности червей, чем в их уничтожении. Возможность вакцинации человека представляется маловероятной, хотя для некоторых животных (собаки, крупный рогатый скот) вакцинация оказывается на удивление эффективной. Интересно, что некоторые препараты, действующие на червей (ниридазол, левамизол, гетразан), как выяснилось, стимулируют или супрессируют Т-лимфоциты человека, воспалительные процессы и т.д. Возможно, черви имеют общие с хозяином структуры и метаболические характеристики. Эозинофилы могут выполнять 3 функции при гельминтозах, включая фагоцитоз многочисленных комплексов антиген-антитело, модуляцию гиперчувствительности и киллинг некоторых червей с помощью IgG-антител (по крайней мере in vitro). Эозинофилия развивается частично под влиянием тучных клеток и факторов хемотаксиса, выделяемых Т-клетками. Стимуляция выхода эозинофилов из костного мозга осуществляется Т-клетками через ИЛ-5 (рис. 23). IgE. Экстракты некоторых червей и сами черви стимулируют синтез как специфических, так и неспецифических IgE-антител. Возможно, опосредуемая IgE воспалительная реакция (например, в кишечнике) препятствует проникновению или фиксации червей. С другой стороны, IgE в больших количествах способны блокировать тучные клетки, предотвращая аллергию, например, к пыльце растений. Синтез антител класса IgE означает активность Т-хелперов типа Th2. НЕМАТОДЫ (круглые черви) Нематолы подразделяются на филярии, у которых личинки I стадии (микрофилярии) могут развиваться лишь в насекомых, а для человека инфекционна только Ш их стадия, и кишечные глисты, у которых весь цикл развития может проходить у человека. Филярии. Onchocerca volvulus — возбудитель онхоцеркоза, или «речной слепоты», распространяется мошками Simulium, которые откладывают и концентрируют личинки в коже человека. Микрофилярии, обитающие в области глаза, вызывают прогрессирующую слепоту, которая в основном связана с иммунным ответом. На Ближнем Востоке патология связана преимущественно с поражением кожи. Не совсем ясно, с чем связаны особенности заболевания — с паразитами или иммунологическими особенностями (сравните — лепра). Loa loa вызывает сходное заболевание (лоаоз), но в более лёгкой форме. Wuchereria bancrofti и Brugia malayi распространяются комарами, которые всасывают микрофилярии с кровью больного. Личинки заселяют лимфатические сосуды и лимфатические узлы и вызывают слоновость, частично блокируя и частично стимулируя клеточный иммунитет. Возможно, какую-то роль в этом играют элементы почвы, например силикаты. На некоторых экспериментальных моделях микрофиляремия контролируется антителами. Глисты кишечника — Axaris, Strongiloides, Toxocara. При прохождении через лёгкие могут вызвать астму и другие заболевания лёгких, связанные с эозинофилией. Личинки Trichinella spiralis инкапсулируются в мышцах. На некоторых экспериментальных моделях черви этого типа стимулируют стойкий защитный иммунитет. Strongiloides часто вызывают заболевание у людей с иммуносупрессией. Toxocara — болезнь кошек и собак; передаваясь людям, вызывает заболевание детей младшего возраста (токсокароз) и поражения глаз в более позднем возрасте. Гвинейские черви (Dracunculus) обитают под кожей, достигая в длину до 120 см. Анкилостомиды (Ancylostoma, Necator) проникают через кожу и живут в тонкой кишке, вызывая тяжёлые анемии. Ни один из этих червей не стимулирует защитный иммунитет. ТРЕМАТОДЫ (сосальщики) Часть жизненного цикла трематоды проходят в моллюске. Выходящий из него церкарий способен инфицировать человека через кожу (шистосомы) или попадает в организм с пищей (фасциолы, клонорхи). В последнем случае трематоды заселяют печень (печёночные сосальщики), но не стимулируют защитный иммунитет. Шистосомы (кровяные сосальщики) обитают и спариваются в венозной крови [Schistosoma mansoni, S. japonicum — в брыжейке; S. haematobium — в мочевом пузыре). Безвредны до тех пор, пока их яйца не попадут в печень или мочевой пузырь. После этого опосредованные Т-клетками гранулёматозные реакции могут вызвать фиброз в печени, а иногда рак мочевого пузыря. Для защиты от иммунных факторов поверхность взрослых червей покрыта антигенами, происходящими из клеток хозяина. В то же время стимулируемые антитела могут поражать молодые формы на последующих стадиях развития. В этих реакциях участвуют IgE-, IgG-антитела, эозинофилы и макрофаги. Шистосомы выделяют множество молекул, разрушающих антитела и подавляющих макрофаги, что делает взрослую особь практически неуязвимой. Таким образом, организм хозяина, оставаясь заражённым шистосомой, становится устойчивым к реинвазиям (сопутствующий иммунитет). Фасциолы представляют опасность в основном для сельскохозяйственных животных, у которых они паразитируют в желчном протоке. В этих случаях иммунный ответ может вызвать повреждение печени. Вакцины неэффективны. Клонорхи сходны с фасциолами, но инфицируют человека и могут вызывать рак желчного протока. ЦЕСТОДЫ (ленточные черви) Паразитирование цестод в кишечнике может быть для хозяина сравнительно безвредным (например, цепни), но иногда они попадают в мозг, где погибают (цистицеркоз) или образуют колонии в печени (например, пузыревидные личинки эхинококка), в которой черви защищены от действия антител. Антигены эхинококка (например, освобождаемые при хирургическом вмешательстве) могут вызвать тяжёлую гиперчувствительность немедленного типа (рис. 33), 32. НЕЖЕЛАТЕЛЬНЫЕ ПРОЯВЛЕНИЯ ИММУНИТЕТА. ОБЩАЯ СХЕМА
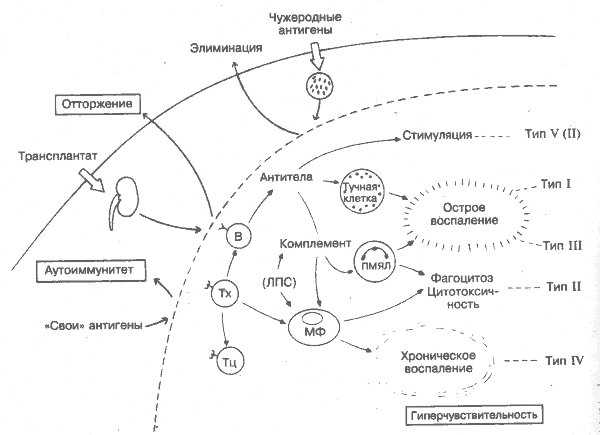
Эффективность иммунной системы, полезная в борьбе с инфекциями (верхняя часть рисунка), имеет и негативные стороны. Наличие широкого спектра рецепторов, специфически распознающих антигены и приводящих в действие мощные эффекторные механизмы, в ряде случаев может обернуться против хозяина. Во-первых, иногда механизмы, сдерживающие реагирование лимфоцитов против «своих» антигенов, оказываются неэффективными (аутоинмунитет; внизу слева); кроме того, возникают ситуации, когда отторжение трансплантата нежелательно. Во-вторых, сильные эффекторные факторы (комплемент, гранулоциты, макрофаги и др.; в центре) могут повреждать окружающие ткани по типу гиперчувствительности. Классификация патологических иммунных реакций никогда не отличалась особой стройностью. Аллергия первоначально означала любые отклонения в реакции иммунной системы на повторную встречу с антигеном. Гиперчувствительность, вместо того чтобы обозначать вредное для организма реагирование, отражала только время, необходимое для проявления порой безобидных (например, кожные тесты) реакций и подразделялась по этому принципу на острую, немедленную и замедленную. На сегодня иммунология накопила достаточно знаний, чтобы классифицировать патологические иммунные реакции по типу задействованных эффекторных механизмов. Речь идет о схеме Джелла и Кумбса (тип I-IV; справа), которая сохранила привычные значения терминов «аллергия» и «Гиперчувствительность», но расширила значение последней за счёт аутоиммунитета и отторжения трансплантата. Тем не менее большинство иммунологов предпочитают употреблять термин «аллергия» для определения немедленной реакции гиперчувствительности (тип I), например, к пыльце растений. Несмотря на это, необходим новый взгляд на сущность тех процессов, которые происходят в результате специфического распознавания и действия эффекторных механизмов, ведущих к повреждению ткани. Т-хелперы. Распознавание Т-хелпером несущей части антигенной детерминанты необходимо как для стимуляции В-лимфоцита к синтезу антител, так и для активации макрофагов. Не доказано, что Т-хелперы реагируют на абсолютно неизменённые собственные антигены in vivo (рис. 22, 36). B — В-лимфоциты — предшественники антителообразующих клеток. Распознают «свои» антигенные детерминанты в норме. Они могут переключиться-на продукцию аутоантител при частичной или перекрёстной реакции на «свои» антигены, если Т-хелперы распознают «не свои» детерминанты на том же антигене (например, лекарство или вирус; рис, 36). Тц — цитотоксические Т-лимфоциты, способные убивать аллогенные или изменённые «свои» клетки-мишени. Цитолитическая активность по отношению к «своим» нормальным клеткам демонстрируется in vitro, но не наблюдается в чистом виде in vivo, возможно, из-за её блокады. Тучные клетки. Базофильные гранулы тучных клеток содержат вазоактивные амины и другие медиаторы, которые освобождаются после того, как фиксированные на поверхности клетки IgE связывают аллерген, что приводит к быстрому локальному (аллергия) или системному (анафилаксия) воспалению (рис. 33). Иммунные комплексы. Связывание антител с антигеном — основа нормального гуморального ответа. Если растворимые иммунные комплексы не фагоцитируются, а циркулируют в крови, активируя комплемент, полиморфно-ядерные лейкоциты и тромбоциты, то они могут вызвать тканевые повреждения (рис. 34). Комплемент. Активированный иммунными комплексами комплемент участвует не только в элиминации антигена, но и в повреждении тканей. Анафилатоксины СЗа и С5а действуют на тучные клетки, а опсосин СЗb и литический комплекс С5-С9 способствуют разрушению трансплантированных клеток и через аутоантитела — собственных клеток организма. ПМЯЛ — полиморфно-ядерные лейкоциты. Опосредуемый комплементом хемотаксис ПМЯЛ приводит к их быстрому накоплению в очаге воспаления, где они фагоцитируют иммунные комплексы. Лизосомальные ферменты гранулоцитов способны вызывать деструкцию тканей (например, феномен Артюса). Тр — тромбоциты. Комплексы антиген-антитело связывают и агрегируют тромбоциты, что ведёт к выделению вазоактивных аминов и закупорке сосудов. Агрегация тромбоцитов является одной из характеристик отторжения трансплантата почки. МФ — макрофаги. Фагоцитирующие макрофаги под влиянием Т-клеток накапливаются и активируются в очаге персистенции антигена и вызывают некроз тканей или образование гранулём (рис. 35). Медленное поступление моноцитов и макрофагов в участок подкожной инъекции антигена характеризует замедленный тип гиперчувствительности. Макрофаги могут быть активированы и непосредственно бактериальными продуктами. Так, бактериальный эндотоксин липополисахарид (ЛПС) стимулирует освобождение ФНО и ИЛ-1. Эти цитокины в больших дозах могут вызвать коллапс сосудов и повреждение некоторых органов. Эндотоксический шок с участием цитокинов характерен для инфекций, вызванных менингококками и другими грамотрицательными бактериями. Кроме того, эндотоксины непосредственно активируют комплемент (по альтернативному пути) и запускают процесс свёртывания крови. ТИПЫ ГИПЕРЧУВСТВИТЕЛЬНОСТИ (классификация Джелла и Кумбса с добавлениями): I. Острая реакция (немедленная, анафилактическая, реагиновая) опосредуется IgE-антителами (иногда IgG) вместе с тучными клетками, например, сенная лихорадка. II. Опосредуемая цитотоксическими антителами класса IgM или IgG вместе с комплементом, К-клетками или фагоцитами реакция, например, трансфузионные реакции, многие аутоиммунные заболевания. Возможно, это не гиперчувствительность, а проявления аутоиммунитета и реакций отторжения трансплантата. Подобные возражения привели к появлению реагирования по типу V (см. ниже). III. Опосредуемая иммунными комплексами; воспаление с участием комплемента, полиморфно-ядерных и других лейкоцитов, например, феномен Артюса, сывороточная болезнь, хронический гломерулонефрит. IV. Опосредуемая клетками (замедленная, туберкулинового типа): Т-зависимая активация макрофагов, эозинофилов и других клеток, например, туберкулоидная лепра, шистосомный цирроз, отторжение трансплантата, кожная сыпь вирусной природы. V. Стимулирующая — сравнительно недавно появившаяся подгруппа реагирования типа II. Сюда можно отнести случаи прямой стимуляции антителами функции клеток (например, стимуляция тиреоидстимулирующего рецептора щитовидной железы при тиреотоксикозе). Следует выделить отдельный тип гиперчувствительности для блокирующих и усиливающих антител противоопухолевого иммунитета, а также для поликлональной активации В-лимфоцитов, например, при трипаносомозе. Важную роль в процессах гиперчувствительности играют многие цитокины. 33. АЛЛЕРГИЯ И АНАФИЛАКСИЯ
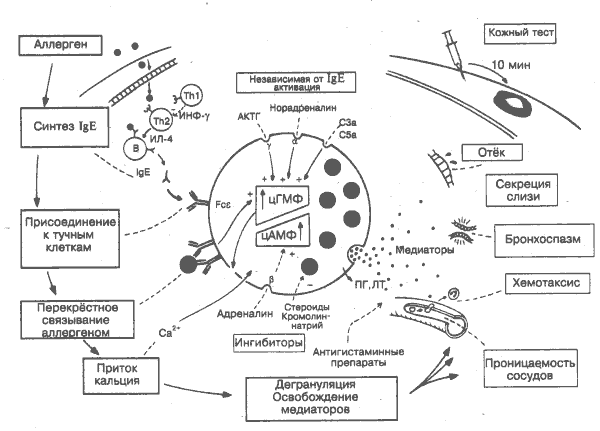
Из проявлении гиперчувствительности наиболее распространены реакции I типа по классификации Джелла и Кумбса. К ним относятся патологические расстройства разной степени тяжести — от распространённых аллергических состоянии, таких как сенная лихорадка, крапивница, экзема, до редких, но тяжёлых анафилактических реакций на пенициллин,пчелиный яд и др. В основе этих видов патологии лежат дегрануляция тучных клеток под действием специфических lgE-антител и освобождение медиаторов воспалительных процессов. Таким образом, это случаи острого воспаления (рис. 6), индуцированного не инфекцией или повреждением тканей, а конкретным антигеном. Системное освобождение медиаторов (анафилаксия) характеризуется бронхоспазмом, рвотой, кожными высыпаниями, отёком слизистой оболочки горла и полости носа, сосудистым коллапсом и может привести к смерти. Локальное освобождение медиаторов характеризуется чаще всего каким-либо одним из этих симптомов в зависимости от зоны воздействия антигена. Антигены, запускающие эти реакции, известны как аллергены. Людей, страдающих чрезмерной аллергией, называют атопиками. Обычно заболевание имеет наследственную природу и сопровождается множеством конституциональных аномалий. Поскольку одним из сильных аллергенов являются антигены гельминтов, то существует мнение, что такая разрушительная и явно бесполезная форма иммунного ответа сохранилась с того времени, когда гельминтозы представляли серьёзную угрозу для выживания человека. Тем не менее антитела класса IgE эффективны при минимальных повреждениях (например, глисты в кишечнике), быстро и специфически вызывая воспалительный процесс с привлечением лейкоцитов из кровотока. Воспалительные процессы тесно связаны с функционированием вегетативной нервной системы. Через влияние симпатических (а и р) и парасимпатических(у) рецепторов на внутриклеточные уровни циклических нуклеотидов АМФ (аденозинмонофосфат) и ГМФ (гуанозинмонофосфат) возможна регуляция активности тучной клетки в освобождении медиаторов (рис. 24). Дегрануляция тучных клеток может произойти в результате действия факторов повреждения тканей (рис. 6) или активации комплемента (рис. 34). IgE — основной класс реагиновых (гомоцитотропных, кожносенсибилизирующих) антител. В норме составляют менее 1/10000 всех сывороточных иммуноглобулинов. При аллергии и глистной инвазии общее содержание IgE в крови возрастает более чем в 30 раз, а содержание специфических lgE-антител — более чем в 100 раз. Дегрануляция тучной клетки происходит после того, как связанные с Fce-рецепторами антитела класса IgE взаимодействуют с аллергеном. При внутрикожной инъекции аллергена сенсибилизированному индивиду уже через несколько минут развивается немедленная кожная реакция. Состояние гиперчувствительности может быть перенесено морской свинке с сывороткой. Это тест на пассивную кожную анафилаксию. Антитела класса IgG, удаляя аллерген, способны предотвратить дегрануляцию тучных клеток. Некоторые подклассы IgG (для человека — IgG4), напротив, могут вызвать реагиновый тип реакции. Тх — Т-хелпер. Продукция IgE В-лимфоцитами — высокозавсимый от Т-клеток процесс. У больных атопией аллергены стимулируют цитокины Th2 (ИЛ-4, ИЛ-5 и др.), в отличие от здоровых, у которых преобладают цитокины Th1. По-видимому, ИФ-g ингибирует синтез IgE-антител, и в этом отношении цитокины Thi рассматриваются как супрессорные при аллергии. Это является убедительным подтверждением существования разных субпопуляций Т-хелперов у человека. Показано также, что многие другие факторы, выделяемые Т-лимфоцитами, участвуют в регуляции синтеза IgE. Тучные клетки. Тканевые тучные клетки отличаются от базофилов крови главным образом по содержанию медиаторов. Существуют значительные различия между тучными клетками, локализующимися в соединительных тканях вокруг кровеносных сосудов, и тучными клетками в лёгких, кишечнике (тучные клетки слизистых тканей). Тучные клетки слизистых тканей отличаются тем, что регулируются Т-лимфоцитами и, как считают некоторые исследователи, происходят из них. Са2+. Перекрёстное связывание IgE-рецепторов антигеном сопровождается изменениями липидов клеточной мембраны. Это приводит к притоку в клетки кальция, увеличению количества аденилатциклазы и как следствие к возрастанию уровня цАМФ. цАМФ, цГМФ — циклические аденозин- и гуанозинмонофосфаты, относительные уровни которых регулируют клеточную активность. Падение величины соотношения цАМФ/цГМФ в результате притока Са2+ или стимуляции a- и g-рецепторов вызывает дегрануляцию клетки. Стимуляция b-рецептора, например, адреналином, приводит к обратному эффекту. У больных с атопией может быть частичный дефект функции b-рецепторов, ведущий к высвобождению излишнего количества медиаторов. Дата добавления: 2014-12-12 | Просмотры: 1354 | Нарушение авторских прав |