|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ИММУННЫЕ КОМПЛЕКСЫПри избытке антигена или антител образуются преимущественно мелкие (растворимые) комплексы. При почти одинаковых количествах антигена и антител (зона эквивалентности) формируются преципитаты (образования решётчатой структуры). В присутствии комплемента (т.е. в свежей сыворотке) образуются только растворимые комплексы; СЗ способен растворять крупные комплексы (рис. 34). Блокирование киллерной активности, опосредованной Т-лим-фоцитами или антителами, иммунными комплексами при избытке антигена или антител (соответственно) может стать причиной неотвечаемости на опухоли или паразитарные заболевания. C1q — первый компонент комплемента. Связывается с Fc-фрагментом антител в иммунном комплексе, и, возможно, это происходит после конформационных изменений в молекуле Ig, хотя некоторые исследователи считают достаточным условием на-груженность антигеном обоих активных участков (IgG). Связывание Clq с иммунным комплексом вызывает активацию комплемента по классическому пути. Воспаление. Продукты расщепления СЗ и С5, воздействуя на тучные клетки, нейтрофилы и др., вызывают повреждение сосудов, характерное для болезней, связанных с иммунными комплексами (рис. 34). Лизис (например, бактерий) требует полного каскада компонентов комплемента. Иногда комплекс С5,6,7 удаляется от первоначального участка связывания антитела, активирует С8 и С9 и вызывает лизис нормальных клеток (например, эритроцитов) — процесс, известный как реактивный лизис. Фагоцитоз. Чаще всего иммунные комплексы фагоцитируются макрофагами, нейтрофилами, эозинофилами и др. Обычно классы и подклассы антител, соединяющиеся с Fc-рецепторами фагоцитов, связываются и с комплементом, давая более высокий эффект опсонизации. Действие через Fc- и СЗ-рецепторы происходит по разным механизмам. IgM, например, в большей степени связывает комплемент, чем взаимодействует с фагоцитарными клетками. Большинство иммунных комплексов, циркулирующих в крови, связывается через рецепторы комплемента с эритроцитами (рис. 5), попадает с ними в печень или селезёнку, где удаляется местными фагоцитарными клетками. Цитотоксичность. Антитела, связанные с поверхностью клетки или микроорганизма, через Fc-рецепторы могут опосредовать киллинг, а не фагоцитоз. Макрофаги, моноциты, нейтрофилы, эозинофилы и лимфоцитоподобные К-клетки способны осуществлять антителозависимую клеточно опосредованную Цитотоксичность (рис. 9). Данные о значении этого типа цитотоксичности in vivo противоречивы. В-клеточная память. Фолликулярные дендритные клетки имеют рецепторы к комплементу, которые позволяют им удерживать иммунные комплексы и представлять антиген В-лимфоци-там с высокоаффинными свойствами рецепторов, обеспечивая тем самым усиление антительного ответа. Выявление растворимых комплексов Иммунные комплексы осаждают ультрацентрифугированием или в градиентах плотности и преципитируют в полиэтиленгликоле (ПЭГ), а также на холоде (криопреципитация). Имея в своём составе иммуноглобулины, комплексы выявляются анти-Ig-антителами (например, ревматоидный фактор). Для обнаружения иммунных комплексов часто используют чувствительную реакцию их связывания с C1q. Выявление компонента СЗ основано на применении анти-СЗ-сывороток (иммуноконглютинин) и использовании клеток линии Raji с рецепторами комплемента. Некоторые комплексы не фиксируют комплемент, но преципитируются ПЭГ. Отдельные тесты могут выявлять также другие крупные молекулы. Поэтому для определения иммунных комплексов необходимо сочетание нескольких тестов. 20. КЛЕТОЧНЫЙ ИММУННЫЙ ОТВЕТ
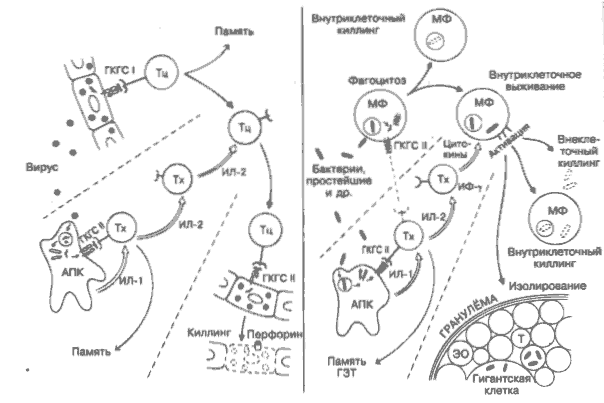
Многие варианты иммунного ответа опосредуются Т-лимфоцитами. проходят без участия В-лимфоцитов, проявляя при этом характерные для адаптивного иммунитета специфичность и память. Первоначально была выявлена их роль в иммунитете к возбудителю туберкулёза, а позже установлено, что они вовлекаются в контактную чувствительность, отторжение трансплантата, противовирусный и противоопухолевый иммунитет, хроническое воспаление и др. Во всех случаях речь идёт о клеточном иммунитете. Этот вариант иммунитета проявляется в двух направлениях: генерации специфических цитотоксических Т-лимфоцитов против внутриклеточных вирусов (на рисунке слева) и стимуляции Т-лимфоцитами активности неспецифических клеток, таких как макрофаги, в отношении внутриклеточных бактерий и других паразитов (справа). Примером последнего типа ответа является гиперчувствительность замедленного типа, определяемая в кожном тесте. Клеточный иммунный ответ имеет много общего с гуморальным, а именно взаимодействие с участием Т-хелперов и представление антигена в ассоциации с молекулами ГКГС (рис. 13, 14, 17). Нежелательными последствиями клеточного иммунитета могут быть повреждение тканей и отторжение трансплантата (рис. 35,37). Как и антительный ответ, клеточный иммунитет регулируется различными супрессорными клетками и факторами (на рисунке не показаны), которые в норме, вероятно, ограничивают повреждающие побочные эффекты, но при некоторых заболеваниях подавляют защитные свойства иммунной системы. Вирусы. Не способны к длительному выживанию вне клеток хозяина, в которых они размножаются, покидают их, и в то же время многие из них разрушают клетку (подробно см. рис. 26). ГКГС I - молекулы ГКГС класса I (А, В, С у человека, К, D, L у мыши; рис. 13) играют существенную роль в распознавании вирусных антигеиов рецептором цитотоксических Т-лимфоцитов. Молекулы CDS также участвуют в этом процессе (рис. 14, 17). Тц — цитотоксический Т-лимфоцит (Т-киллер), в функцию которго, в частности, входит распознавание и уничтожение инфицированных вирусом клеток. Их рецепторы распознают собственные антигены ГКГС класса I плюс «не свои» вирусный антиген. Распознавание высокоспецифично, т.е. имеются разные Т-лимфоциты для различных вирусов, которые отбираются и клонально пролиферируют подобно В-клетке (на рисунке этот этап не показан). АПК — антигенпредставляющие клетки. Представляют сочетание антигена вируса и молекулы ГКГС II Т-хелперу так же, как в антительном ответе, и секретируют ИЛ-1. ИЛ-1 — интерлейкин-1 (м. м, 17 500). Белок, секретируемый АПК и макрофагами, Стимулирует Т-хелперы к продукции ИЛ-2 и пролиферации. ИЛ-1 ранее был известен как LAF — фактор, активирующий лимфоциты (интерлейкины; рис. 23). Тх — Т-хелпер. Т-лимфоцит-хелпер для клеточного иммунитета во многом сходен и, возможно, подобен Т-хелперу для антительного ответа (см. Thi- и Тh2-клетки; рис. 9). Вызывает пролиферацию и дифференцировку цитотоксических Т-клеток в зрелые киллерные клетки главным образом с помощью секретируемого им ИЛ-2. ИЛ-2 — интерлейкин-2 (м. м. 15 500). Гликопротеин, секретируемыи Т-хелпером и значительно варьирующий у разных биологических видов. Действует только на клетки, несущие соответствующий рецептор. На Т-лимфоцитах рецепторы к ИЛ-2 появляются в процессе созревания. ИЛ-2 ранее был известен как фактор роста Т-лимфоцитов — TCGF (рис. 23). Цитолитическое действие. После полного созревания цитотоксические Т-клетки способны лизировать любую клетку, на поверхности которой распознают сочетание антигена вируса и молекулы ГКГС класса I. Цитолитическое действие осуществляется в два этапа: присоединение киллера к поверхности клетки-мишени с помощью антигенспецифического рецептора и последующий Са2+-зависимый лизис её. Лизис происходит после отсоединения киллера, что позволяет одному киллеру лизировать несколько клеток-мишеней. В процессе лизиса участвуют секретируемые лимфоцитом перфорины, которые являются небольшими порообразующими молекулами, сходными с литическим комплексом конечных компонентов комплемента. Интересно, что естественные клетки-киллеры (NK), несмотря на отличие их распознающих механизмов, используют для лизиса мишеней те же способы, что и Т-киллеры (рис. 26). Кроме того, под влиянием клеток-киллеров запускаются механизмы апоптоза в клетке-мишени, что ведет к её гибели. Бактерии. Некоторые бактерии, простейшие, грибы и многие вирусы, будучи фагоцитированными макрофагами (МФ), избегают обычного внутриклеточного киллинга (рис. 8) и выживают в фаголизосомах или в свободном состоянии в цитозоле. В отсутствие помощи от Т-лимфоцитов возможно развитие прогрессирующей, не поддающейся лечению инфекции, Помощь Т-хелперов (Th1) заключается в секреции ИФ-g и некоторых других факторов, активирующих макрофаги. Цитокины Большое семейство молекул, продуцируемых лим-фоидными и миелоидными клетками с различным действием на макрофаги. Они неспецифичны по отношению к антигену, и активность некоторых из них подавляется естественными ингибиторами, ограничивающими их нежелательные эффекты. Ниже представлены некоторые из наиболее известных цитокинов (подробнее см. рис. 23): ИЛ-2 — см. выше. МИФ — фактор, ингибирующий миграцию макрофагов, ограничивает их подвижность и концентрирует в окружении Т-лимфоцита. МАФ — фактор, активирующий макрофаги, повышает многие их функции, включая внутриклеточный киллинг и секрецию различных цитотоксических факторов, способных поражать микроорганизмы вне клетки. Ивтерферон (иммунный или у) — крайне важная противовирусная и регуляторная молекула, возможно, главный компонент МАФ. Лимфотоксин, возможно, важен в киллинге некоторых опухолевых клеток (рис 30). Фактор роста В-лимфоцнтов (рис. 18). КСФ — колониестимулирующий фактор. Стимулирует дифференциацию моноцитов и, возможно, секрецию ИЛ-1. Гранулёма. Не подвергающиеся перевариванию материалы (например, туберкулёзная палочка, клеточные стенки стрептококка, тальк) могут быть изолированы плотными скоплениями макрофагов. Там же часто содержатся Т-лимфоциты, эозинофилы (ЭО) и гигантские клетки, образованные слиянием нескольких макрофагов. О роли гранулём при хронических воспалениях см. рис. 35. Память. Все Т-лимфоциты, вовлечённые в клеточный иммунитет, способны формировать клетки памяти, обеспечивая тем самым возможность иммунного ответа по вторичному типу (более эффективный и ускоренный ответ). В иммунных реакциях, где эффекторные функции выполняют макрофаги, память создаётся исключительно Т-хелперами. ГЗТ — гиперчувствительность замедленного типа. Впервые этот тип реагирования описал Р. Кох в 1891 г. При подкожном введении туберкулина больным туберкулёзом на следующий день или позже в месте инъекции наблюдались покраснение и отёк. При наличии у больных антител соответствующая реакция развивается через несколько часов. Соответственно появились термины «гиперчувствительность замедленного типа» и «гиперчувствительность немедленного типа». ГЗТ зависит от Т-клеток памяти и реализуется в месте инъекции антигена, сопровождаясь повышенной сосудистой проницаемостью (справа внизу), Таким образом, ГЗТ является моделью нормального клеточного иммунитета, а также удобным тестом на Т-клетки памяти. 21. ТОЛЕРАНТНОСТЬ
Эволюция распознающих механизмов, вызывающих уничтожение чужеродного материала, могла происходить только одновременно с совершенствованием механизмов, защищающих от повреждения «своих» тканей. Факторы естественной защиты, такие, как фагоцитоз, лизоцим, С-реактивный белок, активированный по альтернативному пути комплемент и т.д., нормально активны лишь против ограниченного спектра субстанций, включая микроорганизмы и «свои» уже повреждённые ткани. Механизмы адаптивного иммунитета, т.е. Т- и В-лимфоциты с их огромным набором рецепторов, явно нуждаются в ограничении активности тех рецепторов, которые способны распознавать «своё». Такая агрессивность не может быть обеспечена на генетическом уровне, так как «свои» молекулы и рецепторы, способные их распознать, наследуются совершенно отдельно. Например, у носителей группы крови А вырабатываются анти-В-антитела, и наоборот. Таким образом, АВ-ребёнок от А-отца и В-матери наследует способность продуцировать анти-А- и анти-В-антитела, но для нормальной жизнедеятельности не должен производить ни одно из них, т.е. быть толерантным к А- и В-антигенам эритроцитов. В иммунной системе аутореактивность (т.е. реактивность против «своего») сдерживается на нескольких уровнях. В левой части рисунка представлены три основных типа адаптивного ответа (рис. 18 и 20), в центре — механизмы, сдерживающие аутореактивность. Кроме клональной элиминации аутореактив-ных клонов, всегда считавшейся основной причиной неотвечаемости иммунной системы на «свои» ткани, обнаружено множество других регулирующих механизмов, нарушение любого из которых может привести к аутоиммунному ответу (рис. 36), В определённых условиях (справа на рисунке) сдерживающие механизмы могут быть запущены нормальным антигенным «не своим» материалом. Иммунная система воспринимает эти вещества как «свои» и не отвечает на них — состояние, названное толерантностью. Это может оказаться полезным при пересадке органов, но может привести к очень тяжёлым последствиям при некоторых инфекциях. Толерантность подразумевает специфичность по отношению к тому антигену, который её вызвал, и в корне отличается от неспецифической неотвечаемости, вызванной поражением иммунной системы в целом (рис. 38). В литературе толерантность часто ставят в прямую зависимость от клональной элиминации. К сожалению, в большинстве случаев клональная элиминация слишком труднодоказуема, чтобы говорить об этом с уверенностью. Дата добавления: 2014-12-12 | Просмотры: 2051 | Нарушение авторских прав |