|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
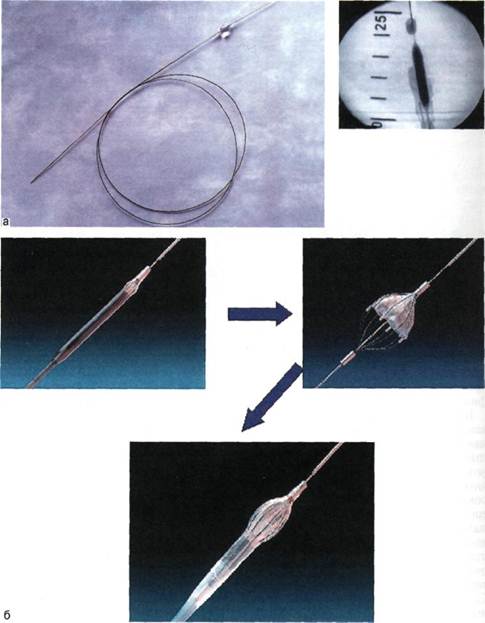
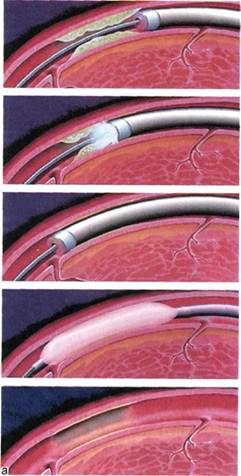
Транслюминальная баллонная ангиопластикаПервое чрескожное транслюмина-льное вмешательство на периферических сосудах, пораженных атеросклерозом, было выполнено Ч.Дот-тером 16.01.1964 г. с помощью коаксиальных тефлоновых катетеров. Однако лишь после того как А.Грюнтциг в 1973 г. сконструировал баллонный катетер, чрескожная транслюминальная баллонная ангиопластика (ЧТЛБАП) стала стремительно развиваться и получила широкое распространение. Баллонная дилатация основана на оригинальной концепции Грюнтцига, заключающейся в использовании баллона, смонтированного на двухкана-льном катетере. Один канал позволяет перемещать баллонный катетер по проводнику и вводить контрастное вещество, а через второй можно раздувать баллон до необходимого диаметра. Современные баллонные катетеры обычно изготавливают из полиэтилена, полиэтилена-тетрафталата или полиуретановых и нейлоновых составов, которые в зависимости от материала и диаметра позволяют достигать давления в баллоне от 5 до 20 атм. Разнообразные формы и профили баллонов допускают безопасную дилатацию сосудов, начиная от большого диаметра (аорта) до очень малого калибра (коронарные артерии и артерии голени) (рис. 4.1). Рекомендуемая продолжительность раздувания баллона может составлять от 20 с до нескольких минут. Обычная экспозиция — 20—60 с. При очень стойких стенозах более длительное (свыше нескольких минут) раздувание баллона может быть эффективным, но должно применяться только при наличии достаточного коллатерального кровотока дистальнее закрывающего просвет сосуда баллона. В соответствии с локализацией поражения выбирают антеградную или ретроградную катетеризацию артерии. Всегда используют гемо-статический интродьюсер для облегчения замены катетера, защиты артериальной стенки от повреждения недостаточно спавшимся баллоном и для контрольных инъекций контрастного вещества. После предварительной контрольной ангиографии через участок стеноза или обструкции под флюороскопи-ческим контролем вводят проводник, а затем и сам баллонный катетер. Размер баллона выбирают в соответствии с оценкой первоначального размера просвета сосуда. Раздувание баллона всегда контролируют флюороскопически, и резуль-
Рис. 4.1. Баллоны для ангиопластики, шприц-манометр, интродьюсер, проводники, катетеры. таты вмешательства проверяют ан-гиографически после опорожнения баллона. Патоморфологический меха- низм, на котором основано выполнение ЧТЛБАП, может быть описан как «контролируемое травматическое повреждение», состоящее наряду с ее растяжением главным образом в разрыве интимы и медии артериальной стенки. Это приводит к увеличению просвета сосуда. Затем следует процесс заживления, приводящий к формированию гладкой внутренней поверхности артерии. В начале процедуры внутривенно вводят 5000 ЕД гепарина. Дополнительное лечение для предотвращения острой или отсроченной тром-ботической окклюзии и/или ресте-ноза включает в себя ингибирова- ние агрегации тромбоцитов антиаг-регантами (аспирин, трентал), ан-тикоагулянтную терапию (гепарин), снятие спазма, индуцированного манипуляциями катетером с помощью вазодилататоров. Обычно во время процедуры внутриартериаль-но вводят 5000 ЕД гепарина. После успешной реваскуляризации в не-осложненных случаях применяют антиагреганты. Гепаринизация в течение 3 сут с последующим перора-льным приемом варфарина рекомендуется после реканализации полных окклюзии или для пациентов с повышенным риском периферической эмболизации. У пациентов с недостаточным кровотоком после стентирования также показана пероральная антикоагуляция. Другие способы профилактики тромбоза и его рецидивов как до, Таблица 4.1. Сравнительный анализ отдаленных результатов оперативного и эндоваскулярного способов лечения стенозов внутрених сонных артерий (п=273)
так и после лечения состоят из комбинации антиагрегантов и ди-пиридамола. Для прохождения через неровные участки стенозов или окклюзии существуют проводники различной формы и разными способами управления. Для прохождения через участок полной окклюзии лучше всего подходит управляемый витой проводник с легким изгибом на дистальном конце диаметром 0,035", который выступает из кончика ангиографического катетера калибра 4 или 5F. В последнее время стали популярными гидрофильные проводники. Баллонная дилатация и стентиро-вание сонных артерий — одно из наиболее перспективных и сложных направлений в интервенционной радиологии. Показаниями к ангиопластике и стентированию сонных артерий являются транзи-торные ишемические атаки, синко-пальные состояния в анамнезе, а также выявленные асимптомные стенозы, суживающие просвет артерии более чем на 60 % и характер атеросклеротической бляшки. Сдерживающим фактором является высокий риск интраоперационной эмболии сосудов головного мозга. Однако с изобретением специальных окклюзионных баллонов и фильтров, располагаемых дистальнее места операции, частоту интраопе-рационных эмболии удалось значительно снизить (рис. 4.2). По данным K.Mathias и соавт. (1999), проанализировавших ранние результа- ты баллонной ангиопластики и стентирования у 632 пациентов, частота осложнений (транзиторные ишемические атаки, малые и большие инсульты) составляет около 6 %, а летальность не превышает 1 %. W.D.Jordan и соавт. провели сравнительный анализ отдаленных результатов оперативного и эндоваскулярного лечения у 273 пациентов со стенозами внутренних сонных артерий (табл. 4.1). По данным различных авторов, 5-летняя проходимость стентиро-ванного сегмента ВСА составляет около 80 %. Показания для аортоподвздошной и бедренной ангиопластики варьируют от Пб до IV степени ишемии конечности. Идеальным типом поражения, при котором показана ангиопластика, является короткий концентрический стеноз. Эксцентрические протяженные стенозы менее пригодны. Подвздошные и бедренные окклюзии артерий длиннее 10 см на сегодня не считаются противопоказаниями. Поражения артерий голени также стали доступными для вмешательств с помощью современных низкопрофильных баллонных катетеров. Непосредственный успех ангиопластики в аортоподвздошной и бедренно-подколенной области высок и, по данным разных авторов, составляет 95 и 87 % [32]. Сохранение проходимости сосуда после 5 лет наблюдения составляет соответственно 80—90 и 60—70 % [29, 43]. Частота осложнений —
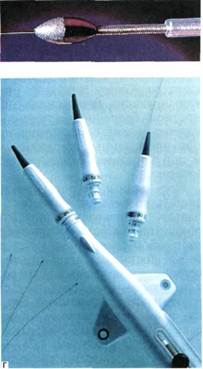
Рис. 4.2. Система защиты головного мозга при операциях на брахиоцефальных артериях. а — окклюзионный баллон; б — фильтр «Angioguard» фирмы «Cordis». около 5 %, но только в 1 % случаев требуется хирургическое вмешательство. Гематомы и периферические эмболии являются наиболее частыми осложнениями. Последние можно лечить с помощью ас-пирационной тромбэктомии или фибринолиза. Стеноз подключичной артерии может быть успешно устранен более чем в 90 % случаев [37]. Поражения сонных и позвоночных артерий также все чаще устраняют с помощью чрескожной транслюмина-льной баллонной ангиопластики. Основной и наиболее распространенной методикой чрескожной реваскуляризации брюшной аорты, тазовых и периферических артерий является чрескожная транслюмина-льная баллонная ангиопластика (ЧТЛБАП), при которой баллонные катетеры проводят за участок стеноза и сквозь окклюзии с помощью проводников. Помимо этого, разрабатывают другие механические приспособления для реканализа-ции, такие как вращающиеся или пульсирующие проводники и катетеры, атерэктомические устройства и аспирационные катетеры. Более того, часто для реканализации тромбоэмболических окклюзии используют тромболизис урокиназой или, реже, рекомбинантным тканевым активатором плазминогена (rtРА). Все эти методы обычно применяют в комбинации с баллонной ангиопластикой. Другие новые разработки — это лазерная ангиопластика для удаления атеросклероти-ческих бляшек или эндоваскуляр-ные стенты для лечения повторных или остаточных стенозов и осложнений после ЧТЛБАП или хирургического лечения. Лазерная реканализация. Это способ использования лазерной энергии для удаления атероматоз-ного материала, главным образом путем его испарения из-за высокой локальной температуры. Наиболее распространенные лазерные систе- мы — аргоновый лазер, лазер на парах, меди- и эксимерный ксеноно-вый лазер. Применяют разнообразные системы проведения лазерной энергии к цели — волоконную оптику, металлические наконечники («горячий наконечник»), сапфировые наконечники и баллоны («горячий баллон») (рис. 4.3, а). Основная проблема применения лазерной техники заключается в опасности перфораций, ограниченном диаметре реканализованного просвета и высокой стоимости лазерных систем и катетеров. Поскольку большинство окклюзии может быть ре-канализовано с помощью более дешевых устройств и отдаленные результаты лазерной ангиопластики не лучше результатов баллонной ангиопластики, эта методика пока имеет ограниченное применение. Ротационная и атерэктомическая реканализация. Для хронических окклюзии артерий, которые не могут быть реканализованы с помощью традиционных проводников, разработаны различные вращающиеся устройства. К наиболее известным можно отнести атерэкто-мический катетер Симпсона, ате-рэктомическое устройство Kensey, атерэктомический катетер ротобла-тор. Катетер Симпсона (рис. 4.3, б) является первым атерэктомическим устройством и представляет собой эластичный катетер, имеющий режущий элемент в виде циркулярного вращающегося ножа с частотой вращения 2000 об/мин, который располагается внутри металлического футляра с боковым окном в 15—20 мм длиной. На противоположной от окна стороне катетера располагается баллончик, который в момент атерэктомии раздувается и прижимает режущий нож к атеро-склеротическим массам. По мнению многих авторов, показаниями для выполнения атерэктомии катетером Симпсона являются короткие, дискретные, экс-
Рис. 4.3. Устройства для реканализа-ции окклюзированных сегментов артериального русла. а — устройство для лазерной реканализа-ции; б — устройство Симпсона. центричные бляшки. Предпочтительным считается применение этого метода при наличии критических стенозов. При окклюзиях может возникнуть перфорация стенки сосуда. Имеются данные об удачном применении катетера Симпсона при гиперплазиях интимы и при устранении изъязвленных бляшек. Определенные сложности для данного устройства представляют каль-цифицированные бляшки, так как
они оказывают большое сопротивление вращающемуся ножу катетера. При наличии кальцифициро-
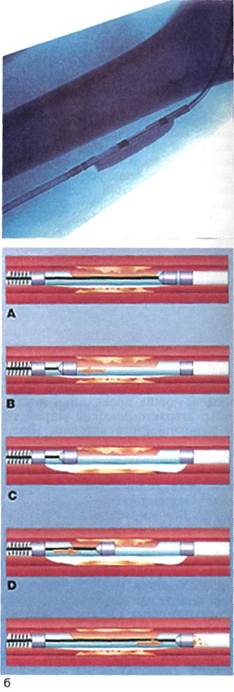
ванных бляшек атерэктомию Симп-сона используют как метод, предшествующий ЧТЛБАП с целью разрушения бляшки. Применение этого метода при продолженных ок-клюзиях не дает хороших результатов как в ближайшие, так и в отдаленные сроки из-за большого количества рестенозов и реокклюзий. Метод, предложенный K.Kensey и соавт., устраняет ряд недостатков катетера Симпсона.
Рис. 4.3. Продолжение. в — устройство механической река-нализации; г — ротоблатор; д — аппарат «Ангиоджет». Атерэктомическое устройство K.Kensey, известное как система Trac-Wrigt, является эластичным катетером с дисталь-ным кулачком, соединенным с центральным (приводящим в движение) штифтом (рис. 4.3, в). Кулачок вращается со скоростью 100 000 об/мин и движется в направлении наименьшего сопротивления. Система орошения, через которую под большим давлением подается жидкость, расширяет сосуд, в то время как кулачок распыляет ате-росклеротические массы. Этот вид катетера действует за счет высокой скорости вращения кулачка и фактически распыляет бляшку. Катетер может быть проведен чрескожно или через артериотомию в общей бедрен- ной артерии с помощью интродью-сера размером 9 F. После реканали-зации окклюзии проводят стандартную баллонную ангиопластику для дилатации резидуальных стенозов. По общему мнению, применение катетера Kensey показано при ок-клюзирующих поражениях поверхностной бедренной артерии. Этот катетер может быть применен как при протяженных поражениях, так и при коротких, сегментарных ок-клюзиях. Еще одним методом механической атерэктомии является рото-блатор (производства фирмы «Bio-physic International»). Оно представляет собой эластичный катетер, который доставляет атерэктомическое устройство различных размеров. На конце этого устройства имеется шаровидный металлический бур, усыпанный множеством алмазных осколков размером 22—45 мкм (рис. 4.3, г). Буры диаметром 1,25—6,0 мм выбирают в зависимости от диаметра сосуда, на котором предполагают вмешательство. Сначала применяют небольшой по диаметру бур, который позднее меняют на буры с большим диаметром для увеличения просвета сосуда. Бур вращается со скоростью 100 000-200 000 об/мин и двигается вдоль проводника, который должен быть проведен через пораженный сегмент до выполнения атерэктомии. Высокая скорость вращения позволяет алмазным микролезвиям воздействовать на сильно кальцифицированные бляшки в артерии и распылять их. При этом эластичные ткани в нормальном участке остаются интактными. Распыленные фрагменты по размеру меньше, чем эритроциты, и проходят через звенья микроциркуляции. Касаясь техники применения методики ротоблатор, следует отметить, что она является более травматичной по сравнению с другими методами, так как требует проведения в артерию интродьюсера большого диаметра (9—14 F) или артериотомии. К преимуществам устройства ротоблатор можно отнести возможность устранения кальцинированных поражений артериальных сегментов, большую безопасность выполнения, так как используется направляющий проводник, что гарантирует от перфорации артериальной стенки. Недостатками метода являются невозможность проведения бура и предварительного проводника через окклюзии при наличии труднопроходимых стенозов, большая травма-тизация стенки сосуда при проведении устройства к месту окклюзии в связи с большими диаметрами буров. Необходимость многократной смены буров и проводников резко замедляет проведение операции, что также ухудшает результаты оперативных вмешательств. Одним из принципиально новых направлений в эндоваскулярном лечении больных с поражениями артериальной системы является вибромеханическая ангиопластика при окклюзирующих заболеваниях сосудов. Эта методика разработана Н.А.Чигогидзе в Научном центре сердечно-сосудистой хирургии им. А.Н.Бакулева РАМН и является приоритетной в мировой практике. Она обладает рядом преимуществ, к которым можно отнести малую травматичность и безопасность, простоту выполнения и экономичность, высокую эффективность при реканализации значительных по протяжению окклюзии, возможность ее применения одновременно в различных сегментах сосудистого русла. Тромболизис. Чрескожный внут-риартериальный тромболизис применяют для реканализации тромбо-тических окклюзии. Тромболитик может быть введен через катетер или перфузионный проводник, помещенные проксимальнее окклюзии (региональный фибринолиз). Фибринолитический препарат следует вводить непосредственно в тромботическую массу (локальный тромболизис), уменьшая количество препаратов, необходимых для реканализации. Наиболее широко используемый сегодня тромболи-тик — урокиназа. Для регионального фибринолиза обычная доза составляет 50 000-100 000 ЕД уроки-назы в час. При локальном фибри-нолизе типичные дозировки — от 5000 до 20 000 ЕД на 1 см окклюзии, в зависимости от давности и степени организации тромба. Другой (значительно более дорогой) препарат, используемый в настоящий момент, — это рекомбинант-ный тканевый активатор плазмино-гена (rtPA). Однако до сих пор не доказаны преимущества его использования при периферических ок-клюзиях. Обычно при локальном фибринолизе ангиографиче-ский катетер калибра 5F погружают на 3—4 см в сгусток и вводят по 5000-10 000 ЕД урокиназы. Под флюороскопическим контролем катетер медленно продвигают в зону окклюзии. Для предотвращения ди-стальной эмболии тромб не должен быть пройден до того, как будет растворена большая часть проксимального сгустка. Комбинируя этот метод с ЧАТ, можно значительно ускорить процедуру и сократить дозу урокиназы. Недавно был введен в практику так называемый пункционно-раз-брызгивающий метод. При этой методике применяют катетер с множественными боковыми отверстиями для рассеивания небольших объемов высококонцентрированного фибринолитика в окклюзиро-ванный сегмент длиной 5—10 см. Последующая разработка — это микропористый баллонный катетер, на котором баллон перфорирован многочисленными отверстиями микроскопического размера. Баллон раздувают под относительно низким давлением в 1—2 атм смесью фибринолитика и физиологического раствора. Просачивание многочисленных маленьких струек высококонцентрированной урокиназы или rtPA под давлением происходит непосредственно в сгусток. Сгусток инфильтрируется и раздавливается между стенками баллона и артерии одновременно. Этот метод существенно ускоряет литический процесс. Он стал особенно эффективен для старых сгустков и/или хронической окклюзии с мягким неорганизованным тромбом. Кроме того, этот метод может быть успешно комбинирован с ЧАТ и традиционной ЧТЛБАП. Стандартный локальный фибри-нолиз в бедренно-подколенной области успешен более чем в 80 % случаев. Наилучшие результаты достигаются, если возраст тромба меньше 3 мес и сквозь него легко проходит проводник. Осложнения при региональном фибринолизе составляют около 10—15 %, тогда как при локальном фибринолизе они сокращаются приблизительно до 6 %. Главные осложнения заключаются в образовании гематом и в ди-стальной эмболизации. Геморрагии редко наблюдаются при локальном фибринолизе, если не превышается дозировка урокиназы 400 000— 500 000 ЕД. Локальный фибринолиз также успешно применяют для реканализации подвздошных окклюзии и при тромбозе гемодиализных шунтов. Чрескожная транслюминальная аспирационная тромбэктомия. До последнего времени оставалась нерешенной задача разработки эффективных способов чрескожной тромбэктомии при острых и под-острых тромбозах. В арсенале рент-генохирургических методов подхода к этой проблеме до недавних пор оставалась только селективная тромболитическая терапия. Существенные недостатки данного метода — ограничение эффективности по мере увеличения давности тромбоза, неуправляемость, а также воз- можность местных и общих геморрагических осложнений. Полноценной рентгенхирурги-ческой альтернативой открытой тромбэктомии призвана стать чрес-кожная аспирационная тромб-эктомия. Для реализации этой идеи предложено много устройств, однако только несколько из них имеют значение для клинического использования — Amplatz thrombectomy device и Trerotola device, использующие механический ротационный принцип, редко используемые при артериальной патологии, и системы Hydrolyser и Angiojet, основанные на гидродинамическом эффекте. Именно последние два прибора позволяют эффективно вмешиваться на различных участках сосудистого русла, включая артерии. Первые результаты использования данных приборов дали весьма обнадеживающие результаты. По техническим характеристикам более перспективным представляется использование прибора Angiojet (см. рис. 4.3, д). Система Angiojet состоит из трех основных частей. Мобильный блок управления с микропроцессорным контролем и сенсорной детекцией всех компонентов системы обеспечивает переключение на отдельные режимы работы (коронарный, периферический, нейроваскулярный), индикацию рабочего давления и введенного объема жидкости. Специальная помпа обеспечивает подачу гепаринизированного физиологического раствора в катетер и удаление смеси раствора (около 50 %) и крови с детритом тромбов из катетера в пластиковую градуированную емкость. Раствор подается в катетер со скоростью 50— 60 мл/мин. Третья часть комплекса — катетер, непосредственно вводимый в область тромбоза на проводнике 0,014"—0,018" или без него. Катетер для периферического применения имеет диаметр рабочей части 5F и через отверстия на вер- хушке обеспечивает как сонаправ-ленные с длинной осью катетера струи, так и радиальные струи для разрушения тромбов в крупных сосудах. На входе в катетер давление достигает значений приблизительно 9000 Па (600 амт), на выходе из катетера — 2500 Па (170 атм). В окружности катетера в соответствии с эффектом Бернулли создается зона низкого давления, что обеспечивает всасывание жидкости и разрушенных частиц во второй просвет катетера. При тромботических и подо-стрых окклюзиях ЧАТ может комбинироваться с локальным тромбо-лизисом. ЧТЛБАП производят в тех местах, где обнаружены дополнительные стенозы. Комбинация локального тромболизиса и аспираци-онной тромбэктомии значительно сокращает количество вводимых фибринолитиков и ускоряет процедуру- Внутриартериальное стентирова-ние. Содружественные усилия хирургов, рентгенохирургов и инженеров, направленные на преодоление проблемы недолговечности лечебного эффекта ЧТЛБАП из-за эластической упругости стенки, рубцевания интимы, остающихся бляшек и развития рестенозов привели к созданию нового класса эн-допротезов — стентов, имплантируемых в сосуды для поддержания их просвета. Первые стенты были предложены Ch.Dotter в 1964 г., но не получили широкого признания из-за малого окончательного диаметра — 2—3 мм. Баллонорасширя-емые стенты, разработанные Palmaz и Strecker, и самораскрывающийся Wallstent чаще всего используют при вмешательствах на артериях (рис. 4.4). Эти стенты представляют собой тонкую сетку из металлических нитей или тонкостенную трубочку из нержавеющей стали с зигзагообразно расположеными прямоугольными пазами в случае стен-та Palmaz.
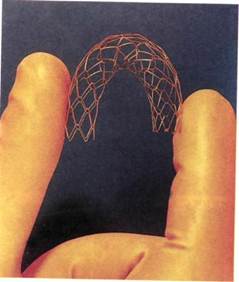
Рис. 4.4. Типы стентов. В нашей стране начало разработки и клинического применения стентов из нитинола было положено работами И.Х.Рабкина и соавт. (1985—1987). Однако предложенная конструкция — спираль не обеспечивала решения клинических задач — расширения и поддержания просвета артерий. Стент, предложенный В.К.Рыжковым и соавт., также с использованием нитинола, был более эффективен, поскольку в его конструкции использована идея ромбовидной ячейки как элемента стента. Однако, как отмечали и сами авторы, поперечная упругость стента была недостаточной. Более поздние работы З.А.Кавтеладзе и соавт. (1995—1998) показали, что, используя принцип переплетения проволоки, можно создавать прочную цилиндрическую конструкцию сосудистого эндопротеза. Фирмой «КОМЕД» (Россия) был предложен саморасширяющийся стент, конструкция которого была разработана на основе описанных выше прототипов. Стент изготовлен из нитино-ловой проволоки в виде сетчатого плетеного цилиндра, поверхность которого образована ячейками ромбической формы (рис. 4.5). Смонтированные на баллонном катетере или специальном приспособлении для введения стенты могут быть освобождены в желаемом месте сосудистого русла. Расширенные металлические стенты достаточно прочны для того, чтобы выдержать противодействие артериальной стенки и сохранить просвет сосуда хорошо проходимым. Отдаленные наблюдения за больными после вмешательств на подвздош-
Рис. 4.5. Стент «Алекс» фирмы «КО-МЕД» (Россия). ных артериях показали прекрасные результаты с проходимостью более чем в 90 % случаев после 5 лет. Стенты особенно ценны при лече- нии сложных подвздошных стенозов и окклюзии (рис. 4.6). В бед-ренно-подколенной области гиперплазия интимы на участке стенти-рованной артерии все еще является нерешенной проблемой и приводит к повторной обструкции в 40—60 % случаев. Чем более дистально имплантируются стенты, тем соответственно меньше диаметр сосуда и больше возможность развития инти-мальной гиперплазии (рис. 4.7). Это осложнение еще более вероятно в случае недостаточного диста-льного оттока. Поэтому следует отбирать пациентов для бедренно-подколенного стентирования с очень большой осторожностью. В первую очередь у таких больных должны быть рассмотрены другие методы, такие как повторная баллонная ангиопластика. Показания к стентированию сосудистого русла в настоящее время определяются в ходе рентгеноэндо-васкулярного вмешательства на сте-нозированном сегменте артерии. Безусловными показаниями к стентированию являются разрывы или
Рис. 4.6. Стентирование подвздошных артерий. 484 отслойка интимы, которые могут возникнуть в результате дилатаци-онного воздействия баллона. Участок артерии с резидуальным стенозом также подлежит стентирова-нию. При реканализации окклюзи-рованного сегмента артерии, особенно если в этом месте обнаружена бляшка, которая стала причиной тромбоза, также необходимо стен-тирование. В случае протяженных стенозов артерий более 40 мм также показано стентирование. На протяженных и извитых участках сосудистого русла целесообразно применять самораскрывающиеся стенты, длина которых может достигать 80—100 мм. Более короткие матричные, баллон-но-расширяемые стенты эффективнее на коротких участках артерий, — там, где имеется ригидный стеноз и велика опасность возникновения резидуального стеноза сосуда. Методика имплантации стентов различается в зависимости от ее конструкции. Матричные стальные баллонно-расширяемые стенты укреплены на дилатационном баллоне в виде узкой перфорированной трубки, которая в момент дила-тации усилием стенок баллона раскрывается на требуемый диаметр, внедряясь ячейками в интиму сосуда. После опорожнения баллон удаляют из сосудистого русла. Жесткость конструкции стента хорошо обеспечивает его устойчивость к внешнему сдавлению, эластическому сжатию просвета артерии. Это же свойство является недостатком баллонно-расширяемого стента. Стенты этих конструкций могут быть проведены только на прямых участках. При этом длина стента, как правило, не превышает 55— 58 мм в сложенном виде. Самораскрывающиеся стенты имплантируют в сосудистое русло через специальные доставляющие устройства, в которых они плотно
Рис. 4.7. Гиперплазия интимы в стен-тированном участке артерии. уложены. После освобождения от внешнего чехла доставляющего устройства стент благодаря собственной упругости раскрывается, упираясь ячейками в стенки сосуда. При этом всегда требуется дополнительная дилатация стенти-рованного участка для более глубокого внедрения нитей стента в интиму. Самораскрывающиеся стенты более гибки, поэтому они могут быть длиной до 80 мм и более. Кроме того, допустима контралате-ральная имплантация подобных стентов. Наиболее широкое распространение получили операции стентиро-вания периферических артерий, в частности подвздошных, бедренных и подколенных. В связи с этим очень важно оценивать отдаленые результаты ангиопластики и стен-тирования по тяжести и распространенности атеросклеротических поражений, по локализации имп-
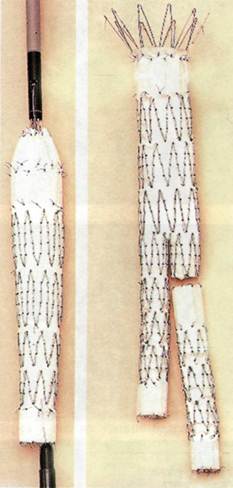
Рис. 4.8. Стенты-графты. лантированных стентов. По данным J.Reekers (1997), через 5 лет после ангиопластики подвздошных артерий остаются проходимыми 63— 65 %, тогда как ангиопластика со стентированием при той же локализации дает более устойчивый положительный эффект. Подвздошные артерии продолжают функционировать через 6 лет у 92 % больных. По данным M.Henry и соавт. (1999), через 1 год на уровне бедра функционировали 96 % стентированных артерий, на 2, 3 и 4-й годы наблюдения — 95 %. При стентировании подколенных артерий через 1 год функционировали 90 %, на 2-й и 3-й годы — 80 %, а через 4 года — 69 %. Авторы замечают, что первичный успех ангиопластики и стентирования подвздошных и бед-ренных артерий значительно отличается — 86 и 65 % соответственно, а на отдаленных сроках наблюдения результаты выравниваются — 94 и 95 %. Эндопротезирование артерий. Эн-допротез — устройство для внутри-сосудистого применения, состоящее из стента, покрытого пленкой или тканью, которая обеспечивает изоляцию сосудистой стенки под протезом от просвета сосуда. В зарубежной литературе такие устрой- ства называют покрытые стенты, или графты (рис. 4.8). Впервые идея применения эн-допротезов для лечения аневризм и артериовенозных фистул была сформулирована Ch.Dotter в 1969 г. В том же году R.Ersek изобрел стент с покрытием. Тем не менее в течение длительного времени этот проект находился на стадии экспериментальных исследований. В 1981 — 1983 гг. A.Balko впервые в истории произвел внутрисосудистое протезирование аневризмы аорты зигзагообразным нитиноловым стентом у животного. Через год S.Taheri изобрел стент с клеевым покрытием. 1984 г. ознаменовался появлением зигзагообразного стального стента с дакроновым покрытием. Н.Володось впервые в мире имплантировал такое устройство в клинике в 1986 г. С 1990 г. началось широкое применение эндопротезов. Множество клиник вели исследования в этом направлении, и в скором времени появились работы об использовании данной методики при аневризмах грудной аорты, в экстренных операциях при разрывах аневризм как брюшной, так и грудной локализаций, при диссек-циях аневризм нисходящей грудной аорты, в сочетании со стандартны-
ми реконструктивными операциями (резекция аневризмы брюшной аорты с протезированием + эндо-протезирование аневризмы грудной аорты; проксимальный анастомоз с использованием стента, а дисталь-ный — хирургическим путем в бок бедренной артерии). В настоящее время эндопротезированию подвергаются все отделы аорты (имеются единые эндопротезы для дуги аорты с ветвями, грудной и брюшной аорты с ветвями), продолжаются процесс усовершенствования методик имплантации эндопротезов и разработка новых материалов для них (рис. 4.9). Эндопротез состоит из тонкостенного синтетического протеза, который вводят в одном месте сосудистого русла и фиксируют с помощью стента в другом. Одна из первых моделей эндопротезов состояла из дакронового протеза и матричного стента Palmaz, расширяемого баллоном. Первое время хирург самостоятельно перед проведением операции фиксировал стент к протезу с помощью монофиламентной нити, причем использовались эндопротезы как с одним фиксирующим стентом в проксимальном отделе, так и с двумя — в проксимальном и дистальном отделах. Однако дальнейшие испытания показали, что применение первого варианта сопровождается большим количеством осложнений. В настоящее время используют и матричные, и саморасширяющиеся стен-ты, появились фабричные эндопротезы — дакроновые, политетра-фторэтиленовые: Min Tec, EVT, Chuter, Talent и др. Эндопротез пакуется в интродьюсер диаметром от 16 до 21F с гемостатическим клапаном. В настоящее время применяют как линейные, так и бифуркационные модели эндопротезов (рис. 4.10). Основные показания к имплантации эндопротезов в брюшную
Рис. 4.9. Протезирование графтом аневризмы левой общей подвздошной артерии. аорту — наличие аневризмы инфра-ренальной локализации. В основном этот метод используют у паци-
Рис. 4.10. Аортальный бифуркационный протез Talent. ентов с тяжелыми сопутствующими заболеваниями, не позволяющими выполнить традиционное хирургическое вмешательство. Концепция эндоваскулярного протезирования ставит перед хирургом ряд проблем, в частности, связанных с анатомическими особенностями. Адекватный доступ к аорте — главный залог удачного эндопротезирования. Выраженная извитость подвздошных артерий, мощный кальциноз (особенно у пациентов, находящихся на хроническом гемодиализе), сегментарные окклюзии или резкие сужения ставят под сомнение успех процедуры. Длительность удовлетворительных отдаленных результатов напрямую зависит от состояния так называемых шеек аневризмы. На этом уровне стенка сосуда должна быть «здоровой» — просвет аорты не расширен и свободен от тромботи-ческих масс. «Золотое правило» эндоваскулярного протезирования — выключение всей аневризмы из кровотока. В настоящее время доказано, что пристеночный тромбоз не дает удовлетворительного сцепления стента со стенкой сосуда. Таким образом, сохраняется сообщение с полостью аневризмы и остается угроза ее разрыва. Существует еще один ограничивающий фактор — после имплантации протеза должна сохраняться проходимость почечных и внутренних подвздошных артерий. В случае короткой проксимальной шейки возможно размещение непокрытой части стента в интеррена-льном сегменте, однако короткая шейка представляет собой угрозу дальнейшего увеличения аневризмы. Необходимость закрытия устьев обеих внутренних подвздошных артерий также является противопоказанием к эндопротези-рованию в связи с угрозой развития ишемии кишечника и органов таза. В отдельных случаях возможно выключение из кровотока второй внутренней подвздошной артерии через несколько недель. Однако лучшим выходом в таких случаях остается линейное аортоподвз-дошное эндопротезирование в сочетании с перекрестным бедрен-но-бедренным аллошунтировани-ем. Большинство авторов особое внимание обращают на проходимость верхней брыжеечной артерии; ее окклюзия является противопоказанием к эндопротези- рованию аневризмы брюшной аорты. Перед имплантацией эндопротеза производят ряд измерений: определяют длину и ширину проксимальной и дистальной шеек аневризмы, длину основной (для линейного протеза) или обеих бранш бифуркационного протеза, пользуясь при этом трехмерными изображениями, полученными с помощью спирального компьютерного томографа. Этот метод имеет ряд преимуществ перед аксиальной томографией, ангиографией и внутрисосудистым ультразвуком (невозможность получения точных размеров при двухмерной визуализации). В настоящее время общепринято, что проксимальная и дисталь-ная шейки аневризмы, т.е. неизмененные участки, должны быть не меньше 1,5 см длиной (идеально 2,5 см), что ограничивает использование линейных аорто-аорталь-ных протезов лишь для реконструкции аневризм малых размеров. Некоторые авторы применяют классификацию аневризм брюшной аорты по Allenberg в модификации Raithel (1998). • Тип 1 — Инфраренальная аневризма с адекватными проксимальным и дистальным перешейками 1а — изолированная инфраренальная аневризма 16 — инфраренальная аневризма с адекватным дистальным перешейком • Тип 2 — Адекватный проксималь- ный перешеек 2а — аневризма, распространяющаяся до бифуркации аорты 26 — аневризма с вовлечением общей подвздошной артерии 2в — аневризма, распространяющаяся до наружных подвздошных артерий, с вовлечением устьев внутренних подвздошных артерий • Тип 3 — Отсутствие адекватного проксимального перешейка Указанные авторы считают, что использование эндоваскулярного метода лечения позволительно лишь при аневризмах типа 1. P.Heilberger (1998) и соавт. считают, что только у 25—33 % пациентов с аневризмами брюшной аорты имеются показания к имплантации эндопротеза в связи с анатомическими особенностями. Для имплантации эндопротеза обычно используют артериотомиче-ское отверстие в бедренной или плечевой артериях, флюороскопи-ческий контроль. Заводят катетер выше почечных артерий и выполняют ангиографию. Устанавливают проводник в бедренную артерию и продвигают выше почечных артерий; по проводнику заводят интро-дьюсер так, что метки проксимального стента визуализируются в проксимальной шейке аневризмы. Маркируют позицию стента на экране и/или на теле пациента. При применении линейного эндопротеза удостоверяются, что длина протеза выбрана правильно и дисталь-ный стент расположен выше бифуркации аорты и ниже дистальной шейки аневризмы. При применении бифуркационной модификации необходимо удостовериться, что короткая бранша контралате-ральной бранши протеза расположена над бифуркацией и не в подвздошной артерии. Также важно повернуть интродьюсер и расположить маркер короткой бранши параллельно контралатеральной нижней конечности. При раздувании баллона, находящегося в области проксимального стента, следует помнить, что наступает кратковременная, но полная окклюзия просвета аорты. Артериальное давление может подняться, и необходимо на этот момент снизить его до 80 мм рт.ст. Медленно удаляют интродьюсер. Баллон продвигают сверху вниз и периодически раздувают для лучшего контакта со стенками (особенно для зигзагообраз-
Рис. 4.11. Имплантация аортального бифуркационного протеза. ных стентов с покрытием. Считают, что стент полностью имплантируется в стенку аневризмы, что обеспечивает плотную фиксацию, а применение покрытия не позволяет возникать проллапсу интимы. Если после раздувания сохраняется сужение, то устанавливают дополнительный стент. Нельзя оставлять сужения более 20 % — это может привести к тромбозу! Выполняют контрольную ангиографию, и при выявлении подтекания производят его коррекцию повторным раздуванием баллона. При имплантации бифуркационного эн-допротеза вторым этапом имплантируют дополнительную контрала-теральную браншу, обычно через контралатеральную бедренную артерию, хотя можно использовать плечевую или бедренную артерию, через которую уже была импланти- рована основная часть протеза. Заводят интродьюсер в короткую браншу эндопротеза, раздувают проксимальный баллон, который фиксирует проксимальный стент длинной бранши в короткой бран-ше основного протеза. Затем удаляют интродьюсер и баллон, который периодически раздувается и моделируется стенка длинной бранши эндопротеза (рис. 4.11). Выполняют ангиографию. При применении линейного аортоподвздошного эндопротеза с помощью окклюзирую-щего съемного баллона или другого окклюдера большого диаметра закрывается контралатеральная подвздошная артерия. Следующим этапом реваскуляри-зуется контралатеральная конечность путем перекрестного бедрен-но-бедренного аллошунтирования. Средние сроки госпитализации пациента 4—5 сут. Осложнения. Наиболее частые специфические осложнения делят на 2 группы: 1) связанные с недостатками имплантируемого устройства и системы для его проведения; 2) связанные с проведением или ограничением методики (табл. 4.2; 4.3). Частота перехода к открытой операции доходит до 41 %. Многие авторы отмечают, что наибольшая частота перехода к стандартным реконструкциям наблюдалась в начале применения данной методики. Первично хорошие результаты, (1996), достигаются в 84 % случаев протезирования в брюшной аор-то-аортальной позиции и в 100 % — в грудной. В случае аортоподвздошного эндопротезирования положительные результаты ниже 74 %. Отдаленные результаты — 62 % из числа всех пациентов и 80 % — в группе с первично хорошими результатами. Таблица 4.2. Осложнения, связанные с недостатками имплантируемого устройства и системы для его проведения [модифицированная таблица F.J.Veith, 1999]
Таблица 4.3. Осложнения, связанные с проведением или ограничением методики [модифицированная таблица F.J.Veith, 1998]*
Все осложнения приведены в порядке убывания их частоты. Этот тип осложнений объясняется особенностями конструкции протеза, доставляющего устройства; он встречался в 75 % наблюдений автора. Другие осложнения, связанные с анатомическими особенностями пациента или характером поражения аорты и ее ветвей, а также с проведением самой эндоваскуляр-ной операции, встречались реже — в 25 % случаев. С некоторыми осложнениями удается справиться применением эндоваскулярных методик (табл. 4.4). Следует отдельно остановиться на основной проблеме эндоваску-лярного протезирования — пери-протезном подтекании крови, результатом чего является прогресси- рование заболевания. Выделяют следующие типы по месту расположения: проксимальные и дисталь-ные (расположение стентов в области тромботических масс, неполная фиксация стента к стенкам аорты, неточное определение места раскрытия стента, поломка стента или его дефекты), негерметичные соединения «ног» бифуркационного протеза, боковая негерметичность (функционирующие поясничные, нижняя брыжеечная артерии) и негерметичность оболочки стента. По времени возникновения выделяют первичную (до 30 сут) и вторичную негерметичность. В среднем частота возникновения подобных осложнений следующая: Таблица 4.4. Способы эндоваскулярной коррекции осложнений эндоваскулярно-го протезирования брюшной аорты [модифицированная таблица F.J.Veith, 1998]
▲ линейное эндопротезирование: • первичные — 16 %; • вторичные 8,5—10 %; ▲ бифуркационное эндопротезиро • первичные — 25 %; • вторичные — 2—7 %. В настоящее время при выявлении негерметичности эндопротеза делают попытку эндоваскулярной коррекции. Небольшое подтекание с течением времени может самостоятельно прекратиться. Безуспешность эндоваскулярной тактики и увеличение размеров аневризмы на 10 % считается показанием к тради- ционному хирургическому вмешательству. Исследования показали, что при отсутствии негерметичности размеры аневризмы в среднем уменьшаются на 0,41 см в месяц (до 50 мм в год). В отдаленном периоде возможно умеренное расширение дис-тальной шейки аневризмы (0,12+ ±0,27 см) при отсутствии признаков негерметичности. Интраоперационная и ранняя послеоперационная летальность при эндоваскулярном протезировании аневризм брюшной аорты составляет, по данным различных ав-
Рис. 4.12. Лечебные эмболизации. а — при артериовенозной ангиодисплазии; б — при легочном кровотечении.
Рис. 4.12. Продолжение. в — при хемодектоме; г — при эмболизации гемангиомы печени. торов, 0,7—13,3 %. Основные причины — острая коронарная недостаточность, пневмония, почечная или полиорганная недостаточность, ишемический колит — не отличаются от таковых при традиционном оперативном вмешательстве. Перспективы развития метода. В первую очередь — совершенствование конструкции имплантируемого устройства. Это и создание цельных бифуркационных эндопро-тезов, саморасширяющихся эндо-протезов с адгезивной тканью (фибриновый клей) на поверхности, и ультратонкое покрытие стен-та, что в свою очередь позволит уменьшить диаметр интродьюсера и применение фильтров для предотвращения эмболии. Во вторую очередь — совершенствование мастерства интервенционных радиологов, расширение показаний к выполнению этой операции. Лечебная эндоваскулярная окклюзия — эмболизация. Эмболиза-ционные процедуры являются важной альтернативой хирургическому
Рис. 4.13. Эмболизационные материалы, а — спирали; б — губка; в — гидрогель. лечению при артериальных кровотечениях, аневризмах, артериове-нозных ангиодисплазиях и травматических фистулах, а также опухолях периферической сосудистой системы (рис. 4.12). Основными показаниями к проведению лечебной эндоваскулярной окклюзии являются: • лечение травматического кровотечения, особенно в области таза и конечностей; • врожденные артериовенозные дисплазии и фистулы; • кровотечение из опухолей, в особенности из мочеполового тракта; • химиоэмболизация опухолей костей (остеосаркома), первичных опухолей печени или метастазов. Методика выполнения и эмболи-зационный материал. Высококачественная (суперселективная) анги-ограмма является необходимым условием для любого типа артериальной эмболизации. Катетеры, через которые эмболизирующий материал будет вводиться, должны быть подведены к зоне поражения как можно ближе для того, чтобы сохранить непораженные артерии и ткани. Используют специально сформированные катетеры 4F и 5F с внутренним просветом в 0,035 или 0,038 дюйма (0,9; 1,0 мм). Проводники с гидрофильной оболоч- кой значительно улучшают проведение катетеров в периферические артерии. Для доступа к сосудам малого диаметра применяют катетеры калибра 2,7—3F, которые проводят коаксиально через обычные 4 и 5F ангиографические катетеры. Имеется большое количество Основными являются механические приспособления (спирали из нержавеющей стали и отсоединяющиеся баллоны), гемостатическая или желатиновая губка (Gelfoam), гидрогель и мини-спирали (рис. 4.13). Осложнения эмболизации периферических артерий обычно происходят из-за ишемии и инфаркта органа, на сосудах которого производится вмешательство. Рефлюкс эм-болизационного материала или его прохождение в венозную систему с непреднамеренной окклюзией других сосудов (с развитием периферической ишемии, легочной эмболии) является еще одним источником осложнений. При тщательном соблюдении техники выполнения вмешательства частота осложнений не превышает 0,5 %. Однако боль, отек мягких тканей и лихорадка, представляющие собой постэмбо-лизационный синдром, могут длиться от 2 до 10 сут и наблюдаются достаточно часто. 4.2. Рентгеноэндоваскулярные лечебные вмешательства на венах 4.2.1. Имплантация кава-фильтров Внутрипросветная установка кава-фильтра в нижней полой вене была разработана Mobin-Uddin и соавт. в 1967 г. и применяется чтобы защитить легочно-сосудистое русло от эмболии из полых вен и их притоков. Продолжаются дискуссии относительно показаний для этого вмешательства. Имплантация показана, если: ▲при илиокавографии или при дуплексном сканировании в просвете нижней полой вены или в подвздошных венах обнаружены флотирующие тромбы; ▲у больного с тромбозом нижней полой вены начало или продолже-
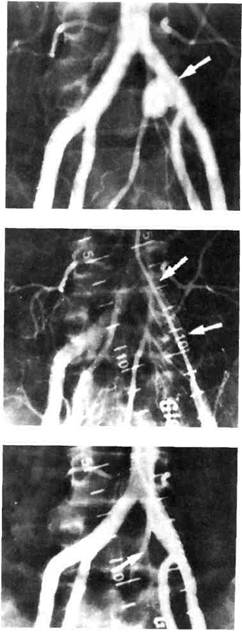
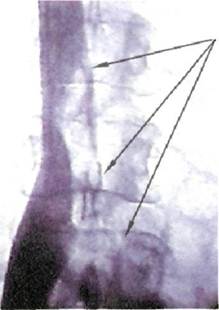
ние антикоагулянтнои терапии противопоказано; ▲антикоагулянтная терапия не предупредила повторную эмболию; ▲в случае венозного тромболизи-са, так как у 20 % больных имеется опасность эмболии в течение первых трех суток лечения. В настоящее время применяют 2 типа кава-фильтров — постоянные и временные. Постоянные фильтры имеют конструкцию, которая не позволяет удалить их из сосудистого русла. Эти конструкции выпускаются фирмами COOK, Cordis, Mansfild, КОМЕД. Постоянные ка-ва-фильтры просты в применении, надежно фиксируются к стенкам нижней полой вены, хорошо улавливают тромбоэмболы. Повторные эмболии при правильно установленных кава-фильтрах не описаны. Однако известно определенное количество осложнений, связанных с постояными кава-фильтрами. Наиболее тяжелым из них является поздний первичный тромбоз фильтра (не эмболия!), встречающийся в 15—50 % наблюдений (по данным разных авторов). К сожалению, это осложнение запрограммировано самой конструкцией фильтра. Длина любого постоянного фильтра 40—55 мм. Металлические лучи, или проволочное сплетение, выполняющие роль ловушки, значительно нарушают ламинарность кровотока в данном сегменте нижней полой вены. Это неминуемо приводит со временем к нарастанию тромботических масс на конструкции фильтра и окончательному тромбозу последнего (рис. 4.14). Логичным решением этой проблемы явилась разработка временных кава-фильтров, которые могут быть удалены из сосудистого русла через 7—15 сут после завершения тромболизиса, удаления тромба из просвета нижней полой вены. Существует несколько конструкций временных кава-фильтров — фильтр-катетер — устройство, имп- Рис. 4.14. Кава-фильтры. а — постоянный; б — временный.
Рис. 4.15. Кавография. Флотирующий тромб в нижней полой вене. лантируемое в просвет нижней полой вены через яремную или подключичную вену, и удерживаемое на катетере в течение всего срока терапии. Эти конструкции не нашли широкого применения из-за риска смещения фильтра-катетера, опасности инфицирования катетера и места пункции вены. Все большее распространение получают конструкции зонтичных временных ка-ва-фильтров, оснащенных на вершине устройствами для надежного удержания в момент имплантации и удобного захвата при удалении. Все манипуляции также проводятся эндоваскулярно, под флюороскопи-ческим контролем. Методика имплантации кава-фи-льтра. Доступ в венозное русло осуществляется, как правило, через внутреннюю яремную или подключичную вену справа. После измерения давления в легочной артерии, ангиопульмонографии и илиокаво-графии (см. выше) диагностический катетер устанавливают в про- екции устьев почечных вен и выполняют илиокавографию (рис. 4.15). Все манипуляции производят под флюороскопическим контролем. Катетеризируя и контрастируя поочередно каждую вену, уточняют их количество, уровень впадения в нижнюю полую вену, скелетото-пию. Это необходимо для правильной имплантации кава-фильтра, который должен быть распложен так, чтобы его лучи фиксировались к стенкам нижней полой вены тотчас ниже устьев почечных вен или тотчас ниже нижнего устья, а вершина фильтра находилась в потоке крови, оттекающей из почечных вен. Это позволяет защитить почечные вены от эмболии тромбами из нижних отделов нижней полой вены и предупреждает формирование тромбов на центральной части фильтра, так как эта часть постоянно омывается кровью. Для достижения этого проводящую канюлю устанавливают в нижней полой вене дистальнее устьев почечных вен. Буж с проводником удаляют. В просвет открытого крана канюли устанавливают металлическую гильзу с заранее фиксированным к захвату катетера-толкателя кава-фильтром «Зонтик». В гильзу поступальным движением вводят катетер-толкатель, который с небольшим усилием проталкивает кава-фильтр внутрь проводящей канюли. Под рентгеновским контролем с помощью катетера-толкателя кава-фильтр устанавливают на уровне дистального торца проводящей канюли. В этом положении кава-фильтр удерживают катетером-толкателем неподвижно, а канюлю медленно подтягивают вверх так, чтобы контролировать первоначальное раскрытие более длинных центрирующих, а затем более коротких фиксирующих лучей. Последние оснащены фиксаторами и обеспечивают надежное удержание фильтра в просвете нижней полой вены. На заключительном этапе имплантации нажатием на пружинную ручку катетера-толкателя освобождают кава-фильтр. Катетер-толкатель и доставляющую канюлю удаляют, выполняют контрольную кавографию (рис. 4.16). После имплантации кава-фильтра продолжают антикоагулянтную и антиагре-гантную терапию в течение 3—6 мес. Состояние нижней полой вены и ее притоков, состояние кава-фильтра и кровотока в нем контролируют периодическим ультразвуковым дуплексным сканированием [26]. Следует указать на осложнения, общие для временных и постоянных кава-фильтров. Эти осложнения включают миграцию и эмболию фильтра в легочные магистрали, перфорацию вены, структурную фрагментацию фильтра, повреждения мочеточников. К счастью, это довольно редкие осложнения, частота которых не превышает 0,5— 1 %. Более частым и также общим осложнением имплантации кава-фильтра является болевой корешковый синдром. Он развивается при имплантации неверно подобранного по диаметру фильтра, когда ножки последнего, слишком глубоко внедряясь в ткань стенки нижней полой вены, вызывают реактивное воспаление Окружающих тканей и нервных окончаний [28]. Дата добавления: 2015-02-06 | Просмотры: 2017 | Нарушение авторских прав |