|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
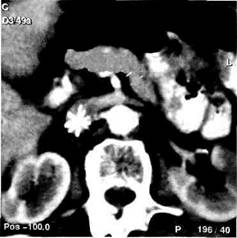
Дифференциальная диагностика. Вклинической практике приходится нередко дифференцировать ТЭЛА от различных заболеваний, вызывающих развитие синдрома острого легочного сердца в результатеВ клинической практике приходится нередко дифференцировать ТЭЛА от различных заболеваний, вызывающих развитие синдрома острого легочного сердца в результате повышения внутригрудного давления (клапанный пневмоторакс, ущемленная диафрагмальная грыжа). Окклюзия легочной артерии может возникать как осложнение при зондировании полостей сердца и легочной артерии, при сдавлении ее опухолью или кровью в случае разрыва аневризмы аорты. При этих состояниях важны учет общего клинического фона, анамнез, отсутствие периферического флебо-тромбоза. Принципы консервативной терапии. При лечении ТЭЛА врач должен руководствоваться следующими основными положениями: • устранение угрозы смерти от сердечно -легочной недостаточности в остром периоде заболевания; • нормализация перфузии легких и предотвращение в отдаленном периоде тяжелой гипертензии в малом круге кровообращения; • надежная профилактика повторных эпизодов ТЭЛА. Комплекс лечебных мероприятий для решения первой задачи включает применение средств, "разгружающих" малый крут кровообращения (эуфил-лин, дроперидол, пентамин), брон-холитических, коронаролитических препаратов, сердечных гликозидов, проведение оксигенотерапии. Основой консервативной терапии ТЭЛА является управляемая антикоагулян-тная и тромболитическая терапия. Она имеет самостоятельное значение при закупорке сегментарных и более мелких легочных сосудов. При субмассивных эмболиях наиболее эффективна эндоваскулярная тромболитическая терапия, включающая катетеризацию ветвей легочной артерии, эндоваскулярную фрагментацию тромбоэмбола катетером и подведение к эмболу больших доз тромболитиков. Для проведения антикоагулянтной терапии требуется постоянная внутривенная инфузия гепарина с управлением глубиной гипокоагуляции и поддержкой необходимого ее уровня постоянно в течение необходимого времени. Для этого вначале струйно вводят 4000—5000 ЕД гепарина в вену, затем переходят на постоянное капельное его введение в суточной дозе 25 000—30 000 ЕД, разведенных в 1000—1200 мл изотонического раствора хлорида натрия. Средняя скорость инфузии — 1000—1200 ЕД гепарина в час. При достижении благоприятного клинического эффекта и улучшении состояния на 5—7-е сутки лечения внутривенное введение гепарина целесообразно заменить дробным подкожным введением (суммарная доза 30 000 ЕД, интервалы между введениями 6 ч). Прямая антикоагулянтная терапия предотвращает нарастание вторичного тромба в легочной артерии, ликвидирует спазм легочных артериол и бронхиол, препятствует росту и распространению венозного тромбоза в венах — источниках повторных ТЭЛА. Обязательным дополнением к ге-паринотерапии, особенно в первые дни, является применение препаратов низкомолекулярных декстранов (реополиглюкин, реомакродекс) в дозе 10 мл/кг в сутки. При массивных тромбоэмболиях с целью влияния на скорость и полноту лизиса легочных эмболов решающее значение имеет использование тромболитических средств, однако их применение целесообразно лишь в течение первых суток. Тромболитические средства делят на препараты, обладающие непосредственным литическим действием (фибринолизин, аспергамин), и препараты—активаторы эндогенного фи-бринолизина (стрептаза, урокиназа). Фибринолизин вводят внутривенно медленно в суточной дозе 20 000— 40 000 ЕД, растворяя в изотоническом растворе натрия хлорида. Наиболее выраженным литическим действием при ТЭЛА обладают препараты второй группы. Положительный эффект от введения стрептокиназы отмечают в 73—79 % случаев. Урокиназу больные переносят значительно лучше, чем стрептокиназу, за счет меньшей аллергогенности. Начальная доза стрептокиназы составляет 250 000-300 000 ЕД, ее растворяют в изотоническом растворе натрия хлорида и вводят внутривенно в течение 15—30 мин. Поддерживающая доза — обычно 100 000 ЕД в течение 1—6 сут в зависимости от клинического эффекта. Инициальная доза урокиназы — 4000 ЕД/кг в течение 15—20 мин, в дальнейшем дозировка составляет 4000 ЕД/ч в течение 8— 24 ч. Однако необходимо помнить о возможности осложнений, в первую очередь кровотечений, при применении этих препаратов. Их частота при лечении фибринолитическими средствами значительно выше, чем при применении гепарина (45 и 27 % соответственно), а число выраженных кровотечений (кровопотеря более 1500 мл) достигает 27 % по сравнению с 13 % при использовании гепарина. Лечебная эффективность этого метода довольно высока. По данным В.С.Савельева (1999), в группе выживших пациентов у 14 % отмечено полное рассасывание тромбоэмбо-лов, у 74 % наступил частичный лизис с сохранением небольших остаточных перфузионных нарушений и у 12 % больных улучшения не отмечено. Среди препаратов последнего поколения, созданных для лечения ТЭЛА, необходимо отметить группу тканевых активаторов плазминогена (альтеплаза, актилизе), которые активируются, связываясь с фибрином, и способствуют переходу плазминогена в плазмин. При использовании этих препаратов фибринолиз повышается только в тромбе. Альтеплазу вводят в дозе 100 мг по схеме: болюс-ное введение 10 мг в течение 1—2 мин, затем в течение первого часа — 50 мг, в последующие 2 ч — оставшиеся 40 мг. Еще более выраженным лити-ческим действием обладает ретепла-за (retavase), которую применяют в клинической практике с конца 90-х годов. Максимальный литический эффект при применении retavase достигается в течение первых 30 мин после введения (10 ЕД + 10 ЕД внутривенно). Частота кровотечений при использовании тканевых активаторов плазминогена значимо ниже, чем при назначении препаратов группы фиб-ринолитиков, поэтому именно на них возлагают большие надежды в улучшении результатов лечения ТЭЛА. В литературе до сих пор дискутируется вопрос о возможности фрагментации венозных тромбов — источников тромбоэмболии на фоне проводимой тромболитической терапии. Это возможно, но вероятность рецидива ТЭЛА при этом не столь высока (по данным В.С.Савельева, повторная эмболизация у пациентов без наличия фильтрующих устройств отмечена в 0,8 % случаев). Показания к оперативному лечению. Показанием к экстренной эм-болэктомии является тромбоэмболия легочного ствола или главных ее ветвей при крайне тяжелой степени нарушения перфузии легких (перфу-зионный дефицит 60 %), снижении р02 до 55 мм рт.ст. и наличии резко выраженных гемодинамических расстройств — стойкой системной гипо-тензии или выраженной гипертензии малого круга кровообращения (давление в правом желудочке выше 60 мм рт.ст.). При данных показателях вероятность выздоровления больных при проведении комплексной консервативной терапии не превышает 12 %. В случае крайне тяжелой степени нарушения перфузии легких и полной уверенности в диагнозе хирург должен попытаться произвести эмболэктомию без ангиографичес-кого исследования. Это единственный шанс спасти больного с прогрессирующим падением сердечной деятельности. Редким показанием к проведению экстренного хирургического вмешательства у больных с массивной эмболией легочной артерии является парадоксальная эмболия артерий большого круга через открытое овальное окно. При тромбоэмболии главных легочных артерий с нерезко выраженными расстройствами гемодинамики показания к хирургическому вмешательству относительны. В связи с тем что опасность быстрой декомпенсации кровообращения отсутствует, у врача есть время для проведения лечебного тромболизиса. При его неэффективности операция может быть выполнена в отсроченном порядке с целью предотвращения развития тяжелой постэмболической легочной гипертензии. Противопоказания к операции. Противопоказаниями к эмболэкто-мии из легочной артерии являются тяжелые сопутствующие заболевания с неблагоприятным прогнозом — злокачественные новообразования IV стадии, выраженная недостаточность кровообращения при сердечно-сосудистых заболеваниях. В этих случаях успех операции сомнителен. Следует подчеркнуть, что пожилой возраст не является противопоказанием к хирургическому вмешательству. Относительным противопоказанием к экстренной операции считают повышение систолического давления в правом желудочке более 75 мм рт.ст., что свидетельствует о хронической окклюзии легочных вен. Типы оперативных вмешательств. Среди вариантов хирургических вмешательств можно выделить две группы операций: выполняемые с остановкой кровообращения и без нее. Эмболэктомию в условиях остановки кровообращения производят после пережатия легочного ствола (предложена Тренделенбургом и в настоящее время не используется) либо полых вен. Вторая операция — в условиях временной окклюзии полых вен — позволяет удлинить интервал безо- пасной остановки кровообращения до 2,5—3 мин. Максимально быстрое и полное обнажение сердца и крупных сосудов возможно в условиях срединной стер-нотомии, которой и отдают предпочтение при подобных операциях. Оптимальным методом хирургического лечения массивной ТЭЛА считается эмболэктомия в условиях искусственного кровообращения. При этом кровообращение в организме не прекращается, что позволяет избежать опасности развития необратимых поражений головного мозга и паренхиматозных органов. В то же время осуществляются полная декомпрессия правых отделов сердца и коррекция метаболических расстройств, обусловленных гипоксемией. Отсутствие лимита времени при этом виде хирургического вмешательства дает возможность провести наиболее полную эмболэктомию. Прямая эмболэктомия из легочной артерии в условиях искусственного кровообращения. Хирургическое вмешательство начинают с обнажения и канюляции под местной анестезией бедренных сосудов. Затем подключат АИК и на фоне вспомогательной артериальной перфузии осуществляют наркоз и стернотомию. Такая последовательность действий обусловлена высоким риском асистолии на вводном наркозе, что связано с резко выраженными гемодинамическими расстройствами. После стернотомии верхнюю полую вену канюлируют, а нижнюю полую пережимают. Эмболэктомию выполняют в условиях полного нормотермического искусственного кровообращения. Наиболее целесообразно начинать эмболэктомию с левой главной легочной артерии, которая наиболее доступна. Артериотомию производят в продольном направлении: это создает лучшую экспозицию, а также предупреждает возможность разрыва стенки артерии во время внутрисосу-дистых манипуляций. Для удаления эмболов используют окончатые зажи- мы, отсос, баллонный катетер, форсированное раздувание легких, осуществляемое анестезиологом. Удалению эмболов из периферического сосудистого русла помогает массаж легких, проводимый одним из оперирующих хирургов. Для удаления вколоченных тромбоэмболов выполняют массаж не самого легкого, а его корня. Об адекватности эмболэкто-мии судят по появлению ретроградного тока алой крови. Операция при ТЭЛА даже в условиях искусственного кровообращения всегда сопряжена со значительной смертностью, зависящей в основном от состояния больных в момент вмешательства. У большинства хирургов, которые имеют достаточный опыт в лечении данной патологии, послеоперационная летальность при массивной ТЭЛА колеблется в пределах 50 %. Но при строгом отборе больных высокий уровень смертности оправдан, если будут спасены хотя бы отдельные пациенты, — так утверждали известные американские хирурги D.Cooley и A.Beall. Эмболэктомия в условиях временной окклюзии полых вен. В тех случаях, когда отсутствуют условия для экстренного искусственного кровообращения, жизнеспасающим может быть оперативное вмешательство в условиях временной окклюзии полых вен. После выполнения стернотомии, вскрытия перикарда пережимают полые вены, что дает хирургу примерно 3 мин, в течение которых он должен удалить крупные тромбо-эмболы из главных легочных артерий. Этот срок лимитирован выраженной гипоксией при массивной ТЭЛА. Переднюю стенку легочного ствола в месте артериотомии пристеночно отжимают, в результате чего восстанавливается кровоток. Арте-риотомическое отверстие ушивают над зажимом. Такое вмешательство в некоторых случаях может быть частью сердечно-легочной реанимации, которая чаще всего бывает безуспешной до восстановления проходимое- V ти главных легочных артерий. К сожалению, летальность при таких операциях "отчаяния" превышает 80 %. Методы профилактики повторных тромбоэмболии. В настоящее время в хирургии ТЭЛА строго соблюдают принцип обязательного проведения парциальной окклюзии нижней полой вены у пациентов, которым проводят эмболэктомию. Если позволяет состояние больного, имплантацию венозного кава-фильтра выполняют до операции во время ангиографи-ческого исследования. При быстро-прогрессирующих нарушениях гемодинамики профилактическое вмешательство (имплантацию кава-фильтра через предсердие или пликацию нижней полой вены механическим швом) выполняют после завершения эмболэктомии. Наиболее эффективным средством профилактики ТЭЛА у больных с высоким риском операции является эндоваскулярное вмешательство с установкой кава-фильтров различных конструкций. Основные требования, предъявляемые к фильтрам-ловушкам: • высокая эмболоулавливающая способность; • минимальное влияние на кровоток в НПВ; • возможность надежной фиксации к стенке вены без ее перфорации; • максимальная простота и атрав-матичность в НПВ; • биологическая инертность и ат-ромбогенность. Основные показания к имплантации кава-фильтров: • эмболоопасные (флотирующие) тромбы в НПВ, подвздошных и бедренных венах, осложненные или не-осложненные ТЭЛА, когда прямое вмешательство на венах невозможно или нецелесообразно; • массивная тромбоэмболия легочной артерии; • повторные ТЭЛА, источник которых не установлен. Во многих случаях имплантация кава-фильтров более предпочтитель- на, чем оперативные вмешательства на венах: ▲ у больных пожилого и старческого возраста при тяжелых сопутствующих заболеваниях и высокой степени риска операции; ▲у больных, недавно перенесших оперативное вмешательство на органах брюшной полости, малого таза и забрюшинного пространства; ▲ при рецидиве тромбоза после тромбэктомии из илиокавального, подвздошно-бедренного сегментов; ▲у больных с гнойными процессами в брюшной полости, в забрюшин-ном пространстве; ▲при резко выраженном ожирении; ▲при беременности сроком более 3 мес; ▲при старых неокклюзивных тромбозах илеокавального, подвздошно-бедренного сегментов, осложненных ТЭЛА, когда выполнение тромбэктомии в полном объеме технически не представляется возможным; • у больных с травмами опорно-двигательного аппарата, подлежащих длительной иммобилизации; • при наличии осложнений со стороны ранее установленного кава-фильтра (слабая фиксация, угроза миграции, неправильный выбор размера). В большинстве случаев основным методом диагностики, определяющим показания к тому или иному виду эндоваскулярного лечения, в том числе и имплантации кава-фильтров, является экстренное ангиографичес-кое исследование. При острых тромбозах системы НПВ оно включает ретроградную нижнюю илеокавогра-фию, а при осложнении тромбоза ТЭЛА — прямое зондирование правых отделов сердца и ангиопульмоногра-фию. Исходя из данных флебографи-ческого исследования, производят расчет ширины контрастируемого сосуда в исследуемой проекции (методика компьютерной оценки ангио-грамм) для правильного выбора диаметра кава-фильтра. В связи с тем
Рис. 11.45. Компьютерная томограмма. В просвете НПВ определяется кава-фильтр "песочные часы". что НПВ в поперечном сечении обычно имеет форму овала, а после имплантации кава-фильтра приобретает округлую форму, то измерение ширины сосуда в прямой и боковой проекции позволяет оценить диаметр предполагаемой окружности по формуле: d3 = d1 • d2, где d3 — предполагаемый диаметр НПВ после установки фильтра; d1 и d2 — ширина НПВ в прямой и боковой проекции (рис. 11.45). Ценная информация о состоянии магистральных вен может быть получена с помощью ультразвуковых методов исследования. Использование датчиков с высокой частотой эхосиг-нала и опцией цветового допплеров-ского картирования (ЦДК) позволяет детально исследовать глубокую и поверхностную венозные системы нижних конечностей и оценить характер кровотока. При применении режима ЦДК в норме определяется полное однородное прокрашивание сосуда. При исследовании больных с острым тромбозом в проекции сосуда либо нет цветного изображения, либо определяется его частичное заполнение с закругленным дефектом в области верхушки тромба. Если цветовое картирование регистрирует неполное заполнение просвета вены, а изображение имеет многоцветный неоднородный характер, значит, кровоток носит турбулентный характер. Установка кава-фильтров должна выполняться в специализированных учреждениях, учитывая сложность и травматичность техники имплантации, возможный риск последующих осложнений, невозможность удаления некоторых моделей фильтров после того, как опасность эмболии миновала. Наиболее серьезным осложнением после установки кава-фильтров различных модификацией является тромбоз НПВ. Частоту тромбоза нижней полой вены 10—15 % с развитием клиники хронической венозной недостаточности нижних конечностей многие авторы считают вполне приемлемой ценой за устранение риска легочной эмболии и ее исходов. При имплантации кава-фильтра у больных с острым венозным тромбозом глубоких вен для первичной профилактики ТЭЛА частота подобного осложнения значительно ниже — 3-4,4 %. Сравнительная характеристика различных моделей кава-фильтров в зависимости от количества осложнений приведена в табл. 11.6. Таблица 11.6. Осложнения, развивающиеся при применении различных моделей в процентах кава-фильтров
Преимуществами фильтра "песочные часы", применяемого в клинической практике с 1994 г., являются высокая эмболуловливающая активность и низкая способность к перфорации НПВ в отличие от многих зарубежных разработок (рис. 11.46). Окончательно не установлено, может ли сам кава-фильтр являться причиной тромбоза НПВ. Возникновение тромбоза в поздние сроки после имплантации фильтра (через 3 мес) часто не связывается с захватом эм-бола, а объясняется тромбогенным воздействием фильтра на сосудистую стенку и протекающую кровь, особенно при нарушении показателей свертываемости. Поэтому в настоящее время считается необходимым иметь в арсенале модели кава-филь-тров для постоянной и временной установки. Имплантация постоянных фильтров целесообразна лишь при выявлении нарушений свертывающей системы крови, создающих опасность рецидива ТЭЛА в течение жизни пациента. Опасность тромбоза НПВ в этой ситуации уходит на второй план, к тому же она может быть снижена при проведении консервативных и профилактических мероприятий. В иных ситуациях возможна временная имплантация ка-ва-фильтров на срок до 3 мес.
Рис. 11.46. Обзорная рентгенография брюшной полости. В инфраренальном отделе НПВ определяется кава-фильтр "песочные часы". Учитывая высокий риск возникновения тромбоза глубоких вен в послеоперационном периоде, необходима активная профилактика данного осложнения. Для практических целей выделяют три степени риска (табл. 11.7) после-
Таблица 11.7. Категории риска венозных тромбоэмболических осложнений в процентах (по J.Hirsin, J.Hoak, 1996) операционных венозных тромбоэм-болических осложнений (ТЭО). Необходимость принятия профилактических мер существует во всех без исключения случаях. Выбор способа профилактики зависит от степени риска ТЭО. Поскольку основным источником эмболизации малого круга кровообращения являются тромбозы системы НПВ, их предотвращение исключает и угрозу развития ТЭЛА. В группе больных низкого риска следует использовать неспецифические меры профилактики (максимально ранняя активизация больных, компрессионная терапия). Специфическую профилактику антикоагулянтами в этих условиях не проводят. При умеренном риске наряду с перечисленными выше мерами необходимо дополнительное назначение малых доз гепарина — 5000 ЕД 3—4 раза под кожу живота или, что в настоящее время является более предпочтительным, низкомолекулярных гепа-ринов (клексан, фраксипарин, фраг-мин), которые отличаются меньшей частотой возникновения геморрагических осложнений, большей предсказуемостью их течения и длительностью действия. В оптимальном варианте специфическая профилактика послеоперационного венозного тромбоза должна начинаться не после окончания хирургического вмешательства, а за 2—12 ч до его начала и продолжаться до полной активизации больного (не менее 7—10 дней). Значительно повышенный риск инт-раоперационных геморрагических осложнений иногда может вынудить хирургов отложить введение гепарина на 2—12 ч, но не на 3—4 дня, как это часто бывает на практике. При высоком риске тромботичес-ких осложнений назначение гепарина или его низкомолекулярных фракций целесообразно сочетать с методами ускорения венозного кровотока (перемежающая пневмокомпрессия, электростимуляция мышц и др.). В особых случаях (хирургическое вмешательство на фоне тромбоза илио- кавального сегмента, повторная ТЭЛА во время предыдущих операций и др.), помимо назначения перечисленных выше средств, возможны имплантация кава-фильтра (постоянного или временного), пликация НПВ. Результаты ближайшие и отдаленные. Считается, что эмболия не вызывает каких-либо серьезных последствий, если больной выжил после данного осложнения. Однако в ряде случаев, несмотря на консервативное лечение, возникает хроническая окклюзия (стеноз) главного ствола или главных ветвей легочной артерии с развитием тяжелой гипертен-зии малого круга кровообращения. Для обозначения этого состояния пользуются термином "хроническая постэмболическая легочная гипер-тензия" (ХПЭЛГ). Частота развития данного состояния после тромбоэмболии артерий крупного калибра составляет 17 %. Ведущим симптомом ХПЭЛГ является одышка, которая у 50 % больных наблюдается даже в покое, усиливаясь при перемене положения тела, во время быстрой речи. Плохая переносимость физической нагрузки связана со значительным нарастанием давления в малом круге кровообращения. Помимо одышки, больные предъявляют жалобы на сухой мучительный кашель, приступы которого провоцируются физическим или эмоциональным напряжением, кровохарканье, боль в сердце стенокардического характера. Как результат гемодинамической недостаточности правых отделов сердца наблюдаются увеличение печени, расширение и пульсация яремных вен, асцит, желтуха. По мнению большинства клиницистов, прогноз при хронической легочной гипер-тензии на фоне постэмболического поражения легочного ствола и его главных ветвей крайне неблагоприятен. Продолжительность жизни таких больных, как правило, не превышает 3—4 лет. При выраженной клинической картине постэмболических поражений легочных артерий (прогрессирующая одышка в покое или при минимальном напряжении, нетрудоспособность) необходима хирургическая коррекция. Оперативное вмешательство при этом представляет собой технически гораздо более сложную задачу, чем в острой стадии легочной эмболии. Это объясняется плотным спаянием тромба с артериальной стенкой и наличием высокой гипер-тензии малого круга. Однако только при выполнении хирургической дез-обструкции легочного артериального русла — тромбинтимэктомии — можно достигнуть регрессии тяжелой ХПЭЛГ. Исход вмешательства определяется такими факторами, как длительность заболевания, уровень гипертензии в малом круге, состояние дистального легочно-артериаль-ного русла. Приемлемые условия для выполнения операции сохраняются у больных со сроком окклюзии не более 3 лет и систолическим давлением в малом круге до 100 мм рт.ст. Послеоперационная летальность у больных с субкомпресированным легочным сердцем (давление в правом желудочке 51 — 100 мм рт.ст.) составляет 25 %. При оценке отдаленных результатов вмешательства средняя величина перфузионного дефицита уменьшается вдвое (с 57,4 до 27,1 %), хотя полной нормализации легочного кровотока обычно не отмечается (этот факт объясняется наличием неустранимых препятствий на уровне периферического дистального русла). Литература Гервазиев В.Б., Карпенко А.А. Эндоваску-лярная профилактика тромбоэмболии легочных артерий (кава-фильтр "Волан")// Хирургия.-1995.-Т.1.-С.31-34. Гервазиев В. Б., Карпенко А.А. Проблемы эн-доваскулярной профилактики тромбоэмболии легочной артерии и кава-фильтр "Волан "//Ангиол.сосуд.хир. — 1998. —Т.2. — С.124-130. Савельев B.C., Матюшенко А.А. Тромбоэмболия легочной артерии — точка зрения хи-рурга//Грудн. сердеч.-сосуд.хир.—1999.— Т.6.-С.6-11. Яблоков Е.Г., Прокубовский В.И., Мурадян Р.А., Леонтьев С.Г. Состояние илиокаваль-ного сегмента после имплантации противо-эмболического кава-фильтра "РЭПТЭЛА// Грудн. сердеч.-сосуд.хир.—1990.—ТА— С.36-38. Яблоков Е.Г., Ступин И.В., Прокубовский В.И., Павленко В.В. Оценка эффективности противоэмболических кава-филь-тров// Груд. серд.-сосуд.хир.—1994.—Т.5.— С.39-43. AbuRahma A.F., Robinson P.A., Boland J.P. et al. Therapeutic and prophylactic vena cava interruption for pulmonary embolism: caval and venous insertion site patency//Ann. Vase. Surg.-1993.- Nov.7.-Vol.6.-P.561-568. Anderson F.A.Jr., Wheeler H.B. Physician practices in the management of venous thromboembolism: a community-wide sur-vey//J.Vasc.Surg.-1992.-Vol.l6, N 5.-P.707-714. Ascer E., Gennaro M., Lorensen E., Pollina R.M. Superior vena cava Greenfield filters: indications, techniques and results//J.Vasc. Surg.-1996.-Vol.23, N 3.-P.4987-5503. Bergqvist D. Prevention of postoperative venous thromboembolism — an update//Scope on Phlebology and Lymphology.—1996.—Vol.3, N 2.-P.4-7. Braverman S.J., Battey C.J., Smith R.B. Vena cava interruption//Am. Surg.—1992.—Vol.58, N3.-P.188-192. Carson J.L., Kelley M.A., DaffA. etal. The clinical course of pulmonary embolism//N. Engl. J. Med.-1992.-Vol.326, N 19.-P.1240-1245. Coccheri S., Palareti G. Prevention and treatment of deep venous thrombosis: prevention of pulmonary embolism//Cardiologia.—1994.— Vol.39, N 12, Suppl.l.-P.341-345. Cugell D. W. Vena cava filters and anticoagulants for pulmonary emboli//J. AM. A— 1993,-Vol.270, N 15.-P.1867-1868. Defraigne J. O., Vahdat O., Lacroix H., Limet R. Proximal migration of vena cava filters: report of two cases with operative retrieval//Ann. Vase. Surg.-1995.-Vol.9, N 6.-P.571-575. Dorfman G.S. Percutaneous inferior vena caval filters//Radiology.-1990.-Vol.l74, N 3.-P.987-992. Emanuelli G, Segramora V., Frigerio С Selected strategies in venous thromboembolism: local thrombolytic treatment and caval filters//Hae- matologica.-1995.-Vol.80, N 2, Suppl.-P.84-86. Eschelman D.J., Hovsepian D.M., Bonn J. Transfemoral venous catheterization trough unferior vena caval filters//Am. J. Roentgen- ol.-1992.-Vol.159, N 2.-P.434-435. Ferrari E., Baudouy M., Cerbony P. et al. Clinical epidemiology of venous thromboembolic disease. Results of a French Multicentre Reg-istry//Eur. Heart J.-1997. -Vol.349.-P.685- 691. Ferris E.J., McCowan T.C., Carver D.K., Mc-Farland D.R. Percutaneous inferior vena caval filters: follow-up of seven designs in 320 pa-tients//Radiology.-1993.-Vol.l88, N 3.-P.851-856. Greenfield L.J., Proctor M.C., Cho K.J. et al. Extended evaluation of the titanium Greenfield vena caval filter//J. Vase. Surg.—1994.— Vol.20, N 3.-P.458-464. Gross G.M., Johnson R.C., Roberts R.M. Results of peripheral endovascular procedures in the operating room//J. Vase. Surg.—1996.— Vol.24, N 3.-P.353-361. Krievins D.K., Ramin E.B., Gundars J.K., Thomas J.F. Какова роль тромбоэктомии при тромбозах полой вены и илиофеморального сегмента//Ангиол.сосуд.хир.—1997.—Vol. 1.— Р.83-95. Mohan C.R., Hoballah J.J., Sharp W.J. et al. Comparative efficacy and complications of vena caval filters//J. Vase. Surg.—1995.-Vol.21, N 2.-P.235-245. Monreal M., Lafoz E., Ruiz J- Reccurent pulmonary embolism in pateints treated because of acute venous thromboembolism: a prospective study//Eur. J. Vase. Surg.-1994.-Vol.8.-P.584-589. Palombi M., Bochicchio O., Gargiulo M., Sam-marco M. Alternative therapy of deep venous trombosis in patients with hemmorrhagic risk//Minerva Chir.-1994.-Vol.49, N 3.-P.189-194. Partsch В., Kohn H., MostbeckA. Does bed-rest in symptomatic deep vein thrombosis prevents pulmonary embolism? Scope Phlebol. Lym-phol.-1998.-Vol.5, N 1.-P.4-7. Poletti P.A, Becker CD., Prina L. et al. Long-term results of the Simon nitinol inferior vena cava filter//Eur. Radiol.-1998.-Vol.8.-P.289-294. Rocek M., Peregrin J., Velimsky T. Mechanical thrombectomy of massive pulmonary embolism using an Arrow-Threrotola percutaneous thrombotic device//Eur. Radiol.—1998.— Vol.8.—P.1683—1685. Yune H. G. Inferior vena cava filter: search for ideal device//Radiology.-1989. -Vol. 172.-P.15-16. Дата добавления: 2015-02-06 | Просмотры: 1010 | Нарушение авторских прав |