|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Хирургические методы лечения лимфедемыВ комплексной программе лечения лимфедемы хирургические методы до настоящего времени занимают ведущее место. В начале XX в. существовали два метода лечения лимфедемы: скарификация кожи и ампутация конечности в тяжелых случаях. Эти способы не решали проблему лечения этого тяжелого заболевания, что послужило основанием к поиску и разработке новых путей лечения лимфедемы и их совершенствования, которые определили два основных направления в хирургическом лечении лимфедемы: частичное или полное удаление пораженных тканей и создание новых путей лимфооттока. В каждом из направлений можно выделить ряд подгрупп. Основными типами хирургических операций при лимфедеме являются следующие: I. Резекционные операции: • частичное иссечение пораженных тканей — кожи, подкожной клетчатки, фасции [Kondolion E., 1912; Ser-vele ML, 1960; модификация Н.И.Краковский, Т.В.Савченко, 1971, 1976]; • радикальное иссечение тканей с закрытием раневой поверхности кожными трансплантатами [Charles R., 1912; ТрошковАА., 1950; Кузин М.И., 1962; Медведев П.М., 1964; Краковский Н.И., 1966, и т.д.]; • использование управляемой абак-териальной среды в пред- и послеоперационных периодах при радикальных операциях [Костюченок Б.М., Мата-сов В.М., 1986]. II. Создание новых путей лимфооттока: 1) дренирование пораженных учас 2) формирование искусственных 3) создание периферических лим а) прямые лимфовенозные анас б) лимфонодуловенозные анас в) лимфо-лимфатические анас III. Аспирационные операции. К настоящему времени многие способы операции остались в истории, ряд из них претерпели значительные усовершенствования и модификации. Появление лимфодренирующих и аспирационных методов позволило выполнять сочетанные операции, что уменьшило объем травматичных, резекционных операций. Выбор и сочетания операций определяются степенью выраженности патологических изменений в тканях, а также локализацией поражения (одно- или двусторонней), последняя значительно осложняет лечебную тактику из-за распространенности процесса. Как правило, в таких случаях оперативное лечение разделяется на два этапа: вначале выполняются лимфодренирующие операции, а затем, при необходимости, кож-нопластические. Операции на лимфатических сосудах. Операция наложения лимфове-нозных анастомозов (Л В А) показана практически всем больным с обратимым отеком при любой степени заболевания. Абсолютными показаниями к ЛВА являются: • проксимальный блок лимфатических сосудов или узлов; • сегментарная окклюзия или прямое травматическое повреждение магистральных лимфатических сосудов. Операция относительно показана при затруднении лимфатического оттока вследствие врожденной или приобретенной недостаточности лимфатических сосудов, что наблюдается при гипоплазии лимфатических сосудов. Противопоказания связаны с местными и общими факторами: • диффузный склероз лимфатических сосудов, аплазия; • трофические изменения кожи в зоне операции; • острый воспалительный процесс. нозных анастомозов определяется уровнем максимального отека. При диффузном поражении операцию целесообразно выполнять на нескольких уровнях. С 1985 г. нами разработана и применяется методика многоколекторного и многосегментарного наложения ЛВА. Наложение ЛВА выполняют под местной анестезией; оно включает несколько этапов. • введение лимфотропного красителя (синий Эванса, метиленовый синий) — 0,1 мл внутрикожно; • выделение лимфатических сосудов и венозных ветвей, пригодных для наложения лимфовенозных анастомозов, сопоставление этих сосудов в максимально выгодном анатомическом положении; • наложение соустий. Лимфовенозные анастомозы выполняют двумя основными способами: конец в бок и конец в конец, последний более прост в техническом отношении. Для создания условий, обеспечивающих достаточное дренирование лимфы, необходимо формировать лимфовенозные анастомозы в нескольких сегментах и коллекторах конечности. Оптимальной является методика наложения лимфовенозных анастомозов на стопе, голени и бедре при отеке всей конечности и на стопе и голени при отеке до уровня коленного сустава. Лимфовенозные анастомозы в зоне наружного лимфатического коллектора накладывают на уровне средней трети голени. При наложении анастомоза важным условием является отсутствие какого-либо натяжения сосуда. Проходимость анастомоза определяется появлением лимфотропного красителя в вене, исчезновением в ней крови. Послеоперационное ведение включает дезагреганты в малых дозах, активаторы фибринолиза (никотиновая кислота), эластическая компрессия, легкие движения в конечности, пневмомассаж на небольших цифрах давления. Перевязка лимфатических сосудов. При лимфедеме в стадии декомпенсации развивается стойкая недостаточность клапанов лимфатических сосудов. Клиническим признаком ретроградного тока лимфы является появление множественных везикул на коже, значительного отека тканей, который при бинтовании или возвышенном положении конечности резко уменьшается и вновь быстро возвращается к исходному при снятии бинтов или опускании конечности. Рентгенологически это проявляется резким расширением лимфатических сосудов в дистальных сегментах конечности и нарушением эвакуации контрастного вещества при проведении функциональной пробы с физической нагрузкой. При ревизии таких сосудов во время операции и пробе с пережатием дистальный участок лимфатического сосуда спадается и резко расширяется проксимальный. При пересечении таких сосудов отмечается струйное иссечение лимфы из проксимального конца. С целью устранения ретроградного тока лимфы применяется операция — перевязка расширенных лимфатических сосудов. Нами выполнено 49 операций у 41 больного. Перевязка и пересечение несостоятельных лимфатических сосудов произведены на уровне бедра, в зоне магистрального медиального коллектора, у 6 больных на уровне голени и у одного больного на двух уровнях: бедре и голени. Во всех случаях наблюдался отчетливый клинический эффект, который проявлялся уже в первые часы и дни после операции. В некоторых случаях возможна комбинация операции — перевязка и пересечение расширенных лимфатических сосудов в проксимальных сегментах конечности и лимфовенозное дренирование в дистальных — у истоков лимфатического оттока на стопе. Клинические наблюдения подтверждают эффективность предложенной операции и ее вариантов. Кожнопластические операции. Этот тип операций включает два способа — частичное иссечение пораженных тканей (дермолипофасциэктомия) на полуокружности конечности или полное (радикальное) их иссечение. Дермолипофасциэктомия. Основная цель резекционной операции состоит в удалении пораженных тканей (кожи, подкожной клетчатки и частично фасции) для создания внутреннего, лимфатического дренажа и получения хорошего функционального и косметического эффекта. Частичная дермолипофасциэктомия применяется при любой степени лимфедемы, сопровождающейся раз- витием фиброзных изменений в тканях. Противопоказанием к этой операции является острый общий или местный воспалительный процесс, микотическое поражение кожи конечностей. Методика предложенной нами в 1971 г. операции состоит в отличие от широко распространенной операции Сервелла — Кондолеона в том, что линия разреза и иссечение патологически измененных тканей производятся не по внутренней, а по наружной поверхности голени с последующим переходом на стопу (рис. 13.26). Данная методика позволяет получить более высокий функциональный и косметический эффект. При необходимости в случае значительного избытка тканей дополнительно используется традиционная методика — иссечение тканей по внутренней поверхности голени, бедра. В послеоперационном периоде в течение первой недели рекомендуется щадящий режим, контроль за состоянием кожных краев раны, профилактика их отслойки скапливающейся лимфой. Обязательным является тщательное дренирование послеоперационной раны для предупреждения отслойки кожных лоскутов и бинтование конечности.
Заживление раны первичным натяжением отмечено у 95 % пациентов, краевой некроз кожи — у 5 %.
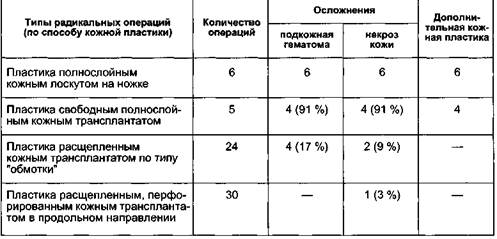
55 - 4886 Основной причиной некроза кожных краев раны была чрезмерная отслойка кожных лоскутов (более 4—5 см) от линии разреза. Радикальные операции. Радикальные операции имеют целью полное иссечение по всей окружности пораженной части конечности кожи, подкожной клетчатки, фасции с последующим закрытием раневой поверхности полнослойным или расщепленным кожным трансплантатом на "ножке" или "свободным". Фиксация производится единым лоскутом [Трошков А.А., 1950; Караванов Г.Г., 1955; Горшков С.З., 1958; Charles R., 1912] или кожными лентами по типу "обмотки" П.М.Медведева (1959). Показанием к радикальной операции является крайняя степень развития фиброзных изменений в тканях пораженной конечности (лимфедема IV степени). Противопоказанием служат: • общее тяжелое состояние больного; • острый воспалительный процесс; • нарушение венозного оттока по глубоким венам; • местные воспалительные и трофические изменения кожи; • микотическое поражение стоп. радикальным операциям. В комплекс подготовки включаются общие мероприятия, направленные на укрепление организма, снятие местных воспалительных реакций, десенсибилизирующую терапию. Проводится определение микробной флоры зева, носа, а при возможности местных тканей и ее чувствительности к антибиотикам. Особенно это необходимо, если пациент болел рожей. За 24—48 ч до операции назначается курс антибиотикотерапии. Кожа конечности подвергается тщательному туалету (ножные ванны с антисептиками). На ночь назначаются седатив-ные препараты. Варианты радикальных операций. С использованием методики пересадки полнослойного кожного лоскута "свободного" или "на ножке" выполнено 9 операций. Во всех случаях было отмечено развитие зоны некроза от 20 до 350 см2, что потребовало дополнительный кожной пластики и резко удлинило срок пребывания больных в стационаре. При операции с использованием метода П.М.Медведева по предложению Н.И.Краковского на заключительном этапе вмешательства — пластике кожи, нижний конец кожной "ленты", взятой со стопы и нижней трети голени, фиксируется в проксимальном отделе конечности, а более полноценный кожный лоскут (проксимальный) трансплантируется на стопу. Результаты операции несколько улучшились, однако и в этой модификации наблюдалось образование зон некроза, кожа длительно "болела". Подтверждалось высказывание А.Н.Ретвинского (1969), что пересадка кожи во всю толщину при лимфедеме нерациональна, так как сохраняется реальная возможность прогрессирования гипертрофического процесса в коже, а следовательно, возможность рецидива. Впервые использование расщепленной кожи для закрытия кожных дефектов предложил Charles (1912). Ф.А.Гергенредер иссекал ткани на голени (в три этапа), а раневую поверхность покрывал свободными кожными лоскутами по Тиршу. Через 3 года рецидива заболевания не было. Анализируя наши наблюдения и основываясь на опыте по кожной пластике отечественных и зарубежных хирургов, была разработана новая методика кожной пластики с использованием расщепленного, а в случае необходимости перфорированного кожного лоскута. Основные этапы операции. Положение больного на спине с приподнятой на подставке конечностью. Для уменьшения кровопотери и сокращения срока операции применя- ется кровоостанавливающий жгут на проксимальную часть бедра. Осложнений ни в ходе операции, ни после нее мы не наблюдали. Первый этап. С помощью дерма-тома производят забор кожных лоскутов возможной длины и толщины 0,4-0,8 мм. Второй этап. Рассекают во всю толщину подкожную клетчатку и фасцию на передней поверхности голени и стопы и последовательно острым и тупым путем удаляют ее единым массивом. В области сухожильных влагалищ, голеностопного сустава фасцию удаляют с особым вниманием во избежание их повреждения. Производят тщательный гемостаз, перевязку перфорантных вен. Снимают жгут и при необходимости выполняют дополнительный гемостаз. Третий этап. Фиксация кожных трансплантатов в продольном направлении. Целесообразно предварительное сшивание их в один или два единых лоскута, что значительно сокращает время операции. Асептические влажные повязки. Эластическое бинтование (рис. 13.27). Такой вариант кожной пластики обеспечивает максимальное приживление кожи. Срок послеоперационного периода (сокращается до 25—30 дней с полным восстановлением функции конечности). Результаты операций представлены в табл. 13.14. Самым частым осложнением в ближайшем послеоперационном периоде было развитие подкожных гематом, отслойка кожного трансплантата. При пластике единым полно-
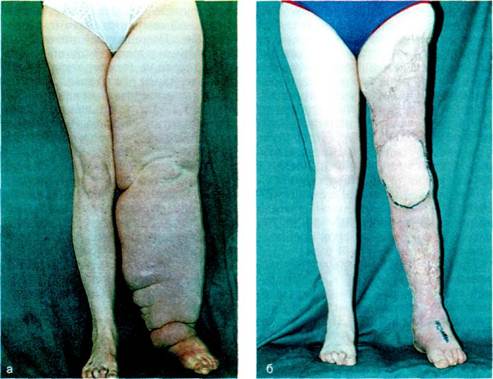
Рис. 13.27. Больная лимфедемой IV степени левой нижней конечности, а — до операции; б — после радикальной операции. 55* Таблица 13.14. Непосредственные результаты радикальных операций
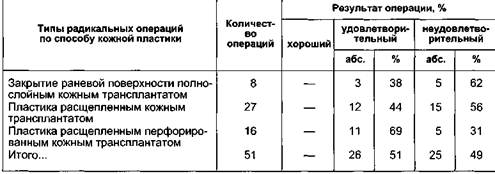
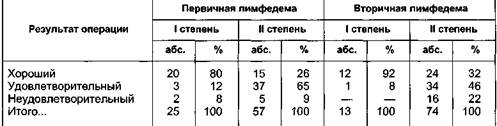
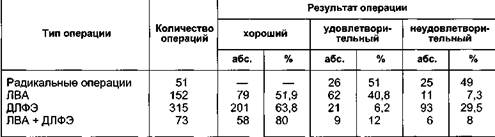
слоиным кожным трансплантатом такое осложнение было в 91 % случаев в виде множественных мелких или массивных сплошных участков. При пластике расщепленным кожным трансплантатом методом отслойки кожи скопление лимфы, крови не превышало 2—4 мл (преимущественно область лодыжек), устранялось при первой перевязке и не имело последствий. Отслойка кожи приводит к некрозу кожного трансплантата. Она возможна и при использовании полнослойной кожи. Требуется иссечение этих участков и дополнительная пластика за счет кожи, взятой с других участков тела (бедро, живот). Предложенные модификации подготовки кожной пластики снизили количество осложнений с 91 до 3 % и сократили средний срок пребывания в стационаре в 3—4 раза. Операции при лимфедеме с использованием управляемой абактериаль-ной среды. Разработанный в отделении ран и раневой инфекции Института хирургии им. А.В.Вишневского РАМН метод лечения в управляемой абактериальной среде [Кузин М.И., 1979; КостюченокБ.М., Матасов В.М., 1981] был использован у 25 больных лимфедемой III—IV степени с выраженными местными нарушениями (воспалительный процесс, язвы) и изменениями со стороны внутренних органов, явлениями гипотонии, анемии, когда объем поражения был достаточно велик, а выполнение радикальной операции было противопоказано. Помещение конечности в изолятор с управляемой абактериальной средой (температура 34 °С, давление 35 мм рт.ст.) давало эффект уже в первые сутки: увеличение диуреза до 2—3 л, уменьшение объема конечности от 25 до 65 % от первоначального, улучшение общего самочувствия, заживление язв. Все это позволяло ограничить объем операции сегментарным иссечением пораженных тканей в зоне максимального фиброза, сделав ее менее травматичной. Использование УАС в послеоперационном периоде обеспечивает: • предупреждение послеоперационного отека конечности; • уменьшение опасности инфицирования. Все раны зажили первичным натяжением. Отдаленные результаты хирургического лечения лимфедемы. Сведения об отдаленных результатах хирургического лечения лимфедемы весьма разноречивы, что можно объ- яснить большим разнообразием методов операций, отсутствием единой, стандартной методики оценки результатов, а также сложностью методики оценки лимфодренирующих операций, малым числом и сроком наблюдений. A.Zelicowki, выполнив 4 больным лимфедемой нижних конечностей 8 радикальных операций, отметил что, "уменьшая объем конечности", операция приносит большой вред коже, оставляя грубые рубцы. В последнее десятилетие в мире распространение получила операция N.Tompson. Произведенная оценка непосредственных и отдаленных результатов, а также экспериментальные исследования функции деэпите-лизированного кожного лоскута, имплантируемого в мышцу, показали, что он подвергается склерозированию и не может обеспечить отток лимфы из поверхностной лимфатической системы конечности в глубокую, что создает условия для рецидивов заболевания и его прогрессирования. По данным О.Вгаеп, проходимость ЛВА до 6 мес подтверждена в 53 % в сроки до 14 лет. Из 52 оперированных положительный результат был в 42 %. Нами проведен анализ отдаленных результатов хирургического лечения больных лимфедемой I—IV степени в сроки от 6 мес до 10 лет у 591 больного из 984 оперированных. Основными типами операций были радикальные операции — 51, наложение ЛВА — 152, дермолипофасциэкто-мия — 315, сочетанные операции (ДЛФЭ + ЛВА) - 73. Анализ отдаленных результатов проводили по трем стандартизированным определениям: хорошие, удовлетворительные и плохие, в каждой группе операций с учетом клинической формы лимфедемы, степени заболевания и типа лимфатических сосудов (гипоплазия, гиперплазия). Отдаленные результаты операций наложения ЛВА изучены у 152 больных в возрасте от 12 до 65 лет, пер- вичная лимфедема была у 83, вторичная — у 69 больных. На одном уровне ЛВА наложены 121 больному (79,6 %), на двух-трех уровнях 31 (20,4 %). При анализе в сроки до 6 мес результат был положительным у 68,4 %, через год — у 53,2 %, через 5 лет и более — у 48 % пациентов. Основными причинами восстановления прежнего состояния и даже прогрессирования отека были физические перегрузки (18,4 %), нарушения режима (11,2 %), травма (1,3 %), воспалительные процессы (рожа). При дифференцированном анализе по клиническим формам лимфедемы выявлены значительные различия: при первичной лимфедеме хороший результат был у 42,3 %, при вторичной — у 63,8 % больных (табл. 13.15). Анализ отдаленных результатов радикальных операций по поводу лимфедемы III—IV степени проведен у 51 из 65 оперированных больных (табл. 13.16). Выявлены определенные преимущества использования расщепленного кожного трансплантата, а в случае грубых изменений кожи (инду-рации, периферических нарушений) расщепленного перфорированного трансплантата, что позволило с минимальной травмой для больного (без взятия кожи с других участков тела) произвести операцию и снизить количество неудовлетворительных результатов с 62 до 31 % (табл. 13.17). При III—IV степени лимфедемы хорошие результаты получены только Таблица 13.15. Отдаленные результаты операции наложения ЛВА при первичной и вторичной формах лимфедемы (в процентах)
Таблица 13.16. Отдаленные результаты радикальных операций при лимфедеме III—IV степени
Таблица 13.17. Отдаленные результаты модифицированной дермолипофасциэктомии (ДЛФЭ) при первичной и вторичной лимфедеме I—II степени
у 4 % больных при вторичной лимфедеме. Удовлетворительные при первичной лимфедеме составили 48 %, неудовлетворительные — 52 %. При вторичной лимфедеме удовлетворительный результат отмечен у 69 % и неудовлетворительный — у 27 % больных. Примененная в Институте хирургии им. А.В.Вишневского РАМН комбинированная методика хирургического лечения лимфедемы III—IV степени, сочетающая прямой лим-фодренаж с сегментарной резекционной операцией, оправдала себя в функциональном и косметическом плане (табл. 13.18). Наиболее перспективными мы считаем ранние операции при лимфедеме I—II степени. Необходимо
Таблица 13.18. Сравнительный анализ отдаленных результатов различных типов операций при лимфедеме и их сочетаниях строго оценивать не только клиническую форму лимфедемы, но и степень заболевания, состояние лимфатических сосудов. При первичных формах лимфедемы, когда преобладает гипопласти-ческий тип лимфатических сосудов, возможен вариант наложения анастомозов на нескольких уровнях (стопа, голень, бедро) и в разных лимфатических коллекторах. В случаях, когда выражен фиброзный процесс, сегментарное иссечение тканей возможно сочетать с аспирацией. Рекомендуется более высокая шкала оценки отдаленных результатов, в которую наряду с традиционными показателями: размерами конечности, ее функцией, трудоспособностью больных — должны быть включены также внешний вид оперированной конечности, состояние послеоперационного рубца, кожных покровов, стабильность состояния больного, воспалительные процессы в зоне операции. При оценке результатов хирургического лечения лимфедемы наряду с клиническими данными особое значение придается специальным лучевым методам исследования, среди которых наибольшую информацию дают ультразвуковые и компьютерно-томографические методы. Система комплексного лечения и реабилитации больных лифедемой. Консервативное лечение показано как ведущий вид лечения больным лимфе-демой I степени. При более тяжелых нарушениях лимфообращения (лим-федема II—III—IV степени) консервативная терапия является вспомогательным методом при подготовке больных к операции. В этих случаях она способствует более гладкому послеоперационному течению, предупреждает возможные осложнения. Продолжение консервативного лечения и после операции является обязательным условием профилактики рецидива и прогрессирования заболевания. При начальных проявлениях забо- левания — лимфедеме I—II степени показания к операции можно определить только после проведения повторных курсов консервативной терапии. Иногда этот период может продолжаться от 1 года до 2 лет. В том случае, когда и после проведенного лечения не получено ожидаемых результатов, можно рекомендовать операцию. Консервативное лечение включает антитромботическую, диуретическую, десенсибилизирующую терапию, иммунотерапию, назначение препаратов гиалуронидазного действия, витаминов, физиотерапевтические процедуры, лечебную физкультуру, массаж, бальнеологическое лечение. Консервативная терапия может проводиться амбулаторно и в условиях стационара общехирургического или сосудистого профиля. Лечение должно быть комплексным, направленным на различные звенья патологического процесса и включать как медикаментозную терапию, так и методы физио- и баль-неолечения. Медикаментозная терапия должна проводиться курсами 2—3 раза в год и чередоваться с назначением физиопроцедур. Наряду с положительным воздействием на нейротрофичес-кий компонент заболевания проводится противобактериальное лечение. С этой целью рекомендуется проверить чувствительность микрофлоры, взятой из зева и носа больных лим-федемой, к антибиотикам. При наличии локальной зоны инфекции в пораженной конечности требуется взять посев в этой зоне и назначать курс антибиотикотерапии с учетом чувствительности. Продолжительность курса антибиотикотерапии составляет 5—10 дней. Больным лим-федемой, особенно в период лечения антибиотиками, показаны витамины группы С, В, Р, аскорбиновая кислота (0,1 г 3 раза в день) с рутином (0,02 г 3 раза в день) или таблетки ас-корутина, противогрибковые препараты (леворин, нистатин, декамин). Кроме того, витаминотерапия оказывает благоприятное влияние на окислительно-восстановительные процессы в тканях, стимулирующее влияние на систему гиалуронидазы — гиалуро-новая кислота. Витамин С активизирует гиалуронидазу при проведении лечения препаратами гиалуронидаз-ного действия, стимулирует фагоцитарную активность и образование антител, оказывает разрушающее действие на токсины. При плохой переносимости антибиотиков для лечения рожи и профилактики ее рецидивов возможно использовать производные нитрофу-рана (фуродонин, фурозолин, фуро-золидин) по 0,1 г 3 раза в сутки в течение 7—8 дней. С целью активации иммунозащитных сил рекомендуется назначение неспецифической иммуностимулирующей терапии: левами-зола (декарис) по 150 мг 1 раз в день, в течение 3 дней, 3 курса с 4-дневными перерывами. Возможно назначение препаратов пирамидиновых оснований — метилурацила по 0,25 г 2 раза в день — 10 дней, пентоксила. Диуретические средства — триампур, лазикс, гипотиазид, фуросемид — рекомендуется назначать в небольших дозах 1—2 раза в неделю в комплексе с препаратами калия по показаниям. Препараты, влияющие на тонус сосудов: • троксевазин (венорутон) по 1 капсуле 2 раза в день 25 дней или по 1 ампуле (5 мл) внутримышечно 20 дней. Анавенол по 25 капель 3 раза в день 30 дней; • эскузан по 20 капель 3 раза в день — 30 дней, детралекс по 2 таблетки в день во время еды. Детралекс повышает тонус вен, снижает проницаемость капилляров, защищает их от повреждения, стимулирует лимфо-ток [Barcle К., 1992; Alat P., 1997], предупреждает выделение медиаторов воспаления. Появились сообщения о возможности и эффективности использования вазопростана (ПГЕ1) в виде подкожных инъекций при лечении больных лимфедемой, особенно в начальной стадии заболевания — I— II степень заболевания [Овчинников СИ., 2000]. Полученные данные о наличии лимфореологических, анти-оксидантных и иммуномодулирую-щих свойств вазопростана подтверждают целесообразность и патогенетическую обоснованность использования препарата [Коваленко В.И., Овчинников СИ., Малышева А.А., 1999]. Рациональное сочетание физиотерапевтических процедур с хирургическими методами лечения значительно улучшает эффективность лечения. Цель включения физиотерапевтических методов в комплексе пред- и послеоперационного лечения — предупредить возможность осложнений, способствовать более гладкому послеоперационному течению. Благоприятное влияние на повышение дренажной функции лимфатической системы, на развитие окольного лимфообращения оказывает курортное лечение: сероводородные ванны (Мацеста, Пятигорск), радоновые (Цхалтубо). Больные, страдающие лимфедемой, подлежат постоянному диспансерному наблюдению. Этой группе больных независимо от вида лечения рекомендуется проведение курсов консервативной терапии. Медикаментозная терапия должна проводиться курсами 2—3 раза в год и чередоваться с назначением физиопроцедур. Профессиональная ориентация больных лимфедемой. Важным элементом профилактики осложнений и дальнейшего развития заболевания является правильная профессиональная ориентация при вступлении больного в трудовую деятельность. Это прежде всего касается большой группы лиц в возрасте от 16 до 25 лет, которые страдают первичной ранней формой лимфедемы. Заболевание у них в большинстве случаев, как показал Н.П.Снытко (1985), находится в начале своего развития (I—II степень заболевания). От правильной организации труда у таких больных во многом зависит дальнейшее течение болезни. Литература Вахидов В.В., Кадыров Р.Ю. Изменение поверхностных лимфатических сосудов при поражении вен нижних конечностей // Хирургия. - 1976. - № 12. - С. 41-45. Веденский А. И. Варикозная болезнь. — Л.: Медицина, 1983. Жуков Б.Н., Борисов В.К. О нарушениях и коррекции лимфооттока при хронической венозной недостаточности нижних конечностей // Вестн. хир. — 1976. — № 2. — С. 89-92. Золотухин И.А., Богачев В.Ю. Медицинский компрессионный трикотаж: излишество или необходимость? // Ангиология и сосудистая хирургия. — 1999. — Т.5, № 4. — С. 79-83. Золотаревский В.Я., Савченко Т.В., Дан В.Н. и др. Дифференциальная диагностика хронических отеков конечностей//Ангиол. и сосуд, хир. - 1999. - Т. 5, № 1. - С. 26-33. Кириенко А.И., Богачев В.Ю. и др. Лечение тяжелых форм хронической венозной недостаточности препаратом гинкор-форт // Ангиология и сосудистая хирургия. — 1999. — Т.5, № 2. - С. 52-56. Покровский А.В., Клионер Л.И., Тарапон Ю.Г. Патогенез и хирургическое лечение пост-тромбофлебитических и варикозных язв голеней // Хирургия. — 1974. — № 11. — С. 73-77. Савельев B.C., Яблоков В.Г. Посттромботи-ческая болезнь // Болезни сердца и сосудов / Под ред. Е.И.Чазова. — М.: Медицина, 1992. - Т.З. - С. 417-442. Berberich J., Hirsch S. Die Roentgenogra-phische Dorsalluna der Arterien und Venen am Lebenden Menschen // Klin. Wschr. — 1923. — Bd. 2. - S. 2226. Browse N.L., Bumand K.C. etal. Diseases of the Veins. - New York, 1999. FerriarJ. An affectation of the limphatic vessals hitherto misunderstood // Med. Histor. and Reflections. - 1810. - Vol. 3. - P. 129. Mailer A. First Lines of Physiolocy, 1786. Bergan J.J. (Ed.), Yao J.S. (Ed.). Surgery of the Veins. - London, 1985. - P. 6-7. Kinmonth J.B. The Limphatics. — London, 1982. Kinmonth J.B. Lymphangiography in man // Clin. Sci. - 1952. - Vol. 11. - P. 13. Дата добавления: 2015-02-06 | Просмотры: 1846 | Нарушение авторских прав |