|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Радиационно-генетические эффекты на молекулярном уровнеНа первом этапе облучения в хромосомной ДНК образуется сложный макрорадикал с двумя типами локализации неспаренных электронов, которым соответствуют повреждения оснований и повреждения сахарофосфатных цепей. Причем нуклеотидные основания повреждаются чаще, чем сахарофосфатная часть ДНК, примерно в 3 раза. По данным работы 80-90% электронов и радикалов, образующихся при облучении, реагируют с азотистыми основаниями – самыми лабильными частями молекулы – и только 10-20% энергии расходуется на разложение сахарофосфатного фрагмента ДНК. Наиболее радиоустойчивыми являются углеродные связи, которые в 7,5 раза стабильнее, чем фосфодиэфирные. Из азотистых оснований большей радиочувствительностью обладают пиримидиновые, из которых самый лабильный тимин. Пуриновые основания в 2 раза устойчивее пиримидиновых. Под действием ионизирующей радиации чаще повреждается одна нить ДНК. При этом образуются такие первичные повреждения, как дезаминирование оснований, алкилирование, возникновение оксимов цитозина, димеризация или гидратация пиримидиновых оснований и др. Вторичные реакции – это разрывы водородных связей, конфигурационные изменения надмолекулярных структур ДНК, а также внутри- и межмолекулярные сшивки полимерных цепей. Разрушение надмолекулярной структуры (деспирализация) обусловлено двойными разрывами ДНК, которые возникают, если одиночные разрывы нитей ДНК расположены на расстоянии не более 10 пар нуклеотидов друг от друга.
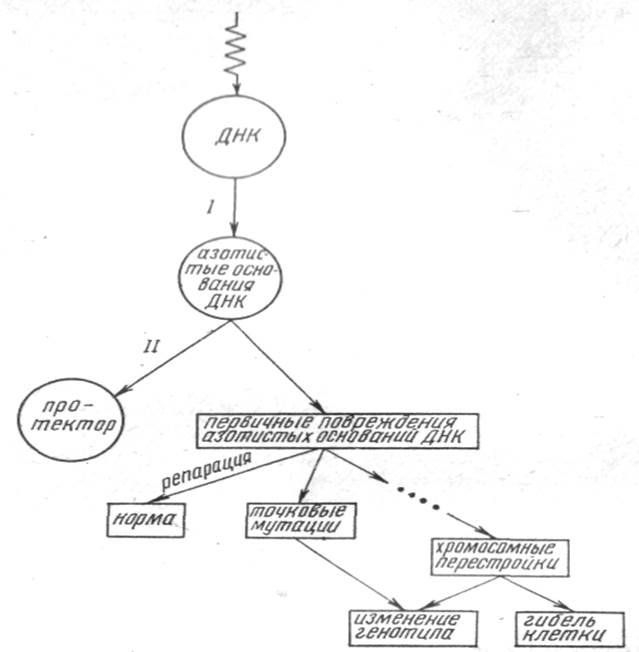
3. Схема радиационно-генетических эффектов в клетке.
Попадание кванта энергии при облучении клетки – процесс случайный, однако конечное повреждение образуется преимущественно в определенных участках хромосом, в так называемых „горячих точках”. Это явление можно объяснить миграцией энергии или заряда вдоль хромосомы к наиболее „ранимым” местам. Существует миграция электронного возбуждения по молекуле ДНК на большие расстояния – 103-104 пар оснований. Далее миграция энергии или заряда идет в направлении наиболее легко возбуждаемых азотистых оснований, которые и являются преимущественными местами атаки электронов. Вещества-радиопротекторы могут захватывать на себя и электроны и возбуждение, чем вызывают снижение выхода радикалов ДНК. Предполагается,
что такой радиопротектор образует с ДНК комплекс, в котором возможна миграция заряда или возбуждения с ДНК на защитное вещество, а рекомбинация этого заряда с зарядом противоположного знака происходит на фрагменте протектора. Таким образом, если квант энергии попадает на ДНК, необязательно последует ее повреждение: при наличии в клетке веществ-радиопротекторов возможна миграция энергии или заряда полностью или частично на протектор (рис. 1.1). Если такой миграции нет, то первичное радиационное повреждение локализуется на азотистых основаниях ДНК. Какова дальнейшая судьба этих повреждений? Во-первых, первичные повреждения могут быть репарированы; во-вторых, возможно образование точковых мутаций и, в-третьих, первичные радиационные повреждения нуклеотидов могут дать начало цепи событий, приводящих к формированию хромосомных аберраций.
Дата добавления: 2015-12-16 | Просмотры: 2023 | Нарушение авторских прав |