 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ЖИВАЯ МАТЕРИЯ
1.2.1 Элементарный состав живых организмов Из известных к настоящему времени более 110 элементов лишь немногие постоянно встречаются в живых организмах. В первую очередь это имеющиеся в больших количествах в живой природе (и необходимые!) макроэлементы (биогенные элементы): Н, С, О, N, S, P, Ca, Mg, К, Fe и характерные для животных Na и СІ. Их концентрация в живых системах составляет более 0,1%. Концентрация Fe, как правило ниже 0,1%, однако роль этого элемента в биохимических дыхательных системах столь велика, что его относят к макроэлементам (табл. 1.1). Регулярно в меньших количествах встречаются столь же необходимые для жизни следовые элементы (микроэлементы): Сu, Mn, Zn, Mo, Со, у животных также F, J, Se, у растений – Сl и В. Их концентрация в организмах меньше 0,1%. Есть еще элементы (ультрамикроэлементы), которые встречаются только у определенных видов организмов (или случайно попадают в них – примеси).
Таблица 1.1 – Химические элементы, обнаруженные у животных, и их приблизительное содержание (в весовых процентах)
В живой и неживой природе распространенность отдельных элементов весьма различна. Например, относительное количество железа в неорганической природе (земной коре, гидросфере и атмосфере) в 300 раз больше, чем в организме человека, тогда как углерода, наоборот (в человеке его в 200 раз больше, чем в окружающей неживой среде). Таким образом, живые организмы способны избирательно поглощать из окружающей среды определенные элементы. В живых организмах накапливаются главным образом элементы с низкими атомными массами. 1.2.2 Химическая основа жизни Живые системы состоят из неорганических и органических соединений. Неорганические соединения – вода и растворенные в ней минеральные вещества. В количественном отношении первое место среди химических соединений занимает вода (в организме человека около – 60%, у медузы – 96% и больше). Вода служит растворителем, средством внутреннего транспорта, средой для большинства процессов обмена веществ и участвует в реакциях гидролиза. Число органических соединений, состоящих главным образом из С, Н, О, N, S и Р, в живом организме чрезвычайно велико; они принадлежат в основном к четырем классам – белкам, липидам, углеводам и нуклеиновым кислотам. У животных количественно преобладают белки, у растений – углеводы. У человека число белков оценивают в 5 млн.; примерно 1,2 млн. живых организмов содержит в совокупности около 1011 различных белков. Однако вопреки мнению многих исследователей конца девятнадцатого века ни одно из органических веществ, выделенных из живых организмов или синтезированных химиками, не проявляет свойств живого. Не существует изолированных «живых веществ». Только организованное взаимодействие различных веществ порождает то, что мы называем жизнью.
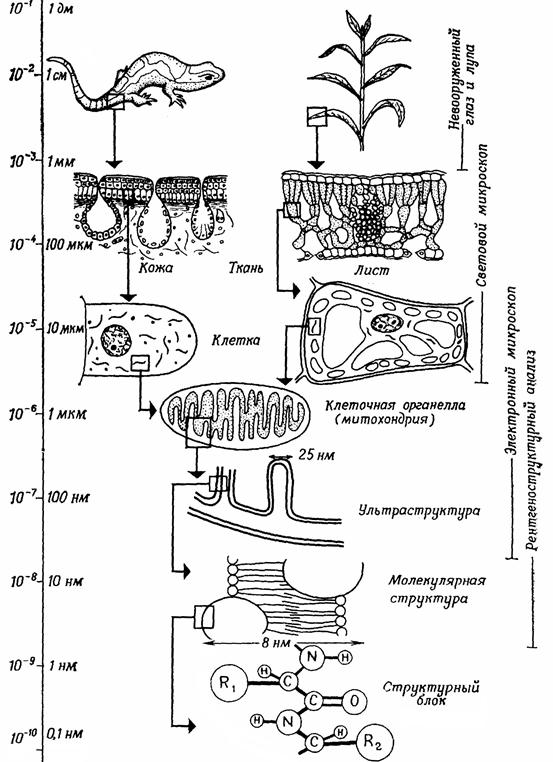
1.2.3 Структурная организация живых организмов Живое выступает в форме определенных образований – «живых организмов» (рис. 1.1). Они отличаются сложной, вплоть до молекулярного уровня, структурной организацией – «безграничной гетерогенностью живых систем» (К.С.Тринчер). Наоборот, машина состоит из определенного числа неподвижных или подвижных частей, каждая из которых гомогенна. Клетка, признанная в ХІХ веке общим структурным элементом всех живых организмов, как многоклеточных животных и растений, так и одноклеточных «протистов», в высокой степени структурирована. Кроме клеточного ядра, обнаруженного Р. Брауном в 1833 г., в теле живой клетки –
Рис. 1.1 - Структурная организация живых организмов до молекулярного уровня
протоплазме – выявлены (некоторые лишь с помощь электронного микроскопа) многочисленные образования с собственными мембранами (например, митохондрии, пластиды, лизосомы и т.д.). Клетка, ограниченная снаружи плазматической мембраной, оказалась расчлененной внутренними мембранами на несколько вложенных друг в друга пространств, или отделений (компартментов). Мембраны имеют характерную молекулярную организацию. Если уже каждая клетка определенным образом структурирована и организована, то у многоклеточных организмов из множества однотипных клеток образуются новые структурные единства – ткани, из различных тканей – органы, а из нескольких органов – системы органов, которые, наконец, вместе составляют живой организм. Благодаря этой сложной структурной организации вплоть до молекулярного уровня все живые организмы отличаются от всех неживых объектов, созданных руками человека.
1.2.4 Динамическое состояние организма «Живое состояние» – это в первую очередь не структура, а процесс. Структуры живого не стабильны, а постоянно разрушаются и строятся заново. Это обновление протекает с различными скоростями. Относительно стабильны, например, дезоксирибонуклеиновые кислоты (ДНК), а также структурные полисахариды (целлюлоза и др.). Мерой этого процесса служит период биологического полуобновления (полужизни) – время, за которое половина данного вещества заменяется новыми молекулами. Скорость обновления изменяется не только от вида к виду, но и от организма к организму и от вещества к веществу. Например, у крыс период полужизни сахара в крови 19 мин, гликогена в печени 20–24 ч, гликогена в мышцах 3–4 дня, белка печени 2–4 дня (у человека 8–10 дней), резервного жира 16–20 дней.
1.2.5 Закон действующих масс идинамическое равновесие Каждая свободно идущая химическая реакция k1 aА + bВ + ··· «mМ + nN (1.1) k–1
достигает, в конце концов, состояния равновесия (термодинамического равновесия), когда скорость прямой реакции
В закрытых системах константа равновесия K(=k1/k-1)зависит от температуры. Катализатор (фермент), напротив, не оказывает влияния на К,он влияет только на время, необходимое для достижения равновесия. В случае открытой химической системы динамическое равновесие может быть достигнуто, когда при постоянном потоке веществ, участвующих в реакции, установятся их стационарные концентрации. Это независимое от времени состояние называется стационарным состоянием. Все клетки и все живые организмы представляют собой открытые химические системы, так как они постоянно поглощают новые исходные вещества и выделяют продукты обмена. При стационарном состоянии равны друг другу скорости превращения v i =k i[Xi], а не стационарные концентрации [Xi]. Стационарная концентрация промежуточного продукта [Xi] тем меньше, чем больше константа его превращения ki. В отличие от замкнутой системы в открытой системе катализатор (фермент), изменяющий константу превращения, изменяет и стационарные концентрации. Скорость всей цепи реакций определяется реакцией, идущей с наименьшей скоростью, – скорость-лимитирующей реакцией.
Дата добавления: 2014-09-29 | Просмотры: 1332 | Нарушение авторских прав |
 и скорость обратной реакции
и скорость обратной реакции  равны друг другу. Согласно закону действующих масс,
равны друг другу. Согласно закону действующих масс, (1.2)
(1.2)