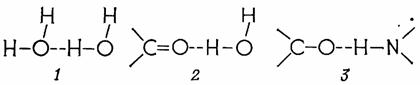|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ХИМИЧЕСКИЕ СТРОИТЕЛЬНЫЕ БЛОКИ
Химическим признаком живого служат органические соединения, которые чрезвычайно многообразны. Но только четыре класса органических веществ имеют всеобщее биологическое значение: белки, нуклеиновые кислоты, углеводы и липиды. Они являются структурными элементами живой материи, а также ее функциональными элементами, так как играют важную роль в процессах метаболизма.
2.1 ХИМИЧЕСКИЕ СВЯЗИ И ВЗАИМОДЕЙСТВИЯ МЕЖДУ МОЛЕКУЛАМИ В органических молекулах атомы связаны ковалентно; орбитали соседних атомов перекрываются, так что формально возникает общая пара электронов (например, Н3С: СН3, или Н3С – СН3). Если один из связанных атомов более электрофилен (кислород, азот), то максимум электронной плотности смещается ближе к этому атому и образуется полярная группа, обладающая дипольным моментом (например, –С=О или – ОН). Молекула воды тоже представляет собой полярную дипольную молекулу. Для структуры живых систем большое значение имеют связи и взаимодействия междумолекулами, рассмотренные ниже. Органические молекулы могут соединяться ковалентными связями. Например, при отщеплении воды образуется сложный эфирили же ацеталь (в частном случае – гликозид), при отщеплении водорода между двумя SH-группами возникает дисульфидная связь(– S – S –). Ковалентная связь в большинстве случаев прочная и лишь очень редко (например, в клеточной стенке) может быть очень слабой. Ионная связь основана на электростатическом взаимодействии между отрицательно заряженной группой одной молекулы (например, – СОО– или –РО3Н2–) и положительно заряженной группой (например, NH3+) другой молекулы. Взаимодействие ион-диполь. Между ионизированными группами (катионами, анионами) и диполями действует электростатическое притяжение, в результате которого ионы гидратируются,т. е. окружаются дипольными молекулами воды. Ионизированные группы гидрофильны (притягивают воду). Особенно важным видом дипольных взаимодействий являются водородные связи. Атом водорода, связанный с сильно электроотрицательным атомом (О, N), приобретает такой сильный положительный заряд (возникает диполь!), что может образовать вторую связь с другим электроотрицательным атомом (рис. 2.1). Подобным же образом связываются друг с другом молекулы воды.
Рис. 2.1 – Образование водородной связи.Водородные связи между молекулами воды (1), между органической молекулой и водой (2) и между двумя органическими, например белковыми, молекулами (3)
Взаимодействия Лондона – Ван-дер-Ваальса – это слабые силы притяжения между неполярными молекулами или частями молекул. Колебания атомов (например, электрические моменты, создаваемые электронами) или групп атомов (например, тепловые вибрации) индуцируют подобные же колебания в соседних молекулах (резонанс). Гидрофобные взаимодействия. Неполярные молекулы и части молекул (например, углеводородные цепи), если они находятся в полярном растворителе (таком, как вода), прочно удерживаются вместе. Это обусловлено тем, что неполярные молекулы и части молекул не взаимодействуют с молекулами воды. Поэтому в водном растворе они нарушают гомогенную структуру воды в результате разрыва водородных связей, что приводит к повышению упорядоченности системы (уменьшению энтропии). Водородные связи образуются снова, и либо происходит удаление неполярных молекул из раствора (образование масляной пленки на поверхности воды), либо окружающая вода сжимает эти молекулы друг с другом так, чтобы площадь соприкосновения возникающего гидрофобного пространства с полярным раствором оставалась минимальной. В обоих случаях достигается состояние наименьшей упорядоченности (максимальной энтропии) в соответствии со вторым законом термодинамики – законом энтропии. Поэтому неполярные молекулы или их части нерастворимы в воде, т.е. гидрофобны. Молекулы с гидрофильной (ионизированной или полярной) и гидрофобной частями (например, липиды,) называются амфипатическими. В водных растворах гидрофобные части молекул сжимаются в замкнутый слой, в то время как гидрофильные части поворачиваются к полярному растворителю и вступают с ним во взаимодействие.
БЕЛКИ Белки (протеины) представляют собой макромолекулы с молекулярной массой от 10 000 до нескольких миллионов. Основные функции белков в живых системах: 1. Структурная, строительная (креатин – белок волос, ногтей, чешуи и т.д.); 2. Каталитическая – белки ферменты (амилаза, трипсин); 3. Транспортная (гемоглобин, транспортирующий кислород, транспортные белки, переносящие вещества через клеточную мембрану); 4. Сократительная (актин и миозин – сократительные белки мышц); 5. Регуляторная (белок-репрессор, регулирующий активность транскрипции); 6. Информационная – белки-гормоны (инсулин); 7. Защитная – белки-антитела иммунной системы; 8. Энергетическая, запасная (белок молока – казеин, яичный альбумин); 9. Рецепторная (родопсин); 10. Белки-токсины (у змей, бактерий); 11. Белки-антибиотики (у растений).
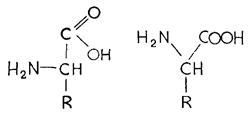
2.2.1 Аминокислоты Структурными блоками белков служат аминокислоты. Молекула аминокислоты обладает одновременно аминогруппой (– NH2) и карбоксильной группой (– СООН) (рис. 2.2). Помимо значительного числа аминокислот, лишь изредка встречающихся в белках, существует 20 протеиногенных аминокислот, из которых в основном построены все белки. Протеиногенные аминокислоты являются α-аминокислотами и имеют L-конфигурацию (исключение составляет оптически неактивный глицин). По строению боковой цепи (R на рис. 2.2) аминокислоты разделяют на 7 групп: 1) алифатические нейтральные (например, глицин); 2) алифатические гидроксиамино-кислоты (например, серин); 3) серосодержащие (например, цистеин); 4) кислые аминокислоты и их амиды (например, аспарагиновая кислота и др.); 5) основные (например, лизин и др.); 6) ароматические и гетероароматические (например, фенилаланин и др.); 7) иминокислоты (пролин). Боковые цепи могут быть гидрофобными (например, у алифатических нейтральных аминокислот и фенилаланина) или гидрофильными (например, у кислых или основных аминокислот).
Рис. 2.2 – Аминокислоты – общая формула
Дата добавления: 2014-09-29 | Просмотры: 1880 | Нарушение авторских прав |