|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
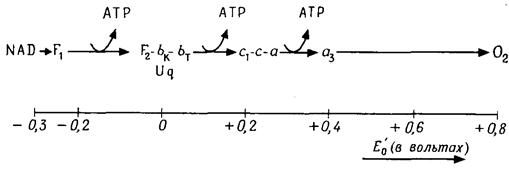
Биологическое окислениеОсновной источник энергии для синтеза АТР при дыхании – это окисление кислородом водорода (связанного с коферментом), получаемого в результате гликолиза, окисления пирувата и реакций цикла лимонной кислоты, а иногда и пентозофосфатного цикла. Каждая реакция окисления (отдача электронов) сопряжена с восстановлением (принятием электронов), так что мы всегда имеем дело с окислением-восстановлением. Н2 ® 2Н+ + 2е– (окисление) 0,5×О2 + 2е– ® О2– (восстановление) H2+O2 ® 2Н++ О2- = Н2О (окисление-восстановление) Системы Н2/2Н+, О2–/0,5·О2 являются окислительно-восстановительными системами. Окисление-восстановление – это перенос электронов от одной окислительно-восстановительной системы к другой. Окислительно-восстановительные системы с большим сродством к электронам («акцепторы электронов») имеют склонность принимать электроны (например, О2– ® 0,5×О2+2е–), а с малым сродством («доноры электронов») – отдавать их (Н2×®×2Н++ 2е–). Переход электронов от вещества с более низким сродством к веществу с более высоким сродством к электронам (от донора к акцептору) – экзергонический процесс, протекающий самопроизвольно с выделением энергии. Перенос электронов в противоположном направлении – эндергонический процесс. Сродство к электронам измеряется как окислительно-восстановительный потенциал (ОВП). Отрицательный ОВП означает низкое сродство к электронам, положительный – высокое сродство. В биологии используют стандартный ОВП (нормальный потенциал) Е'0 [при 25°С, 1 моль/л, 1 атм (= 1,013 бар), рН 7], в химии – Е0 (те же условия, но рН = 0). Для системы Н2/2Н+ Е'0 = – 0,42 В, для системы О2-/0,5·О2 Е'0 = +0,81В. Самопроизвольный, экзергонический перенос электронов происходит по направлению от более отрицательного к более положительному окислительно-восстановительному потенциалу, например Н2/2Н+ ® О2-/0,5·О2 Чем больше разница в ОВП между двумя окислительно-восстановительными системами, тем больше количество освобождаемой энергии (–DG0'). Окислительно-восстановительная система NAD-H/NAD имеет ОВП –0,32 В. Разность потенциалов по отношению к кислороду (Е0' = 0,81 В) велика: DЕ'0 = 1,13 В, откуда DG°' = 218 кДж/моль. Между NAD-H и О2 располагается цепь транспорта электронов, или цепь дыхания. Такие цепи состоят из ряда окислительно-восстановительных систем, которые последовательно передают друг другу электроны. Благодаря этому большая разность ОВП (1,13В) дробится, так же как и освобождающаяся энергия, на несколько «раздаточных пунктов», где энергия может передаваться системе ADP–АТР. Дыхательная цепь состоит из оксидоредуктаз(рис. 4.8) – дегидрогеназ, флавопротеидов, убихинона, цитохромов и белков, содержащих железо и серу. Некоторые из этих белков транспортируют только электроны (е–), другие – водород (е–+Н+).
Рис. 4.8 – Цепь дыхания. Расположение и окислительно-восстановительные потенциалы компонентов цепи дыхания (упрощено). F1, F2 – флавопротеиды FpDl и FpD2; Uq – убихинон; от bK до а3 – цитохромы
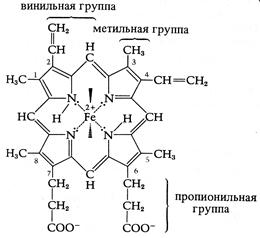
В основном они образуют мультиферментные комплексы, будучи интегральными белками внутренней мембраны митохондрий; только большая часть дегидрогеназ слабо связана с внутренней стороной мембраны: это ее периферические белки. Дегидрогеназы переносят водород с субстрата на свой кофермент, в большинстве случаев NAD+, который слабо связан с ферментом в качестве его косубстрата: Субстрат – Н2 + NAD+ ®Субстрат + NAD-H + H+ (4.16) Флавопротеиды в качестве простетической группы используют FAD, реже FMN (флавинмононуклеотид). Оба фермента содержат рибофлавин (витамин В2). Уравнение реакции: NAD-H + H+ + FAD ® NAD+ + FAD-Н2 (4.17) Водород от NAD-H последовательно переходит к двум флавопротеидам –FpDl и FpD2 (рис. 4.8). Другие флавопротеиды являются дегидрогеназами и принимают водород непосредственно от субстрата (например, от сукцината): Субстрат-Н2+FAD®Субстрат + FAD-Н2 (4.18) Убихинон(Uq, кофермент Q) растворим в липидах. Предполагаемая реакция: FAD-Н2 + Uq ®FAD + UqH2 (4.19) Цитохромы используют в качестве коферментов железопорфирины (гемы), переносящие электроны.Порфирины представляют собой кольцевые структуры из четырех пиррольных колец с центральным атомом металла (рис. 4.9). В цитохроме центральный атом железа путем изменения своей валентности осуществляет перенос электронов: Fe3+ + e– ® Fe2+.
Рис. 4.9 – Простетическая группа цитохромов
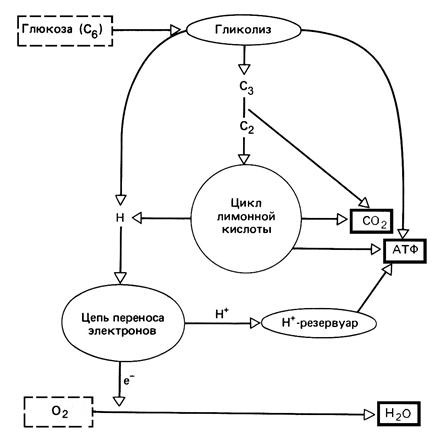
Дыхательная цепь содержит у животных цитохромы bк, bт, с1, с, а и а3. У растений отличия невелики, у бактерий более значительны. При переходе электронов от цитохрома к цитохрому валентность железа все время изменяется. Белки, содержащие железо и серу, в которых железо связано через S, находятся в различных участках цепи дыхания вместе с флавопротеидами и цитохромами и участвуют в транспорте электронов с изменением валентности Fe. Энергия, освобождающаяся при экзергонической диссимиляции, сохраняется (несмотря на большие потери в виде тепла) в форме энергии АТР в результате эндергонического фосфорилированияADP. Фосфорилирование на уровне субстратапроисходит при окислении различных субстратов дегидрогеназами. Фосфорилирование в дыхательной цепипроисходит при окислении одного компонента дыхательной цепи следующим компонентом. При анаэробном брожении фосфорилирование на уровне субстрата – единственный источник энергии для синтеза АТР. В цепи дыхания при движении протона от NAD-Н до O2 освобождается 218 кДж на 1 моль NAD-H. Из этого количества путем образования 3 молей АТРзапасается при стандартных условиях 90 кДж, а в клетке, вероятно, 120 кДж. Ферментный комплекс, образующий АТР, – мембранная АТРаза,находится на внутренней стороне внутренней митохондриальной мембраны. Согласно хемиосмотической гипотезе,поток электронов насасывает протоны через митохондриальную мембрану, и создающийся при этом электрохимический протонный потенциал доставляет энергию для образования АТР. Согласно этой гипотезе, в дыхательной цепи чередуются оксидоредуктазы, переносящие электроны (е–) и переносящие водород (е–+Н+). Они расположены в мембране так, что принятие Н+ может происходить только на внутренней, а отдача – только на наружной стороне. Весь процесс клеточного дыхания можно разделить на три последовательности реакции: гликолиз, цикл лимонной кислоты (ЦТК), цепь переноса электронов (ЦПЭ) (рис. 4.10).
Рис. 4.10 – Расщепление глюкозы в процессе дыхания
Количество АТР, синтезируемой при расщеплении глюкозы при дыхании составляет 38 молекул на каждую молекулу глюкозы (табл. 4.3).
Дата добавления: 2014-09-29 | Просмотры: 1177 | Нарушение авторских прав |