|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
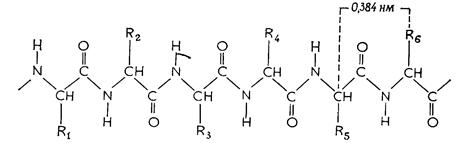
Химическая структура пептидов и белковАминогруппа одной аминокислоты способна вступать в реакцию с карбоксильной группой другой аминокислоты. Формально такая реакция протекает с выделением воды (рис. 2.3). Образующаяся при этом молекула представляет собой пептид, а связь – СО – NH – называется пептидной связью. Дальнейшее присоединение аминокислот с помощью пептидных связей приводит к построению полипептидной цепи с боковыми цепями аминокислот в виде ответвлений (R на рис. 2.3).
Рис. 2.3 – Пептиды. Формальная схема синтеза дипептида (В) в результате образования пептидной связи между двумя аминокислотами (А и Б). Г –отрезок пептидной цепи
Полипептидная цепь полярна, она содержит свободную NH2-гpyппу на аминном конце (N-конце) и свободную СООН-группу на противоположном, карбоксильном, конце (С-конце). Дипептиды содержат два, трипептиды – три, олигопептиды от 2 до 10, полипептиды – более 10 аминокислотных остатков. Белки представляют собой полипептиды, в молекулу которых входят от 100 до нескольких тысяч аминокислот, с молекулярной массой свыше 10 000 и диаметром молекулы от 5 до 100 нм. Протеидами называют белковые соединения с дополнительным компонентом. Чаще всего это низкомолекулярное соединение, которое называют простетической группой. Такие группы имеются у металлопротеидов, фосфопротеидов (содержащих фосфат), хромопротеидов с пигментной группой (например, у гемоглобина), липопротеидов с жироподобным компонентом, гликопротеидов с углеводной частью. Комплексы, в которых белки соединены ионными связями с нуклеиновыми кислотами, называются нуклеопротеидами.
Дата добавления: 2014-09-29 | Просмотры: 1126 | Нарушение авторских прав |