|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ЭНЕРГИЯЭнергия – это «способность производить внешнее действие, т.е. совершать работу». Законы, управляющие превращениями энергии, описывает термодинамика. Ее главные постулаты называются основными законами (началами) термодинамики. Термодинамическая система – это любой участок «Вселенной», отделенный от своего окружения реальной или воображаемой преградой. Гомогенная система во всех своих областях обладает одинаковыми макроскопическими свойствами. Гетерогенная система составлена из различных гомогенных фаз. По виду обмена веществом или энергией с окружающей средой различают: 1) изолированные системы: никакой обмен не возможен; 2) адиабатические системы: невозможен обмен веществом, но возможен обмен энергией, кроме тепловой; 3) замкнутые системы: невозможен обмен веществом, но обмен энергией возможен в любой форме; 4) открытые системы: возможен любой обмен веществом и энергией. Все клетки и все живые организмы являются гетерогенными открытыми системами. Положения классической термодинамики относятся только к равновесным состояниям или к обратимым процессам в замкнутых системах. Только развитие термодинамики необратимых процессов сделало возможным количественное описание необратимых процессов, протекающих в организме как в одной из открытых систем, не находящихся в термодинамическом равновесии.
1.3.1 Применимость закона сохранения энергии к живым организмам Первый закон термодинамики в формулировке Майера-Гельмгольца гласит: при всех изменениях, происходящих в изолированной системе, общая энергия системы остается постоянной. Другая формулировка: при всех макроскопических химических или физических процессах энергия не создается и не разрушается, а только переходит из одной формы в другую. Запас энергии системы состоит из внешней энергии, определяемой внешними параметрами (положение в пространстве, скорость относительно других систем и т. п.), и внутренней энергии, зависящей от собственных внутренних параметров данной системы. Изменение внутренней энергии U замкнутой системы при изменении состояния складывается из количества тепла Q, обмененного при этом с окружающей средой, и работы W. Первый закон: Изменение внутренней энергии системы может быть представлено как
(– pdVпотому, что при + dV, т. е. увеличении объема, система совершает работу и, согласно определению, dW отрицательно). dQ также можно представить как произведение интенсивной величины (температура Т) и экстенсивной величины (энтропия S). Отсюда следует уравнение Гиббса:
И.Р. Майер и Г. Гельмгольц, открывшие первый закон термодинамики, не сомневались в том, что действие этого закона распространяется и на процессы в живых организмах. Многие виталисты, напротив, полагали, что функции живых существ могут быть неподвластны этому закону. Однако в многочисленных опытах было установлено, что общее количество энергии, которое получает растение, животное или человек за некоторый промежуток времени, впоследствии вновь обнаруживается, во-первых, в выделяемом тепле, во-вторых, в совершаемой внешней работе или выделяемых веществах и, в-третьих, в увеличении теплоты сгорания тела в результате роста или накопления вещества.
1.3.2 Энтропия и жизнь Согласно первому закону термодинамики, каждый процесс в природе мог бы протекать так же легко в обратном направлении, как и в прямом. В действительности природные процессы протекают «самопроизвольно» только в одном направлении, они необратимы, т.е. их нельзя заставить идти в обратную сторону, не изменяя окружающую среду. Теплота «самопроизвольно» переходит от более теплого тела к более холодному, но не наоборот. Растворенные частицы распространяются путем диффузии из области более высокой концентрации в область более низкой концентрации, но не наоборот. Газ в вакууме расширяется и никогда не уменьшает самопроизвольно свой объем. В качестве меры необратимости оказалось пригодным понятие энтропии, введенное в 1859 г. Клаузиусом. В высокой степени необратимый процесс характеризуется большим увеличением энтропии. В изолированной системе (без обмена теплом!) энтропия никогда не может уменьшаться, она только возрастает (при необратимых процессах) или, в предельном случае, остается постоянной (при обратимых процессах). Это второй закон термодинамики (закон энтропии): dS ≥ 0 (в изолированной системе!). Все процессы, самопроизвольно протекающие в природе, способствуют установлению равновесия. Это наиболее вероятное состояние с наименьшей упорядоченностью частиц. Каждое упорядоченное состояние (с различиями в концентрации, температуре, давлении и др.) стремится к наименьшей упорядоченности (выравнивание различий означает увеличение энтропии). Поэтому энтропию можно рассматривать как меру неупорядоченности, и второй закон в формулировке Больцмана (1866) гласит: природа стремится перейти из менее вероятного состояния в более вероятное. Это справедливо и для природы в целом (Вселенной), и для любой другой изолированной системы как вероятностное утверждение с тем большей точностью, чем больше число частиц, составляющих систему. Организмы постоянно создают из беспорядка упорядоченность. В них создается и поддерживается физическое и химическое неравновесие, на котором основана работоспособность живых систем. В процессе индивидуального развития (онтогенеза) каждого живого организма, так же как и в процессе эволюционного развития (филогенеза), все время образуются новые структуры, т.е. достигается состояние более высокой упорядоченности. Это кажущееся противоречие с законом возрастания энтропии объясняется тем, что организмы – не изолированные, а открытые системы, непрерывно обменивающиеся веществом и энергией с окружающей средой. Изменение энтропии в открытой системе складывается 1) из ее изменений при процессах, происходящих в самой системе (diS), и 2) из изменений при обмене веществом и энергией с окружающей средой (deS):
Согласно второму закону, diS может быть только положительным или, в предельном случае (обратимые процессы), равным нулю; напротив, deS может принимать положительные (система получает энтропию) или отрицательные (система отдает энтропию) значения:
При этом изменение энтропии dS в открытой системе может быть и отрицательным (упорядоченность увеличивается!), а именно когда deS < 0 и |deS| > |diS|, т.е. когда систему покидает больше энтропии, чем возникает внутри системы благодаря необратимым процессам. Для системы «живой организм - окружающая среда» (среда, из которой берутся питательные вещества и которой отдаются продукты обмена) второй закон термодинамики действителен в своей классической форме, т.е. ее энтропия возрастает и никогда не уменьшается. Таким образом, живые организмы могут создавать внутри себя упорядоченность только за счет того, что они уменьшают упорядоченность в окружающей их среде. Конечно, живые организмы существуют не только за счет отрицательной энтропии, но и за счет положительной энергии. В стационарном состоянии содержание внутренней энергии в системе также постоянно и не зависит от времени. Любая потеря внутренней энергии при осуществлении внешней работы или отдаче тепла должна быть компенсирована соответствующим притоком энергии.
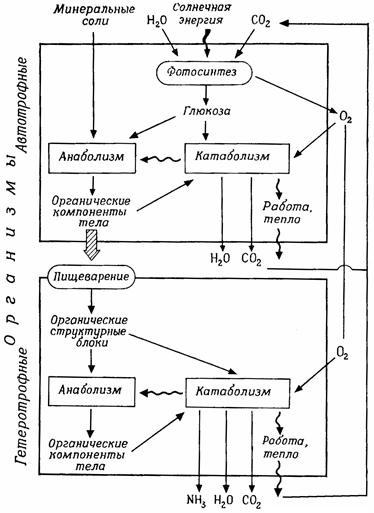
1.3.3 Источники энергии живых организмов В соответствии с законом сохранения энергии все функции живого организма, требующие затраты энергии, должны в конечном счете осуществляться за счет внешних источников энергии, которые бывают двоякого рода. Автотрофные организмы, которые мы находим только в царстве растений и среди прокариот (бактерии, синезеленые водоросли), могут создавать органические соединения (прежде всего углеводы из СО2 и Н2О) из неорганических веществ, используя дополнительный источник энергии. Для зеленых растений таким источником служит солнечный свет, а для некоторых бесцветных бактерий – окисление неорганических веществ (хемосинтез). Гетеротрофные организмы (все животные, включая человека, все грибы, многие бактерии) должны использовать в качестве источника энергии органические «питательные вещества». Они не могут создавать органические соединения из неорганических и живут за счет автотрофных организмов и их биосинтетических процессов (рис. 1.2). Многие автотрофные организмы развиваются, используя в качестве единственного органического вещества глюкозу, а в качестве источника азота довольствуются NH4+ или NО3–. Животным необходим и азот в органической форме (аминокислоты, белки). В соответствии с используемой ими пищей виды объединяются в пищевые цепи, в начале которых стоят автотрофные растения. Первичным источником энергии для жизни на Земле служит, таким образом, солнечная энергия. Каждую секунду Солнце излучает 3,9·1026 Дж энергии. Из общей энергии солнечного излучения Земли достигает лишь ничтожная доля – 1,78·1017Дж/с. Из этого количества энергии 30% отражается поверхностью атмосферы, а по пути через атмосферу поглощается еще 25%, так что поверхности Земли достигает всего лишь около 45% солнечного излучения. Общая энергия излучения, падающего на поверхность Земли, равна 0,80·1017Дж/с. Около 45% этой энергии приходится на спектральную область между 380 и 740 нм (эта часть энергии может использоваться растениями для
Рис. 1.2 – Взаимоотношения между анаболизмом и катаболизмом у автотрофных и гетеротрофных организмов (анаболизм – построение веществ тела; катаболизм – расщепление питательных веществ)
фотосинтеза). Среднюю степень использования света растениями на Земле оценивают в 0,25% (для культурных сельскохозяйственных растений до 2–3%); таким образом, в среднем в ассимилятах растений на всей Земле за 1 с связывается количество энергии около 9·1013 Дж, что составляет 0,05% солнечного излучения на границе атмосферы. Этому соответствует образование сухой массы 4,8×109 г/с = 1,5×1014 кг в год. Эту мизерную долю солнечной энергии используют растительноядные животные. На следующей ступени пищевой цепи – в животных тканях – мы находим только около 15% «съеденной» энергии. На каждой из последующих ступеней опять теряется около 80–90% энергии. В конечном итоге вся поглощенная лучистая энергия снова возвращается в мировое пространство в виде длинноволнового излучения («равновесие фотонных потоков» в системе Земли).
1.3.4 Получение энергии в живых организмах Для всех живых организмов органические вещества (прежде всего углеводы, а также жиры и отчасти белки) с их химической энергией служат «горючим материалом», из которого извлекается вся энергия, необходимая для многообразных функций организма. Автотрофные организмы сами синтезируют это «горючее», гетеротрофные получают его от автотрофных. При распаде органических веществ химически связанная энергия освобождается (катаболизм, диссимиляция). Этот распад может происходить – во многих случаях без участия кислорода (при анаэробном обмене) – к конечным органическим продуктам, относительно богатым энергией, таким как органические кислоты или этанол (брожение), а при использовании кислорода (аэробный обмен) – к бедным энергией конечным продуктам СО2 и Н2О (дыхание). Таким образом, при дыхании освобождается значительно больше энергии. По своему общему уравнению дыхание сходно с горением (для глюкозы: С6Н12О6 → 6О2 = 6СО2+6Н2О). Однако при горении важнейшим процессом, доставляющим энергию, является окисление углерода до СО2, тогда как при дыхании СО2 образуется без существенных изменений в энергии путем отщепления от органических кислот (декарбоксилирование). В процессе дыхания энергия постепенно, малыми порциями, освобождается при образовании воды из кислорода воздуха и водорода, получаемого при дегидрировании субстратов.
1.3.5 Живые организмы и машины Живые организмы часто сравнивают с машинами, так как те и другие могут выполнять внешнюю работу в результате протекающих в них процессов преобразования энергии. Но в отличие от всех систем, работающих за счет тепловой энергии, живые организмы работают при изотермических условиях, без больших разностей температур; содержащаяся в «топливе» энергия прямым путем, не преобразуясь предварительно в тепло, производит полезную работу. Поэтому все организмы называют хемодинамически работающими системами. Энергию организмы используют 1) для совершения внутренней работы – создания и поддержания структур и 2) для осуществления внешней работы. В случае машин тоже можно различать работу по восстановлению изношенных структур (ремонт) и внешнюю работу. Но у них оба компонента независимы друг от друга, и работу по ремонту выполняет, как правило, не сама машина. Живые организмы осуществляют оба процесса сами, одновременно и в тесной связи их между собой. Машина при простое не выполняет работу, не нуждается в притоке энергии и практически не изменяется; ее можно в любое время привести в действие. Живым организмам энергия нужна даже тогда, когда они не выполняют никакой внешней работы: их лабильные структуры могут поддерживаться только при непрерывной затрате энергии. Этой своей динамичностью все живые организмы существенно отличаются от машин, представляющих собой неподвижные, статичные системы с фиксированной конструкцией. При перерыве в снабжении живого организма энергией наступает необратимая утрата его структуры – смерть. В живых организмах нельзя провести резкое различие между структурными материалами и «топливом». Они представляют собой системы, которые сами себя строят, поддерживают в рабочем состоянии, ремонтируют, регулируют и воспроизводят во многих экземплярах и уже, поэтому в основе своей отличаются от машин.
Дата добавления: 2014-09-29 | Просмотры: 1539 | Нарушение авторских прав |
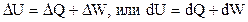 (последнее при бесконечно малых изменениях).
(последнее при бесконечно малых изменениях). (1.3)
(1.3) (1.4)
(1.4) (1.5)
(1.5)