 |
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Нарушение диффузии и перфузии в легких, причины, механизмы развитияВ норме соотношение между величинами вентиляции и перфузии сопряжены как в отдельных областях, так и в лёгких в целом: кровоток реализуется в тех участках лёгкого, в которых осуществляется вентиляция. При этом соотношение перфузии и вентиляции оптимально. Именно в указанных участках лёгкого происходит газообмен между воздухом альвеол и кровью, протекающей по межальвеолярным капиллярам. Это обеспечивает такое отношение выделения лёгкими СО2 к потреблению О2, которое адекватно дыхательному коэффициенту, отражающему интенсивность обмена веществ (эти коэффициенты — вентиляционно-перфузионный и дыхательный — в норме равны примерно 0,8). Нарушение сопряжения вентиляции и перфузии лёгких приводит к развитию дыхательной недостаточности. Количественная зависимость между вентиляцией (V) и перфузией (Р) лёгких выражается показателем V/Р, который в норме колеблется в диапазоне 0,8—1,0. Причины нарушения диффузии газов в легких:
где V - количество газа, диффундирующего за единицу времени; К - коэффициент диффузии; S — общая площадь, через которую происходит диффузия; l - толщина мембраны; Р1 и Р2 - парциальное давление газов по обе стороны мембраны. Исходя из этого, можно выделить следующие причины нарушений диффузии газов в легких: 1) уменьшение коэффициента диффузии. Величина его зависит как от природы газа, так и от среды, в которой происходит диффузия. Практически имеет значение уменьшение коэффициента диффузии кислорода в связи с изменением свойств легочной ткани. При этом переход СО2 из крови в альвеолы, как правило, не меняется, поскольку коэффициент его диффузии очень высокий (в 20-25 раз выше, чем кислорода); 2) уменьшение площади диффузии. Имеет место при уменьшении дыхательной поверхности легких; 3) увеличение толщины альвеолокапиллярной мембраны; 4) уменьшение разности между парциальным давлением газов в альвеолярном воздухе и их напряжением в крови легочных капилляров. Такая ситуация возникает при всех нарушениях вентиляции легких; 5) уменьшение времени контакта крови с альвеолярным воздухом. Диффузия кислорода нарушается в том случае, если время контакта становится меньше 0,3 с. Причины нарушений легочной перфузии : Нарушения кровообращения в легких (легочной перфузии) могут быть вызваны следующими причинами: а) уменьшением давления в правом желудочке (недостаточность правого сердца, уменьшение венозного возврата при кровопотере, шоке, коллапсе); 6) увеличением давления в левом предсердии (стеноз отверстия митрального клапана, левожелудочковая недостаточность сердца); в) увеличением сопротивления сосудов малого круга кровообращения. Последнее может быть обусловлено рефлекторным увеличением тонуса артериол легких, увеличением вязкости крови, наличием преград для движения крови (тромбоз, эмболия). Механизмы развития: Нарушение диффузии. При нормальном легочном кровотоке на объемы диффундируемых из альвеол в капилляры и обратно газов влияют: а) диффузионный путь газов, который складывается из толщины стенок альвеолы, капилляра и толщины интерстициального пространства между альвеолой и капилляром, — увеличивается при хронических диффузных воспалительных процессах в легочной ткани, сопровождающихся повышенным синтезом коллагеновых и эластических волокон, и при отеке легких; проницаемость альвеолокапиллярной мембраны — увеличивается под действием медиаторов воспаления при пневмониях, шоке, альвеолитах и др.; б) общая площадь диффузионной поверхности альвеол и капилляров — уменьшается при хронической эмфиземе легких; в) время контакта газов с кровью — уменьшается при гипоперфузии легочных капилляров. В указанных случаях возникают нарушения диффузии кислорода из альвеол в кровь. Коэффициент диффузии углекислого газа в 20 раз выше, чем кислорода, поэтому при преобладании диффузионных нарушений имеет место артериальная гипоксемия и отсутствует гиперкапния. Нарушение перфузии. Данная форма дыхательной недостаточности обусловлена первичным снижением минутного объема крови в сосудах малого круга в результате нарушений кровообращения и микроциркуляции в легочном круге кровообращения. Острые нарушения перфузии легких развиваются при: а) тромбоэмболии легочной артерии (ишемия легких приводит к снижению давления в легочных капиллярах); б) шунтировании крови (открытый аортальный проток, несращение межжелудочковой перегородки и др. — также наблюдается ишемия малого круга); в) отеке легких, при котором жидкая часть крови может выходить в альвеолы вследствие: повышения давления в легочных капиллярах (в результате левожелудочковой сердечной недостаточности возникает венозная гиперемия сосудов малого круга); повышенной проницаемости стенки альвеол и капилляров, что наблюдается при шоке, вдыхании веществ, повреждающих альвеолы (аммиак), воспалении легочной ткани и др.; уменьшения онкотического давления крови (гипопротеинемия — потеря белка при патологии почек, печени, кишечника и т.д.). Хроническое нарушение перфузии капилляров легких кровью возникает в финале хронических воспалительных заболеваний легких и мелких дыхательных путей, которые вызывают большинство случаев хронической дыхательной недостаточности (туберкулез легких, фиброзируюшие альвеолиты, неконтролируемая бронхиальная астма с исходом в эмфизему, хронический обструктивный бронхит и др.). При этом уменьшается масса легочной паренхимы, происходит ее замещение соединительной тканью (пневмофиброз, пневмосклероз). Уменьшается суммарный радиус капилляров в легких. В результате согласно закону Пуазейля возрастает сопротивление кровотоку в малом круге кровообращения. Перфузия легких снижается. Это сопровождается ростом давления в легочной артерии (легочная гипертензия). В результате возрастает нагрузка давлением на правый желудочек, что приводит к его гипертрофии — развивается легочное сердце, т.е. к дыхательной присоединяется сердечная недостаточность. Нарушение перфузии сосудов легких кровью приводит к увеличению объема функционального мертвого пространства, так как возрастает количество вентилируемых, но не перфузируемых альвеол. В таких альвеолах газообмен невозможен, хотя их вентиляция и происходит. В результате нарушается оксигенация крови, хотя выведение углекислого газа в силу его высокой диффузионной способности, как правило, не нарушается. Т.о., данная форма дыхательной недостаточности обычно характеризуется развитием артериальной гипоксемии без гиперкапнии. 34. Нарушения обработки пищи в полости рта, причины, патогенез, последствия. Понятие о гипер- и гипосаливации.
Проявляются расстройствами механического измельчения и перемешивания пищи с участием зубов, челюстей, нижнечелюстных суставов, жевательных мышц, языка, а также ее смачивания, пропитывания, набухания и растворения различных веществ и формирования пищевого комка с участием слюны. Основные формы патологии ротовой полости: 1) расстройства зубо-челюстного жевательного аппарата чаще всего возникают в результате воспалительных, деструктивных и дистрофических процессов жевательных мышц, слизистых ротовой полости, миндалин, десен, десневых карманов, околозубных тканей, надкостницы, самих зубов, особенно их твердых тканей (эмали и дентина) на фоне дефицита антибактериальных ферментов не только слюны, но и мигрирующих в полость рта лейкоцитов (лизоцима, нуклеазы, РНК-азы, ДНК-азы, калликреина, фосфатазы, пероксидазы), а также иммуноглобулинов, трофогенов, витаминов, макро- и микроэлементов: а) кариес зубов - заболевание, характеризующееся прогрессирующей деструкцией (разрушением) твердых тканей зуба на ограниченных его участках, которое приводит к образованию дефекта в виде постепенно увеличивающейся полости; б) пульпит - воспаление пульпы (рыхлой соединительной ткани), заполняющей полость зуба; в) периодонтит - воспалительный процесс в околозубной ткани; г) пародонтоз -заболевание воспалительно-дистрофического характера, основу которого составляет прогрессирующая резорбция костных тканей зубных альвеол, образование патологических зубодесневых карманов, а также воспаление десен, приводящие к расшатыванию и выпадению зубов; д) гингивит - воспаление слизистой оболочки десны; е) стоматит - воспаление слизистой оболочки полости рта. 2) нарушения слюноотделения могут быть количественные (повышение - гиперсаливация и понижение - гипосаливация) и качественные (изменения состава слюны).. Последние проявляются изменениями количества и активности различных ферментов (гликозидаз: а-амилазы и мальтазы; протеаз: нуклеаз, катепсинов, калликреина; гидролазы: лизоцима или мурамидазы; пероксидазы, фосфатазы), иммуноглобулина А, макро- и микрофагов, гормонов (глюкокортикоидов, глюкагона и др.), ФАВ (паротина, ответственного за регуляцию обмена кальция в зубах и скелете; тонина, урогастрона, фактора летальности и др.), муцина, белков и других азотсодержащих веществ, неорганических веществ (катионов, анионов) и воды. Гиперсаливация - повышение выделения слюны обычно пониженной вязкости. Возникает при стоматитах, гингивитах, действии никотина и различных лекарств, активизирующих блуждающий, лицевой, языкоглоточный, тройничный нервы и тормозящих симпатическую нервную систему, интоксикациях, токсикозе беременных, гельминтозах, неврозах, энцефалитах. Обычно сопровождается снижением кислотности желудочного сока (в результате его ощелачивания обильной слюной). Это приводит к уменьшению его бактерицидных свойств, угнетению процессов переваривания белков в желудке, ускорению эвакуации химуса из него в двенадцатиперстную кишку, возникновению и усилению процессов гниения и брожения в желудке, развитию инфекционных повреждений органов пищеварительного тракта. Возможно и развитие гипогидратации организма. Гипосаливация - снижение выделения слюны чаще повышенной вязкости. Возникает при: хронических инфекционно-воспалительных заболеваниях околоушных (серозных), подчелюстных и подъязычных (серозно-слизистых) слюнных желез и их протоков; выраженных и длительных лихорадках различного генеза; обезвоживании организма; хронических стрессах; торможении активности парасимпатической и стимуляции симпатической нервной системы, а также введении лекарств подобного действия (блокаторов М-холинергических и активаторов адренергических структур). При гипосаливации нередко возникает ксеростомия) - сухость во рту, способствующая активации воспалительных, дистрофических, инфекционных и гнилостных процессов в органах и тканях ротовой полости, в частности, - развитию кариеса зубов, стоматита, гингивита, пульпита, пародонтоза, а также нарушению смачивания пищи, формирования пищевого комка и его глотания.
35. Нарушение пищеварения в желудке. Патология секреторной и двигательной функции желудка, причины, патогенез, последствия.
В основе нарушений пищеварения в желудке находятся парциальные, а чаще сочетанные расстройства секреторной, моторной, всасывательной, барьерной и защитной функций желудка. Расстройства желудочной секреции: 1) Изменение общего количества сока (увеличение, уменьшение, отсутствие); 2) нарушение динамики секреции; 3) расстройство выработки и изменение содержания слизи (повышение, уменьшение, прекращение); 4) нарушение образования соляной кислоты и изменения кислотности сока (гиперхлоргидрия, ахлоргидрия, гипохлоргидрия); 5) нарушение образования и секреции пепсина (увеличение, снижение, прекращение). В целом указанные нарушения обусловливают несоответствие динамики и/или уровня секреции различных компонентов желудочного сока текущим реальным потребностям в них. Нарушения динамики и общего объёма секреции желудочного сока: а) тормозной тип - увеличенный латентный период секреции (между пищевой стимуляцией желудка и началом секреции), сниженная интенсивность нарастания и активности секреции, укороченная длительность секреции, уменьшенный объём секрета; при крайней степени торможения секреции развивается ахилия — практическое отсутствие желудочного сока; б) возбудимый тип - укороченный латентный период начала секреции, интенсивное нарастание секреции, увеличенная длительность процесса секреции, повышенный объём желудочного сока; в) инертный тип - увеличенный латентный период, замедленное нарастание секреции, медленное её прекращение, увеличенный объём желудочного сока; г) астенический тип - укороченный латентный период начала сокоотделения, интенсивное начало и быстрое снижение секреции, малый объём желудочного сока; д) хаотический тип - характерно отсутствие каких-либо закономерностей динамики и объёмов секреции, периодов её активации и торможения в течение продолжительного времени (нескольких месяцев и лет), общее количество сока, как правило, увеличено. Виды расстройств желудочной секреции: а) гиперсекреция — увеличение количества желудочного сока, повышение его кислотности и переваривающей способности. Причины: увеличение массы секреторных клеток желудка (детерминируется генетически), активация влияний блуждающего нерва (например, при невротических состояниях), повышение синтеза и/или эффектов гастрина, гипертрофия и/или гиперплазия энтерохромаффинных (энтероэндокринных) клеток (например, при гипертрофическом гастрите), действие некоторых ЛС (например, ацетилсалициловой кислоты или кортикостероидов). Возможные последствия: замедление эвакуации пищевой массы из желудка, эрозии и изъязвления слизистой оболочки желудка, сопровождающийся изжогой гастроэзофагеальный рефлюкс, нарушения пищеварения в кишечнике; б) гипосекреция — уменьшение объёма желудочного сока, снижение его кислотности и расщепляющей эффективности. Причины: уменьшение массы секреторных клеток (например, при гипо- и атрофической форме хронического гастрита или распадающейся опухоли желудка), снижение эффектов блуждающего нерва (например, при неврозах), снижение образования гастрина, дефицит в организме белков и витаминов, действие ЛС, снижающих или устраняющих эффекты блуждающего нерва (например, блокаторов холинорецепторов); в) ахилия — состояние, характеризующееся практически полным отсутствием желудочной секреции. Причина ахилии — значительное снижение или прекращение секреторной функции желудка. Расстройства моторики желудка: 1) изменение тонуса мышц (гипертонус, атония, гипотонус)→расстройства перистолы - схватывания пищевых масс стенкой желудка и формирования порции пищи для внутрижелудочного переваривания→расстройства эвакуации пищи (ускорение, замедление) в 12п кишку; 2) изменение тонуса мышц сфинктера (снижение, вплоть до их атонии; обусловливает длительное открытие — «зияние» кардиального и/или пилорического сфинктеров) и повышения тонуса и спазма мышц сфинктеров (приводят к кардиоспазму и/или пилороспазму)→ расстройства эвакуации пищи (ускорение, замедление); 3) изменение перистальтики (гиперкинез, гипокинез)→ расстройства эвакуации пищи (ускорение, замедление). Причины: нарушения нервной регуляции двигательной функции желудка: усиление влияний блуждающего нерва стимулирует его моторную функцию, а активация эффектов симпатической нервной системы подавляет её; расстройства гуморальной регуляции желудка (высокая концентрация в полости желудка соляной кислоты, а также секретин, холецистокинин тормозят моторику желудка; напротив, гастрин, мотилин, сниженное содержание соляной кислоты в желудке стимулируют моторику); патологические процессы в желудке (эрозии, язвы, рубцы, опухоли могут ослаблять либо усиливать его моторику в зависимости от их локализации или выраженности процесса). Последствия: в результате нарушений моторики желудка возможно развитие синдрома раннего насыщения - результ снижения тонуса и моторики антрального отдела желудка. Приём небольшого количества пищи вызывает чувство тяжести и переполнения желудка; это создаёт субъективные ощущения насыщения; изжоги - ощущение жжения в области нижней части пищевода (результат снижения тонуса кардиального сфинктера желудка, нижнего сфинктера пищевода и заброса в него кислого желудочного содержимого); тошноты - при подпороговом возбуждении рвотного центра развивается тошнота — неприятное, безболезненное субъективное ощущение, предшествующее рвоте; рвоты - непроизвольный рефлекторный акт, характеризующийся выбросом содержимого желудка (иногда и кишечника) наружу через пищевод, глотку и полость рта; Механизмы развития рвоты: усиленная антиперистальтика стенки желудка, сокращение мышц диафрагмы и брюшной стенки, расслабление мышц кардиального отдела желудка и пищевода, возбуждение рвотного центра продолговатого мозга. Значение рвоты: защитное (при рвоте из желудка устраняются токсичные вещества или инородные тела); патогенное (потеря организмом жидкости, ионов, продуктов питания, особенно при длительной и/или повторной рвоте; демпинг-синдрома — патологическое состояние, развивающееся в результате быстрой эвакуации желудочного содержимого в тонкую кишку. Развивается, как правило, после удаления части желудка. Основные звенья патогенеза: 1) г иперосмоляльность содержимого тонкой кишки (в результате попадания в неё концентрированной пищи из желудка); 2) интенсивный транспорт жидкости из сосудов в полость кишечника (по градиенту осмотического давления). Это может привести к учащению стула; 3) развитие гиповолемии; 4) активация синтеза и выделение в межклеточное пространство БАВ, вызывающих системную вазодилатацию (вследствие эффектов серотонина, кининов, гистамина и др.) и артериальную гипотензию, включая коллапс; 5) интенсивное всасывание в кишечнике глюкозы с развитием гипергликемии→стимуляция образования и инкреции избытка инсулина. Гиперинсулинемия активирует массированный транспорт глюкозы в клетки. Однако к этому времени (обычно через 1,5—2 ч после приёма пищи и быстрой эвакуации её из желудка в кишечник) пища уже утилизирована. В связи с этим развиваются нарастающая гипогликемия, дисбаланс ионов, ацидоз→основные проявления: прогрессирующая слабость после приёма пищи, тахикардия, аритмии сердца, острая артериальная гипотензия, сонливость, головокружение, тошнота, мышечная дрожь (особенно конечностей), нарушения сознания.
36. Нарушения пищеварения в кишечнике. Патология полостного и пристеночного пищеварения, причины, механизмы развития, последствия.
Проявляется расстройствами секреторной, моторной, инкреторной, всасывательной, экскреторной, эвакуаторной и защитной функций. При их нарушении, особенно секреторной и моторной функций, развиваются разнообразные расстройства внутриполостного, премембранного, мембранного и внутриклеточного гидролиза пищевых веществ с участием эндо-и экзогидролаз, особенно в условиях нарушенного оптимального рН не только в кишечной полости, но и в гликокаликсе мембран микроворсинок и внутри клеток слизистой различных отделов тонкой кишки. Нарушения полостного пищеварения обусловлены: повреждением секреторных клеток, расстройством образования в них, выделения ими и активации в полости кишок, г.о., ферментов поджелудочной железы, а также ферментов тонкой кишки и изменением количества желчных кислот желчи. 1) Дефицит количества поджелудочного сока. Причины: повреждение поджелудочной и ее протоков м/о, токсическими веществами, алкоголем, ЛС; при развитии ЖКБ, дуоденита, панкреатита, опухолей при переедании животными жирами; нарушении общего и местного кровообращения, дыхания, энергетического и пластического обменов; аутоиммунных процессах, расстройства нервных механизмов регуляции, интенсивный и длительный стресс, болевой синдром, физическое переутомление, токсикоинфекция. 2) Снижение активности трипсина. Причины: дефицит энтерокиназы и ионов кальция, и как следствие дефицит химотрипсина. 3) Угнетение образования активной липазы. Причины: закисление кишечного содержимого и дефицит желчных кислот. 4) Снижение образование различных активных гликозидаз (α-амилазы, γ-амилазы, мальтазы, сахаразы, лактазы). Причины: снижение рН содержимого кишок→в полости кишок накапливаются полисахариды, декстрины и неактивные гликозидазы, приводящие к уменьшению образования ди- и моносахаридов. 5) Уменьшение или отсутствие поступление желчи в полость 12п кишки (гипохолия или ахолия). Причины: нарушение питания, повреждение гепатоцитов, снижение моторики и проводимости желчевыводящих путей (вследствие их воспаления, сдавления извне, закупорки изнутри, повреждения мышечных структур их стенок или расстройства нервно-гуморальной регуляции); дефицит интестинальны пептидов: холецистокинина, секретина, глюкагона. Наибольшие расстройства полостного переваривания жиров в кишках наблюдается при сочетании дефицита желчи и панкреатического сока. Это всегда сопровождается развитием стеатореи, т.е. повышением содержания в полужидком или жидком вонючем кале большого количества нейтрального жира и ЖК. Нарушения мембранного пищеварения обусловлены: повреждениями щеточной (исчерченной) каймы кишечных ворсинок, либо самих ворсинок, тонких кишок; расстройствами образования, выделения, абсорбции на поверхности мембран и обратного всасывания через них, г.о. кишечных, а также панкреатических гидролитических ферментов; нарушениями моторной активности микроворсинок, ворсинок и стенок тонкой кишки, затрудняющей проникновение питательных субстратов в область щеточной каймы ворсинок. Последствия: при патологии премембранного и, особенно, мембранного пищеварения (эффективность которых значительно выше полостного) могут: 1) нарушаться сопряжение процесс ферментативного расщепления питательных веществ до ди- и, особенно, мономеров и процесса всасывания последних через эритроциты в кровь. 2) резко снижаетсяскорость и интенсивность расщепления питательных веществ из-за повреждений ферментно- транспортных комплексов (наряду с нарушениями транспорта мономеров пищи отмечается угнетение транспорта гидролитических ферментов в клетку). 3) повышается проницаемость различных структур щеточной каймы кишечных ворсинок для разных микроорганизмов, полипептидов и белков, оказывающих выраженное токсико-аллергическое действие на организм. Угнетение мембранного пищеварения в тонких кишках может быть наследственного и приобретенного происхождения. Причины приобретенного угнетения мембранного пищеварения: острые и, особенно, хронические дуодениты и энтериты, интоксикации (химические, в том числе лекарственные, биологические, в том числе вирусные, бактериальные, паразитарные, продуктами гниения и брожения), ионизирующая радиация, частичное (особенно за счет дефицита незаменимых аминокислот), неполное и полное голодание, опухоли (добро- качественные, и, главным образом, злокачественные), соединительно-тканные разрастания, дистрофические процессы. Важное место в его развитии занимают недостаточность ведущих исполнительных систем (кровообращения, дыхания, выделения) и регуляторных систем (с участием парасимпатического и симпатического отделов автономной нервной системы, гормонов гипофиза и надпочечников, а также тканевых гормонов, особенно серотонина и гистамина). Последствия: а) при недостаточности пищеварительных (кишечных и панкреатических) ферментов и желчи развивается синдром недостаточности пищеварения в тонких кишках или мальдигестия; б) при недостаточности ферментно-транспортных комплексов в слизистой тонких кишок возникает синдром недостаточности всасывания питательных веществ или мальабсорбция. И то, и другое как порознь, так, особенно, совместно приводят к развитию синдрома недостаточности усвоения клетками как органов пищеварения так и других органов организмаразнообразных питательных веществ или малъассимиляции и, как правило, к развитию стойкой диареи, прогрессирующего исхудания и истощения организма (несмотря на продолжающийся прием полноценной пищи). 37. Этиология и патогенез язвенной болезни. Моделирование язвы в эксперименте.
ЯБ – хроническое рецидивирующее заболевание, характеризующееся образованием язвы в желудке или двенадцатиперстной кишке. Этиология. Основную роль в развитии ЯБ играет Helicobacter pylori, этот м/о выделяют у 90% больных ЯБ 12п кишки и у 60-70% пациентов с ЯБЖ, инфицирование H. Polyri разрушает защитный слизисто-бикарбонатный барьер и повреждает желудочный эпителий, это развивается в результате продукции H. Polyri гидролитических ферментов (уреаз, фосфолипаз, протеаз) и широкого спектра цитотоксических веществ, активации синтеза и высвобождения в инфицированной слизистой оболочке желудка провоспалительных медиаторов (фактора некроза опухолей, ИЛ, гидролаз лизосом). Среди других причин заболевания выделяют: 1) алиментарные погрешности (нарушение режима и характера питания: длительное употребление грубой пищи, еда всухомятку, длительные перерывы между приемами пищи и т.д. – создают условия для активации желудочной секреции при недостаточном количестве принятой пищи); нервно-психический (стрессовый) фактор, повышение секреции желудочного сока и снижение активности защитных факторов (мукопротеидов, бикарбонатов); 2) наличие вредных привычек (курение – увеличивает риск развития заболевания, снижает вероятность заживления пептических язв; никотин обусловливает подавление секреции защитных бикарбонатов, которые обеспечивают быструю нейтрализацию соляной кислоты; злоупотребление алкоголем - алкоголь непосредственно раздражает слизистую оболочку, стимулирует желудочную секрецию и разрушает слизисто-бикарбонатный барьер); 3) наследственные факторы – у ближайших родственников риск возникновения заболевания в 10 раз выше, ревматоидный артрит повышает риск возникновения симптоматических ЯБЖ, что объясняется ульцерогенным эффектом НПВС; 4) физиологические факторы – желудочная секреция имеет существенное значение, но у большинства больных находят нормо- и гипоацидность, а при ЯБЖ кислотность повышена, у больных с ЯБЖ содержание гастрина повышено как натощак, так и после еды, тогда как при доуденальной язве его содержание повышается после приема пищи, рефлюкс желчи в желудок имеет важное значение в снижении защитного барьера слизистой, повреждение защитного барьера позволяет кислому желудочному содержимому вступать в контакт с раздраженной слизистой желудка и повреждать ее; 5) лекарственные факторы – аспирин и другие НПВС подавляют выработку защитных Пг, кортикостероиды подавляют выработку слизи и угнетают регенерацию слизистой желудка. ЯБ является результатом действия множества взаимопотенцирующих этиологических факторов. Патогенез. Согласно современным представлениям, патогенез ЯБ в общем виде сводится к нарушению равновесия между факторами кислотно-пептической агрессии желудочного содержимого и элементами защиты слизистой желудка и двенадцатиперстной кишки, к которым относятся неизменное желудочное слизеобразование (рН 7,76), достаточная выработка панкреатических бикарбонатов, хорошая регенерация эпителиальных клеток, сохранное кровоснабжение слизистой желудка – обеспечивает быструю регенерацию поврежденной слизистой, нормальное содержание простагландинов в стенке желудка. Моделирование язвы в эксперименте. 1) повреждение слизистой желудка физическими или химическими раздражителями (горячая вода, ляпис, касторовое масло, кислоты). При этом в стенке желудка развивается воспаление и изъязвление. Процесс носит острый характер и язвы быстро заживают. 2) нарушение кровообращения в стенке желудка или 12 п кишки (перевязка, эмболия, склерозирование сосудов). кровообращение восстанавливается за счет анастомозов, и образующиеся раны быстро заживают. 3) длительное введение веществ, усиливающих секрецию желудочного сока (гистамин, пилокарпин, физостигмин). 4) хроническое раздражение блуждающего нерва. При этом усиливается секреция желудочного сока и нарушается трофика стенки желудка. 5) нарушение кортикальных механизмов регуляции функции желудка при экспериментальных неврозах. Так, например, у собак ЯБЖ возникала при сочетании срыва нервной деятельности с ежедневным двухчасовым орошением слизистой оболочки желудка желудочным соком. 6) наложение лигатуры на привратник при сохранении его проходимости. В желудке подопытных крыс через 1-2 сут появляются эрозии и иногда и язвы вследствие сдавления сосудов и раздражающего действия лигатуры на блуждающий нерв. Т.о., причиной повреждения слизистой являются нарушения трофики и кровообращения. 7) введение гастроцитотоксической сыворотки. Например, кролика иммунизируют тканью желудка собаки, а полученную сыворотку, содержащую противожелудочные антитела, вводят в/а интактной собаке-рецепиенту. Антитела взаимодействуют с тканью желудка животного-рецепиента и вызывают повреждение этой ткани в результате реакции антиген-антитело. Существуют и другие способы моделирования ЯБ. Полученные в эксперименте язвы в основном быстро заживают. По механизму возникновения и течения они принципиально отличаются от ЯБ человека. Удается моделировать лишь отдельные проявления этого заболевания.
38. Печеночная недостаточность, виды, этиология, патогенез. экспериментальное моделирование печеночной недостаточности. Принципы патогенетической терапии заболеваний печени.
Печеночная недостаточность – стойкое снижение или полное выпадение одной, нескольких или всех функций печени, что приводит к нарушению жизнедеятельности организма. Классификация: 1) Может быть относительная - возникает при первичном повышении нагрузки на печень, когда требования организма по поддержанию гомеостаза превышают функциональные возможности печени и абсолютная – развивается при первичном поражении печени, вследствие чего уменьшаются ее функциональные возможности и она не способна обеспечивать постоянство внутренней среды в обычных условиях. Относительная недостаточность может переходить со временем в абсолютную: повышение нагрузки на печень →относительная недостаточность печени → нарушение постоянство внутренней среды → вторичные поражения печени → абсолютная недостаточность печени. 2) В зависимости от причин повреждения гепатоцитов абсолютная недостаточность печени может быть: печеночно-клеточной - развивается вследствие непосредственного повреждения гепатоцитов, холестатической – развивается вследствие первичных расстройств желчеобразования и желчевыведения, печеночно-сосудистой – развивается в результате первичных нарушений кровообращения в печени. 3) В зависимости от количества функций, которые нарушаются при поражении печени, недостаточность этого органа может быть тотальной (нарушаются все виды функций печени) и парциальной (страдает одна или несколько функций). 4) По клиническому течению: острая и хроническая. Этиология. Причины м.б. собственно печеночными (гепатогенные - патологические процессы и/или воздействия, прямо повреждающие клетки печени) и внепеченочные (негепатогенные – патологические процессы, протекающие за пределами печени, но вторично повреждающие ее). 1) Печеночные: а) расстройства кровообращения – наибольшее значение имеет развитие портальной гипертензии различного происхождения – стойкое повышение давления в сосудах воротной вены выше нормы (выше 6 мм рт ст); б) паразитарные поражения; в) циррозы – хронически протекающие патологические процессы в печени, характеризуются прогрессирующим повреждением и гибелью гепатоцитов; г) холестаз; д) опухоли; е) дистрофии – наиболее часто развиваются под действием химических веществ (АБ, наркотики, метанол, этанол, бытовые яды, отравления грибами); ж) гепатиты – в результате вирусной инфекции или интоксикации; з) наследуемая патология печени. 2) Внепеченочные: а) эндокринопатия – гипокортицизм, патология паращитовидных желез; б) гипоксия – при сердечной недостаточности – циркуляторная, тканевая при интоксикации; в) гипо-, дисвитаминозы – гиповитаминозы Е, Д, А; г) нарушения кровообращения; д) хроническая почечная недостаточность. Патогенез. Воздействие фактора, повреждающего гепатоциты, формирует разветвлённую сеть взаимозависимых и взаимопотенцирующих изменений. Модификация и/или деструкция плазмолеммы, других мембран и цитоскелета гепатоцитов, развитие иммунопатологических, воспалительных, свободнорадикальных процессов, активация гидролаз приводят к массированному разрушению клеток печени, выходу в интерстиций их содержимого, включая многочисленные гидролитические ферменты. Названные факторы дополнительно потенцируют воспалительные, иммунопатологические и свободнорадикальные реакции. Это, в свою очередь, делает процесс поражения печени тотальным и нарастающим по степени. Экспериментальное моделирование почечной недостаточности. Печеночно-клеточная недостаточность моделируется хирургическим удалением печени (полным или частичным), токсическим повреждением печени гепатотропными ядами (четыреххлористый углерод, хлороформ, фосфор, тринитротолуол), вызывающих центрилобулярный некроз печени. Экскреторная (холестатическая) форма печеночной недостаточности моделируется перевязкой желчевыводящих протоков. Так, подпеченочная (механическая) желтуха, сопровождающаяся холестазом, воспроизводится путем перевязки общего желчного протока. Сосудистая форма печеночной недостаточности моделируется при нарушении печеночного кровообращения путем наложения фистулы Экка и Экка — Павлова (перевязки печеночной артерии, воротной и печеночной вен, одномоментной деваскуляризации печени. Прямая фистула Экка заключается в наложении соустья между воротной и нижней полой венами и перевязке воротной вены выше анастомоза. В результате этого прекращается поступление крови из сосудов пищевого канала в печень, кровоток в ней уменьшается в 2 раза, нарушаются метаболическая (особенно белковый обмен), обезвреживающая (в том числе образование мочевины из аммиака) и другие функции печени. Развитие печеночной комы у оперированных собак ускоряется при кормлении их мясом ("мясное отравление" по И. П. Павлову). Перевязка печеночной артерии может привести собак к гибели, так как вследствие ишемии печень вторично инфицируется анаэробной микрофлорой кишок и развивается массивный некроз ее. Введение антибиотиков предотвращает возникновение некроза. Через 10 дней после перевязки артериальные коллатерали становятся настолько мощными, что кровообращение в печени восстанавливается, приток кислорода становится достаточным, чтобы воспрепятствовать развитию инфекции. Перевязка воротной вены или печеночных вен, одномоментная деваскуляризация печени (перевязка всех афферентных сосудов) у собак вызывает резкое нарушение кровообращения, быстро приводящее животных к гибели. Для экспериментального моделирования портальной гипертензии — синдрома, сопровождающего сосудистую форму печеночной недостаточности, производят частичное сужение печеночных вен или же нижней полой вены выше впадения в нее печеночных вен, а также сужение воротной вены. Следствием этих сосудистых нарушений является повышение давления в системе воротной вены, развитие портокавальных анастомозов, асцита, гипоксического повреждения гепатоцитов и цирроза печени. Принципы патогенетической терапии заболеваний печени. Дезинтоксикация организма и введение протекторных для печени средств (глюкоза, метионин, витамины). Из рациона больного исключается белковая пища. Для профилактики гемокоагуляционных расстройств сожно водить прокоагулянты, а для предупреждения присоединяющихся инфекций – антибиотики широкого спектра действия. В последние годы применяют плазмоферез, гемодиализ, перфузию крови через печень свиньи.
Дата добавления: 2015-02-02 | Просмотры: 7172 | Нарушение авторских прав |
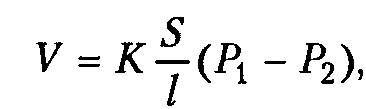 Диффузия газов через альвеолокапиллярную мембрану осуществляется в соответствии с первым законом Фика:
Диффузия газов через альвеолокапиллярную мембрану осуществляется в соответствии с первым законом Фика: