|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
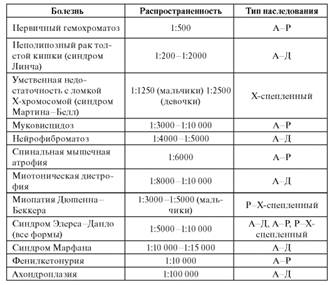
ЭПИДЕМИОЛОГИЯ. Клинико-генеалогические наблюдения свидетельствуют о стандартном или своеобразном поведении генов в семьяхКлинико-генеалогические наблюдения свидетельствуют о стандартном или своеобразном поведении генов в семьях, что и рассматривалось в предыдущих главах. Эти, безусловно, важные сведения должны быть дополнены знанием судьбы генов в популяциях, реальных закономерностей их распространения среди населения. Это особенно важно в настоящее время, потому что происходят интенсивные социальные процессы, с которыми человек ранее почти не сталкивался: массовая миграция населения, ломка этнических, национальных, религиозных, классовых, географических границ браков, увеличение численности населения планеты (неравномерное в разных популяциях), планирование деторождения (сокращение числа детей), улучшение медицинской помощи. Все эти факторы могут влиять на распространенность генных болезней в ближайшем и отдаленном будущем. Эпидемиология генных болезней включает сведения о распространенности этих болезней, частотах гетерозиготного носительства и факторах, их обусловливающих. Первичная основа возникновения наследственных болезней - мутационный процесс, а распространенность болезней (или частота больных) в популяции определяется уже популяционными закономерностями: интенсивностью мутационного процесса, давлением отбора (скоростью элиминации), который определяет плодовитость мутантов и гетерозигот в конкретных условиях среды, миграцией населения, изоляцией, дрейфом генов. Наиболее объективная оценка распространенности наследственных болезней в разных популяциях - определение их частоты среди новорожденных, включая мертворожденных. В последующем частота детей с наследственными болезнями меняется в связи с повышенной смертностью в раннем возрасте. Смертность детей от генных болезней может различаться в разных странах и в разные годы, поскольку этот показатель зависит от многих факторов (уровня медицинской помощи, социально-экономических условий, культурных традиций и т.п.). Оценка частоты определенных форм наследственных болезней среди разных контингентов (в детских больницах, в специализированных школах-интернатах для инвалидов, на амбулаторном приеме и т.д.) прямого отношения к эпидемиологии генных болезней не имеет. Такую оценку можно использовать только для косвенных расчетов распространенности болезни. Социальное перераспределение больных в разные группы населения, безусловно, зависит от экономического уровня, религии, государственного устройства и других факторов. В связи с большим числом нозологических форм генных болезней, их редкой встречаемостью, неполной клинической и патологоанатомической диагностикой наследственной патологии данные по распространенности наследственных болезней в целом еще отрывочные. Однако по формам, по которым проводятся массовые диагностические или профилактические программы, собран убедительный материал для суждения об эпидемиологии генных болезней. Общая частота новорожденных с генными болезнями в популяциях в целом составляет примерно 1%, из них с аутосомно-доминантным типом наследования - 0,5%, с аутосомно-рецессивным - 0,25%, с Х-сцепленным - 0,25%; Y-сцепленные и митохондриальные болезни встречаются крайне редко. Распространенность отдельных форм болезней колеблется от 1:500 (первичный гемохроматоз) до 1: 100 000 и ниже (гепатолентикулярная дегенерация, атаксия-телеангиэктазия и др.). Распространенность генной болезни условно можно считать высокой, если 1 больной встречается на 10 000 новорожденных и чаще, средней - 1: 10 000-40 000, низкой - очень редкие случаи. В группу распространенных входит не более 15 генных болезней, но они обусловливают почти 50% общей частоты больных с наследственной патологией. Данные по распространенности некоторых наиболее изученных генных болезней представлены в табл. 4.7. Таблица 4.7. Распространенность генных болезней
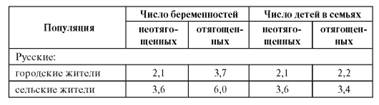
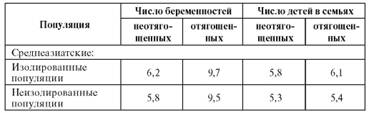
Примечание. А - аутосомный, Д - доминантный, Р - рецессивный. Как видно из табл. 4.7, распространенность разных форм генных болезней сильно различается независимо от типа наследования. Причины таких различий во многом неясны. Распространенность генных болезней определяется частотой вновь возникающих мутаций и числом детей у больных родителей и гетерозигот. Биологические основы распространенности доминантных и рецессивных болезней неодинаковые. Распространенность многих доминантных болезней определяется в основном новыми мутациями. Практически все доминантные болезни ведут к снижению фертильности, а некоторые - даже к стерильности. Репродуктивная функция у больных в целом снижена по биологическим или социальным причинам. Так, только 10% случаев ахондроплазии относятся к семейным. Семейные формы нейрофиброматоза I типа составляют 50-70%. Снижена репродуктивная способность при синдроме Марфана. Поздно начинающиеся аутосомнодоминантные болезни (хорея Гентингтона, болезнь Альцгеймера) не отражаются на репродуктивной способности (число детей). К началу болезни (после 35-40 лет) деторождение уже заканчивается. Распространенность рецессивных болезней определяется частотой гетерозигот в популяциях. Популяционные закономерности распределения генов и генотипов таковы, что частота гетерозигот во много раз выше частоты гомозигот по мутантному аллелю. Накопление гетерозигот в популяциях обусловлено их репродуктивным преимуществом (оставление потомства) по сравнению с гомозиготами по нормальному и патологическому аллелям. Если преимущества никакого нет и не было в истории популяции, то частота гетерозигот, казалось бы, должна приближаться к частоте мутационных событий (равное число появляющихся и элиминирующихся мутаций). На самом деле по всем рецессивным мутациям сохраняется повышенная частота гетерозигот, как бы подхватываемая отбором для размножения. Популяции не только человека, но и всех живых существ отягощены грузом рецессивных мутаций. Эта общебиологическая закономерность была открыта русским генетиком С.С. Четвериковым в 1926 г. Распространенность генных болезней в общем плане определяется популяционными закономерностями поведения генов (см. ниже). Мутационный процесс - одна из биологических характеристик любого вида. Он постоянно протекает у человека в зародышевых и соматических клетках и является основой возникновения и поддержания генетического разнообразия человека. В то же время это первичный источник наследственных болезней. По разным оценкам, частота возникновения мутаций (спонтанный уровень) у человека ориентировочно составляет 1х10-5-1х10-7 гена на поколение, т.е. мутационные события в каждом гене достаточно редки. Лишь в нескольких генах мутации возникают с повышенной частотой (1 на 104 гамет). Эти гены отличаются от других необычайно большими размерами (360 000 пар оснований в гене нейрофиброматоза и 2х106 - в гене миопатии Дюшенна-Беккера). Таким образом, текущий мутационный процесс на генном уровне в одном поколении не может обеспечивать наблюдаемую высокую частоту патологических аллелей в популяциях. По приблизительным косвенным оценкам (а точные прямые пока невозможны) общий вклад мутационного процесса в распространенность наследственных болезней составляет около 20%. Отбор в любых популяциях обусловлен дифференциальной смертностью и плодовитостью особей с разными генотипами, что и приводит через какое-то число поколений к различной концентрации аллелей в популяциях. Поскольку отбор (его направленность и интенсивность) тесно связан с условиями окружающей среды, на этой основе возникают разные концентрации аллелей в различных популяциях. Элиминация или преимущественное размножение зависят от дифференциальной приспособленности гетерозигот, нормальных или мутантных гомозигот к условиям окружающей среды. В качестве примера этой закономерности можно привести факторы распространения аутосомно-рецессивных гемоглобинопатий (серповидно-клеточная анемия, талассемия, аномальные гемоглобины - гемоглобин С, НиЕ) в регионах с высокой заболеваемостью малярией. Малярия у гомозигот по гену нормального гемоглобина сокращает жизнь и репродукцию у здоровых людей. Гомозиготы по мутантным аллелям (больные гемоглобинопатиями) умирают от наследственной болезни, не оставляя потомства. Гетерозиготы выживают, потому что малярийный плазмодий не поражает людей с аномальным гемоглобином, а сама гетерозиготность не вызывает патологического процесса в нормальных условиях. Преимущественное размножение гетерозигот приводило к высокой частоте носительства гена среди населения в прошлом «малярийных» регионов (Юго-Восточная Азия, Африка, Италия, Греция, Кипр, Азербайджан, Узбекистан). Такая частота сохраняется и до настоящего времени. Отбор, безусловно, продолжает действовать и сейчас в популяциях человека не только во внутриутробном, но и в постна- тальном периоде онтогенеза, несмотря на социальную и медицинскую помощь больным. В детском возрасте умирают больные GM2-ганглиозидозом, миопатией Дюшенна, с моногенными врожденными пороками развития. Репродукция понижена у больных гемофилией, ахондроплазией, нейрофиброматозом I типа и т.д. В то же время необходимо обращать внимание на снижение давления отбора в современных условиях (разное для разных болезней), которое в популяциях человека идет двумя путями. Во-первых, улучшение медицинской и социальной помощи больным (особенно лечение наследственных болезней) приводит к тому, что гомозиготы (например, больные фенилкетонурией, муковисцидозом), ранее не доживавшие до репродуктивного периода, теперь не только живут 30-50 лет и более, но и вступают в брак, имеют детей. Следовательно, популяции пополняются гетерозиготами по патологическим генам. Во-вторых, планирование семьи (произвольное сокращение рождаемости, чаще всего 1-2 или 3 ребенка) изменяет действие отбора в связи с репродуктивной компенсацией. Суть этого явления в современных популяциях заключается в следующем. Наследственно отягощенные супружеские пары, у которых повышена смертность детей из-за наследственных болезней, в результате большего числа беременностей по сравнению с таковыми у наследственно неотягощенных пар «достигают» того же числа детей. Это положение иллюстрирует табл. 4.8, составленная по данным Л.П. Большаковой (1986). Популяционные последствия репродуктивной компенсации очевидны, хотя развиваться они будут медленно (десятки, а для некоторых генов сотни поколений). Патологические аллели в этих случаях будут иметь большую вероятность сохранения и увеличения частоты, чем при естественной репродукции индивидов с разными генотипами. Таблица 4.8. Репродуктивная компенсация в разных популяциях
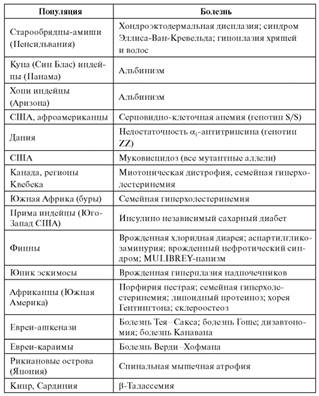
Дрейф генов - это случайное повышение частоты какого-то аллеля в результате нескольких совпадающих событий, имеющих стохастический характер (соответствующий брак, большая семья, унаследование детьми патологических генов, снова «подходящие» браки этих детей, хорошее материальное положение и т.п.). Это явление наблюдается для редко встречающихся признаков (или болезней), которые не отметаются отбором. Благодаря дрейфу генов патологические гены могут долго сохраняться в роду или в небольшой популяции, особенно в изоляте (популяция из 500-1500 человек, в которой практически отсутствует миграция). Неравномерное распределение патологических генов в популяциях, а точнее, их высокие частоты, могут быть обусловлены так называемым эффектом родоначальника. Это явление по популяционногенетическому смыслу близко к дрейфу генов - накоплению какой-либо генной болезни (или многих), унаследованной от одного или нескольких индивидов, переехавших в другое место. Хорошо документированных историческими материалами примеров эффекта родоначальника в генетике человека уже много. В XVII в. иммигранты из Европы (Голландии, Дании, Германии) прибыли в Южную Африку (современная ЮАР). Среди них были носители генов порфирии (мягко текущее аутосомно-доминантное заболевание), хореи Гентингтона (аутосомно-доминантная болезнь с поздним началом), семейного полипоза толстой кишки (аутосомнодоминантная болезнь с поздним началом), липопротеиноза (аутосомно-рецессивная болезнь). Семьи иммигрантов были большими (более 10 детей), поэтому людей с этими болезнями в ЮАР теперь во много раз больше, чем в Голландии и Дании. Родословная лиц с аутосомно-доминантными болезнями прослеживается до одного брака иммигрантов, а ген липопротеиноза - до брата и сестры, прибывших в 1652 г. в теперешнюю ЮАР. Они, их дети и внуки имели большие семьи, что и способствовало увеличению частоты этого рецессивного гена. Китайский иммигрант, прибывший в Южную Африку, имел 7 жен. Он страдал аутосомно-доминантным заболеванием - дисплазией костей и зубов, вызывающей полную потерю зубов к 20 годам, и передал этот ген 70 из 356 прослеженных потомков в 4-х поколениях. В штате Пенсильвания (США) живут изолированно амиши (переселенцы из Европы), переехавшие туда в XVIII в. В 60-х годах XX в. в их поселении обнаружены 82 человека с аутосомно-рецессивной болезнью (карликовость и 6 пальцев), все эти люди - потомки одной супружеской пары. Естественно, имеется тенденция к элиминации патологических генов из популяций путем естественного отбора, поэтому эффект родоначальника сам по себе не может объяснить долгое существование патологического гена в популяции. Миграция населения по регионам или странам с оседлостью в новом месте - теперь уже неизбежный спутник многих социальных процессов (беженцы, переезд в поисках работы и т.д.). Миграция может отражаться на эпидемиологии генных болезней. Она уменьшает или увеличивает частоту носителей патологических генов в «донорских» или «реципиентных» популяциях вплоть до эффекта родоначальника или уравнивания частот в популяциях. Кровнородственные браки имеют особенно большое значение в распространенности рецессивных генных болезней. Такие браки встречаются в западных странах с частотой около 1% на уровне двоюродных братьев и сестер. Однако в ряде этнических групп частота кровнородственных браков на уровне двоюродных родственников составляет 10-20% и даже до 30%, если включается троюродный уровень. В кровнородственных браках существенно повышается вероятность рождения потомства, гомозиготного по патологическому рецессивному гену, по сравнению с таковой в потомстве от неродственного брака. Многие редкие рецессивные болезни встречаются в основном у детей от кровнородственных браков (табл. 4.9). Более того, постнатальная смертность существенно выше у детей, рожденных в кровнородственных браках (рис. 4.36). Особую опасность представляют инцестные браки, т.е. браки между родителями и детьми или между братом и сестрой. Вариации распространенности генных болезней (этнические, географические, популяционные) подтверждены во многих исследованиях. Выше были рассмотрены факторы, влияющие на распространенность генных болезней. Каждый из них может действовать отдельно в конкретной популяции в отношении конкретной нозологической формы или действует в комбинации с другими факторами. Накопилось много доказательств того, что распространенность множества генных болезней различна в разных популяциях. Высокая частота редких генных болезней в отдельных этнических группах объясняется эффектом родоначальника и дрейфом генов в изолированных популяциях. Отбор в таких случаях имеет меньшее значение. В таблице 4.10. приведены примеры высоких частот наследственных болезней в связи с длительной генетической изоляцией. Таблица 4.10. Генетические изоляты с высокой частотой аутосомных болезней
Примечание. MULIBREY-нанизм - MUscle-LIver-BRain-Eye-нанизм. Редкие наследственные болезни относительно часто (в 10-100 раз чаще, чем в других популяциях) обнаруживаются в ряде популяций. У армян независимо от места их проживания отмечается высокая встречаемость семейной средиземноморской лихорадки (периодическая болезнь). В Финляндии часто встречается несколько редких болезней: врожденный нефроз, лизинурическая непереносимость белка, аспартилгликозаминурия, липофусциноз (детский тип) и др. У евреев-ашкенази, в нескольких поколениях постоянно проживающих в США, Европе и Израиле, отмечается высокая частота болезней накопления (GМ2-ганглиозидоз, болезнь Нимана-Пика, болезнь Гоше), синдрома Блума, семейной дизавтономии, абеталипопротеинемии, брахидактилии и др. В некоторых областях Японии часто встречаются акаталазия, болезнь Огаши, наследственный дисхроматоз. В Азербайджане в отдельных районах отмечается высокая частота синдрома Элерса-Данло (классический тип), хореи Гентингтона, гемофилии. Среди канадцев французского происхождения много больных тирозинемией, GM2-ганглиозидозом. Как видно из приведенных примеров (подобной информации много и по другим популяциям), во всех случаях существует достаточно выраженная брачная изоляция, иногда даже вне географических ограничений (евреи-ашкенази, армяне). Различия в распространенности касаются не только редко, но и часто встречающихся форм генных болезней. В последнем случае возможно как уменьшение, так и увеличение частоты болезни. Объяснения колебаний распространенности часто встречающихся генных болезней надо искать, скорее всего, в условиях отбора, как уже упоминалось для гемоглобинопатий. Например, две широко распространенные аутосомно-рецессивные болезни - фенилкетонурия и муковисцидоз - встречаются с неравной частотой в разных географических зонах или больших популяциях. Муковисцидоз встречается в среднем у 1 из 2000-3000 новорожденных в Европе и США, а среди чернокожих африканцев и японского населения его частота составляет 1:100 000. Частота фенилкетонурии в большинстве популяций равна 1:10 000, а в Финляндии, Израиле (для евреев-ашкенази), Японии болезнь встречается крайне редко (1:100 000-1:200 000). В Белоруссии и Ирландии ее частота составляет 1:6000, в Шотландии 1:5300. В заключение следует подчеркнуть, что понимание эпидемиологии генных болезней необходимо врачу любой специальности, поскольку он может столкнуться с «пучковостью» редкой наслед- ственной болезни в пределах обслуживаемого им района или контингента. Знание закономерностей и механизмов распространения генных болезней поможет своевременно разработать меры профилактики (обследование на выявление гетерогенности, генетическое консультирование и др.). Дата добавления: 2015-02-06 | Просмотры: 1164 | Нарушение авторских прав |