|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Критерии септического синдрома
[по Marini JJ., Wheeler A.P., 1997]: I. Клинические признаки инфекции. II. Наличие двух или более симптомов: • гипертермия или гипотермия (температура тела выше 38 0C или ниже 36 0C); • тахипноэ или гипервентиляция (ЧД более 20 в 1 мин, МОД более 10 л/мин); • тахикардия (пульс более 90 в 1 мин при отсутствии сердечных заболеваний или лекарственных препаратов, подавляющих тахикардию); • лейкоциты: более 10 000/мм3, или менее 4000/мм3, или более 10 % незрелых форм нейтрофилов; III. Острая дисфункция органных систем: • изменение ментального статуса (уменьшение по шкале Глазго на 2 пункта); • гипотензия (АДСИСт ниже 90 мм рт.ст. или снижение более чем на 40 мм рт.ст.), резистентная к проводимой терапии; • нарушения газообмена или РДСВ (соотношение PaO2/FiO2 менее 300); • метаболический ацидоз, лактат-ацидоз; • олигурия или нарушения ре-нальной функции (диурез ниже 0,5 мл/кг/ч); • гипербилирубинемия; • коагулопатия (число тромбоцитов менее 100 000/мм3, INR более 2,0; PTT более 1,5; контроль повышения продуктов деградации фибрина). Эпидемиология сепсиса. Очевидно, что не всегда сепсис своевременно и адекватно диагностируется. В тех случаях, когда сепсис является основой заболевания или состояния, подобные диагностические ошибки могут вести к летальному исходу. По данным статистики США, каждый год в стране регистрируется от 300 000 до 500 000 случаев тяжелого сепсиса. Число смертельных исходов, связанных с сепсисом, по этим же данным, колеблется от 30 до 90 % [Боун Р., 1995]. Однако вполне вероятно, что не все случаи сепсиса подтверждаются этими критериями. В отделениях ИТ сепсис имеет более широкую распространенность по сравнению с другими тяжелыми заболеваниями. Несмотря на создание новых, высокоэффективных антибиотиков летальность при септическом шоке за последние 80 лет (1915—1995) не изменилась. Можно с уверенностью констатировать, что септический шок — самая частая причина летальных исходов в отделениях ИТ общего профиля [Meak-ins J., Wheeler A.P., 1986]. Смертность от сепсиса в среднем составляет 40 %, худший прогноз возможен у пожилых пациентов с гипотермической реакцией. Пациенты с иммуносупрессивными состояниями и хроническими заболе- ваниями имеют также менее благоприятный прогноз. Для клинициста представляют интерес случаи сепсиса, обусловленные ИТ, и причины его возникновения в больницах. Госпитальный сепсис. Хотя сепсисом может заболеть любой здоровый человек, находящийся вне больницы, все же сепсис чаще возникает у госпитализированных больных. Вероятность развития сепсиса в больнице обусловлена многими факторами. В отделениях ИТ хирургического профиля риск внутрибольнич-ной инфекции значительно выше, чем в отделениях ИТ с терапевтическим уклоном. Вероятность развития инфицирования несут с собой сами оперативные вмешательства и различные диагностические и лечебные процедуры, особенно при использовании инвазивных методов (катетеризация сосудов, мочевого пузыря, интубация трахеи, повторные операции и т.д.). Сепсис, вызванный катетеризацией кровеносных сосудов, встречается примерно в 10—15 % случаев всех госпитальных инфекций. Доказательством этого вида сепсиса является один и тот же микроорганизм, выделенный из кончика катетера и крови [Mari-niJ.J., Wheeler A.P., 1997]. Микроорганизмы могут попасть в кровоток через соединения в инфу-зионной системе или путем миграции кожной флоры вдоль канала, созданного катетером. Находящиеся в кровотоке микроорганизмы могут оседать на фибриновой оболочке, покрывающей поверхность катетера. Типичными представителями микрофлоры кожи являются стафилококки S. aureus, S. saprophyticus (вызывает инфекции мочевых путей) и S. epidermidis (инфекции, связанные с применением сосудистых и уретральных катетеров). Возбудителями септициемии, обусловленной катетеризацией, кроме перечисленных, могут быть Candida spp., Enterobac-ter, Serratia, Enterococcus, Klebsiella, Pseudomonas spp., Proteus и др. Неко- торые штаммы S. epidermidis вырабатывают липкую субстанцию, позволяющую им легко присоединяться к материалам имплантированных протезов и катетерам. Большой процент септических состояний связан с послеоперационными осложнениями. Увеличению случаев хирургического сепсиса способствует применение имму-носупрессоров при раке и трансплантации органов (кортикостерои-ды, химиотерапия, облучение и др.). Некоторые неотложные состояния несут повышенную вероятность развития сепсиса (такие, как панкреатит, тяжелая травма, геморрагический шок). Несмотря на применение высокоэффективных антибиотиков, достаточно изученных технологических приемов, таких, как диализ, парентеральное питание, механическая вентиляция легких, инотроп-ная поддержка и пр., летальность от сепсиса в отделениях ИТ продолжает оставаться высокой. Патофизиология. Тяжесть клинического проявления сепсиса часто связана не с инфицирующим агентом, а со специфичным активным «тотальным» ответом организма на этот фактор. Воспаление, его физиологический смысл, заключаются в развитии реакции, ограничивающей распространение инфекции. Чрезмерная реакция организма вредна. Клеточные и биохимические механизмы этого ответа быстро развиваются, возрастают уровни медиаторов в крови. В настоящее время принято считать, что в результате этого ответа происходит многоступенчатый каскад реакций, в котором первичный триггерный механизм вызывает выброс ограниченного количества ранних медиаторов, которые в свою очередь вызывают выброс уже большего количества вторичных медиаторов. Многие структуры этого каскада получены in vitro и в экспериментах на животных, но клинические исследования также подтверждают эту схему. Полагают, что начальный триггерный механизм стимулирует клетки иммунной системы к образованию воспалительных медиаторов. Первичным триггерным механизмом часто бывает белок, липид или часть углевода, активизированный компонентом каскада свертывания или остатками мертвой ткани микроорганизма. Возможно, что эндотоксин является составной частью липосахарида оболочки грамотрица-тельных бактерий. Эндотоксин — важный микробиологический токсин, однако известны и другие токсины — Staphylococcal toxic shock syndrome toxin (TSST-I) и group В streptococcal (GBS) toxin и др. CCBP, или CCBO, представляет собой генерализованную реакцию, возникающую в ответ на повреждение, сопровождающуюся выбросом большого количества биологически активных соединений. Инициирующие факторы могут быть различными: это инфекция, травма, кровопо-теря, ишемия. Перечисленные воздействия при сопутствующих условиях (сила воздействия, сила организма) могут резко активизировать клетки иммунной системы и приводить их в состояние «метаболического взрыва». В результате происходит выброс этими клетками огромного количества субстанций, называемых агрессивными медиаторами и приводящих к нарушению функций органов и систем. СПОН следует рассматривать как наиболее тяжелую степень этой системной воспалительной реакции [Горобец B.C. и др., 1997]. СПОН — состояние, при котором органы и органные системы не способны выполнять свои жизнеобес-печивающие функции; это недостаточность двух или более функциональных систем, универсальное поражение органов и тканей медиаторами критического состояния с временным преобладанием той или иной недостаточности [Боун Р., 1995; Marini J.J., Wheeler A.P., 1997].
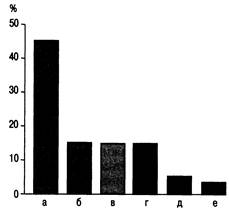
Рис. 27.1. Частота возникновения сепсиса в зависимости от первичного источника поражения [по Marini J.J., Wheeler A.P., 1997]. а — легкие; б — желудочно-кишечный тракт; в — мочевыделительная система; г — неизвестные причины; д — кожа; е — ЦНС. В настоящее время полиорганная недостаточность является основной причиной смерти больных в палатах ИТ и реанимации хирургических стационаров и составляет около 75— 80 % общей летальности (рис. 27.1). Септический триггер — механизм преходящий, его трудно обнаружить клинически. Даже с современной технологией эндотоксин обнаруживается менее чем у половины пациентов с септическим шоком. Отмечено, что развитие сепсиса не требует подтверждения бактериемии или эндоваскулярной инфекции: токсины могут попасть в кровоток из локальных очагов (например, при абсцессах) или непосредственно из толстой кишки (транслокация) даже в тех случаях, когда жизнеспособные микроорганизмы не циркулируют в крови. В патогенезе CCBP основную роль играют цитокины и другие медиаторы. Принято считать, что цитокины являются медиаторами первого ряда CCBP. Цитокины — это, как правило, гликозированные полипептиды средней молекулярной массы (менее 30 кД). Они вырабатываются клетками иммунной системы и некоторыми другими клетками в ответ на активирующий стимул. Цитокины различаются по строению, биологическим свойствам, но наряду с различиями обладают и общими свойствами. Они участвуют в иммунных и воспалительных реакциях, регулируя их силу и продолжительность. Оказывают свое действие через рецепторы на поверхности клеток-мишеней. Незначительные количества цитоки-нов оказывают биологический эффект. Связывание цитокина с соответствующим рецептором приводит, как правило, к активации клетки, ее пролиферации, дифференцировке или гибели. Функции цитокинов осуществляются по принципу сети. Многие функции, приписываемые первоначально одному цитокину, как оказалось, обусловлены согласованным действием нескольких цитокинов (синергизм действия). Одни цитокины индуцируют синтез других (каскадность действия, которая необходима для развития воспалительных и иммунных реакций), усиливают или ослабляют продукцию других. Действие цитокинов может быть антагонистическим. Клетки — продуценты цитокинов, сами цитокины и специфические для них рецепторы формируют единую рецепторно-ме-диаторную сеть. «Именно набор ре-гуляторных пептидов, а не индивидуальные цитокины определяют окончательный ответ клетки-мишени» [Ковальчук Л.В. и др., 1999; SoubaW.W., 1994]. В настоящее время выделяют следующие группы цитокинов: 1) интерлейкыны (ИЛ-1—ИЛ-18)— секреторные регуляторные белки иммунной системы, обеспечивающие медиаторные взаимодействия в иммунной системе и связь ее с другими системами организма; 2) факторы некроза опухолей — цитокины с цитотоксическим и ре-гуляторным действием ФНОа и ΦΗΟβ (лимфотоксин); 3) интерфероны — противовирусные агенты с выраженным иммуно-регуляторным действием (ИФ«, ИФР, ИФУ); 4) колониестимулирующие факторы (КСФ) — стимуляторы роста и дифференцировки гемопоэтических клеток; 5) хемокины — хемоаттрактанты для лейкоцитов; 6) факторы роста — регуляторы роста, дифференцировки и функциональной активности клеток различной тканевой принадлежности (факторы роста фибробластов, эн-дотелиальных клеток, эпидермиса) и трансформирующий фактор роста [Ковальчук Л.В. и др., 1999]. В ответ на повреждающее воздействие развивается воспалительная реакция, направленная на ликвидацию повреждения. Эта реакция может быть местной или общей. В зависимости от воздействия на воспалительные процессы цитокины подразделяются на две группы: провос-палительные (ИЛ-1, ИЛ-6, ИЛ-8, ФНО) и противовоспалительные (ИЛ-4, ИЛ-10), ТФРр (трансформирующий фактор роста β). Наибольшее значение в развитии синдрома CBP имеют провоспалительные цитокины. Самыми ранними воспалительными медиаторами являются цитокины ФНО и ИЛ-1. Эти цитокины привлекают особенное внимание, поскольку они идентифицированы в тканях и крови у многих больных с сепсисом. Кроме того, имеется грубая корреляция между уровнями ФНО в плазме, продолжительностью присутствия цитокина и результатами лечения. Чем выше уровень ФНО в сыворотке крови, чем более длительный период этот уровень сохраняется, тем хуже прогноз. Наиболее важную роль, по-видимому, играет ФНО, потому что он служит главным промежуточным звеном для других цитокинов, включая ИЛ-1, ИЛ-6, ИЛ-8, многочисленных ферментов, простагландинов (ΠΓ) и лейкотриенов, кислородных радикалов, тромбоцитактивирующего фактора (ТАФ) и оксида азота. Очевидно, что ФИО и ИЛ-1 — синергисты и производство ФНО необходимо для максимальной продукции других цитокинов. В пределах минут стимула ФНО может быть обнаружен в крови у многих больных сепсисом и сопровождается ростом ИЛ-1, ИЛ-6 и ИЛ-8. Теоретически выброс цитокинов после одиночного токсинового воздействия можно представить следующим образом. Токсин присутствует в крови в течение короткого периода времени. В течение нескольких минут выпущенный в кровообращение ФНО достигает пика концентрации через 1—2 ч. После ФНО появляются ИЛ-1, ИЛ-6, ИЛ-8. ИЛ-6 обнаруживается в течение самого длительного периода времени. ФНО и ИЛ-1 продуцируются после стимула. По-видимому, путем изменения продукции ИЛ будет возможным изменять и клинические проявления некоторых сепсис-подобных болезней. Фактор некроза опухолей (ФНО, TNF). Считается, что ФНО — это один из ведущих медиаторов в развитии CCBO. Введение его экспериментальным животным приводит к состоянию, имитирующему генера-лизованную реакцию: гипотензию, нейтропению, повышение капиллярной проницаемости. Однако роль ФНО не ограничивается указанными симптомами. Под воздействием этого фактора: • усиливаются процессы адгезии на эпителиальных стенках сосудов; • активируются клетки, участвующие в воспалительной реакции; • увеличивается число молекул ГКГС (главный комплекс гисто-совместимости) на поверхности инфицированных клеток, что способствует их разрушению ци-тотоксическими клетками; • активируются лейкоциты, участвующие в воспалительной реакции: нейтрофилы, эозинофилы и мононуклеарные лимфоциты; • стимулируется продукция других медиаторов (ИЛ-1, ИЛ-6, ФНОа); • будучи активным пирогеном, ФНО воздействует на гипоталамус, вызывает лихорадку, активирует систему свертывания крови; • снижается трансмембранный потенциал клетки, усиливается выброс лактата из периферических тканей, уменьшается синтез альбумина. Этим не исчерпываются все функции ФНО. Бесспорно лишь одно: что этот фактор играет важную роль в системном воспалительном ответе не только при сепсисе, но и при других острых состояниях. Интерлейкины. Под влиянием ИЛ-1 возрастает концентрация продуктов метаболизма фосфолипидов (ПГ, тромбоксана, ТАФ) в клетках воспалительного экссудата (табл. 27.2). Это вызывает расширение стенок кровеносных сосудов. В костном мозге возрастает число гранулоцитов, рециркулирующих в зону воспаления. С повышением локального уровня ИЛ-1 при агрегации гранулоцитов повышаются процессы дегра-нуляции. Основными цитокинами, стимулирующими системный ответ, являются ФНОа, ИЛ-1 и ИЛ-6. ФНОа и ИЛ-1 показали способность к прямому транскрипционному воздействию на продукцию ИЛ-6. Было отмечено также синергичное действие ИЛ-1 и ИЛ-6, приводящее к развитию максимального ответа на повреждение. Под воздействием высоких концентраций ФНОа, ИЛ-6 и ИЛ-1, γ-интерферона у экспериментальных животных происходили существенные изменения в пуле свободных аминокислот плазмы и усиление процессов катаболизма [Боун Р., 1995; Ковальчук Л.В. и др., 1999]. Таблица 27.2. Содержание ИЛ-Ip и ФНО«в биологических жидкостях организма человека [по Ковальчук Л.В. и др., 1999]
Увеличение уровня цитокинов ИЛ-1, ИЛ-6, ИЛ-8 возникает одновременно с активацией систем комплемента и каскада коагуляции. В результате метаболизма арахидо-новой кислоты образуются лейко-триены, ПГ, тромбоксан A2 и ТАФ. Это вызывает вазодилатацию, активацию системы свертывания крови и повышение прокоагулянтной активности. На базальной мембране появляются адгезивные наложения из тромбоцитов и фибрина. По мере прогрессирования процесса медиаторы могут взаимодействовать между собой, активируя друг друга. Если повреждение достаточно сильное, происходит выброс громадного количества цитокинов (каскад воспалительных цитокинов: ФНО«-> ИЛ-1 -> ИЛ-6, ИЛ-8). С током крови цитокины попадают в гипоталамус, действуя на клетки гипоталамуса, последние активируют деятельность передней доли гипофиза к выработке АКТГ и синтезу кортикостероидов надпочечниками. Повышение концентрации провоспалительных цитокинов в крови приводит к активации различных систем организма, и начинается острофазовый ответ, который характеризуется лихорадкой, лейкоцитозом, гиперметаболизмом, наличием острофазовых белков в сыворотке крови, активацией системы свертывания крови, усилением болевого синдрома, полиорганной дисфункцией. Концентрация провоспалительных цитокинов в сыворотке крови и других биологических жидкостях резко возрастает. Интересно отметить, что несте-роидные противовоспалительные средства, в частности ингибиторы циклооксигеназы, снижая индуцированный ИЛ-1, синтез ПГ и тром-боксана, подавляют воспалительный процесс, опосредованный этими метаболитами арахидоновой кислоты. Низкие дозы кортикостероидов стимулируют иммунные процессы, тогда как высокие дозы кортикостероидов подавляют как иммунные реакции, так и воспалительный процесс [Марино П., 1998]. Медиаторы синдрома системной воспалительной реакции (CCBP): • ФИО, TNF; • интерлейкины (ИЛ-1, ИЛ-4, ИЛ-6, ИЛ-8 и др.); • ТАФ; • дейкотриены; • тромбоксан A^; • ПГ (E2, I2) • гистамин, клеточные адгезивные молекулы; • оксид азота; • γ-интерферон; • токсические метаболиты кислорода и другие свободные радикалы; • катехоламины; • стрессовые гормоны. Другие медиаторы CCBP. Известно много медиаторов, участвующих в формировании ПОН. Среди них, кроме цитокинов, наибольшее функциональное значение имеют лейкотриены, ПГ, пептиды, гормональные амины, опиоиды, а также лизосомальные ферменты, кислородсодержащие радикалы и др. Следует подчеркнуть, что в отношении критических состояний и ПОН указанные субстанции рассматриваются как дезорганизующие и патогенные, хотя истинная их роль укладывается также в рамки физиологических регуляторных функций [Go-ris R., 1990; Marini J.J., Wheeler A.P., 1997]. Продукты распада арахидоновой кислоты (лейкотриены, ПГ EI и £2, тромбоксан, эпоксиды). Их совокупные факторы характеризуются брон-хоконстрикцией, повышенной проницаемостью мембран, микротромбозами, адгезией, агрегацией, дегра-нуляцией лейкоцитов [Goris R., 1990]. Оксид азота (NO) — самая маленькая по размерам молекула, синтезируемая в клетке и проявляющая свою биологическую активность. Оксиду азота приписывают роль фактора, вызывающего релаксацию сосудов. Повреждающее действие NO выражается в ингибировании ряда ферментов, индукции процессов ПОЛ, снижении антиоксидант-ного потенциала клеток [Жданов ГГ., Модель М.Л., 1996; Рябов Г.А., Азизов Ю.М., 2000]. Интерфероны являются цитоки-нами. Известно три вида интерфе-ронов: И Фа (лейкоцитарный), ИФР (фибробластный) и ИФУ (иммунный). ИФ«и ИФР обладают сильной противовирусной активностью. ИФУ обладает иммунорегуляторным противовирусным и антипролифератив-ным свойствами. ИФ«и ИФР усиливают действие N К-клеток (основная функция NK-клеток — разрушение клеток, инфицированных вирусом, и опухолевых клеток — естественных киллеров). ТАФ усиливает агрегацию тромбоцитов и нейтрофилов, способствует освобождению оксидантов, образованию продуктов цикло- и липоок-сигеназы в метаболизме арахидоновой кислоты. Непосредственное действие приводит к вазоконстрикции и вазодилатации, повышению проницаемости легочных и системных сосудов [Ковальчук Л.В. и др., 1999]. Фибронектин — белок, существующий в двух основных формах: тканевая — обеспечивает непроницаемость волокон и соединений клеток; циркулирующая — вызывает адгезию частиц, подлежащих уничтожению, к макрофагам и эндотелию. Кислородные радикалы повреждают эндотелиальную мембрану, клетки легочного интерстиция, участвуют в образовании хемотаксического ли-пида, притягивающего лейкоциты. Основными факторами, усугубляющими «медиаторно-цитокиновую бурю», являются гипоксия и дизок-сия [Боун Р., 1995; Жданов Г.Г., Ho-дель M.Л., 1996], глубокие нарушения микроциркуляции, аномально высокие концентрации промежуточных и конечных продуктов обмена веществ, циркулирующих иммунных комплексов, биогенных аминов, продуктов ПОЛ [Ковальчук Л.В., 1999;CerraF., 1987]. Основными морфологическими признаками системной воспалительной реакции и ПОН у пациентов с клинической картиной дыхательной, сердечно-сосудистой, почечной, печеночной недостаточности были деструкция, отек, геморрагии и микротромбы в тканях основных органов [Боун Р., 1995]. Суммарные эффекты, оказываемые медиаторами повреждения, формируют генерализованную системную реакцию, или CCBO — SIRS (табл. 27.3). Таблица 27.3. Медиаторы сепсиса и их действие [по Marini J. и Wheeler Α., 1997]
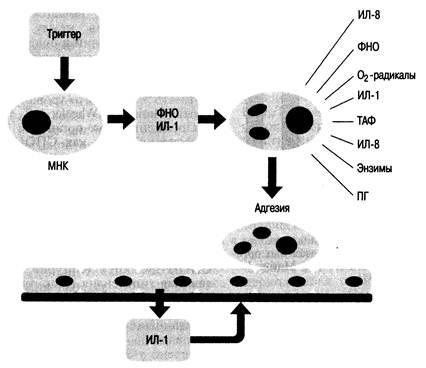
Упрощенное представление развития синдрома сепсиса (рис. 27.2): в большинстве случаев воспалительный стимул (триггер) и ИЛ-1 активируют базальную ткань и циркулирующие мононуклеарные клетки, в результате происходит образование ФНО и FiJI-I, которые активизируют ядросодержащие клетки; другие клетки, особенно нейтрофилы, в ответ на ФНО вырабатывают дополнительно ИЛ, большее количество ФНО, кислородные радикалы, ПГ, лейкотриены, протеазы. ФНО и ИЛ-1 также активируют молекулы адгезии на нейтрофилах и сосудистом эндотелии, что заканчивается закреплением клетки и повреждением сосуда. Диагностика. Клинический диагноз сепсиса основывается на ряде ключевых витальных симптомов, включающем наличие инфекции и системного воспалительного ответа. Это положение находится в противоречии с прежней концепцией заболевания, в которой основополагающим признаком считалось присутствие бактерий в крови. В настоящее время можно утверждать, что сама инфекция не является причиной многочисленных патологических сдвигов, характерных для сепсиса. Они возникают как результат ответной реакции организма на инфекцию и некоторые другие факторы. Сепсис есть клинический синдром, он не может быть основан на одном лабораторном признаке инфекции. Лихорадка является ключевым признаком сепсиса. Она возникает как результат присутствия в крови определенных медиаторов, наблюдается более чем в 90 % случаев диагностированного сепсиса. Лихорадка может быть минимальной или вообще отсутствовать у пожилых больных, больных с почечной недостаточностью или получающих стероиды и другие противовоспалительные препараты. Гипотермия встречается примерно в 10 % случаев сепсиса и
Рис. 27.2. Системная воспалительная реакция [по Marini J.J., Wheeler A.Р., 1997]. Объяснение в тексте. является плохим прогностическим признаком: смертность при этом более 80 %. Полагают, что высокая смертность при гипотермической реакции обусловлена грамотрицатель-ной бактериемией, шоком и/или сопутствующими заболеваниями [Marini JJ., Wheeler A.Р., 1997]. Тахипноэ — второй витальный симптом, обычно ранний признак сепсиса. В ранней стадии сепсиса нарушения дыхания выражены по типу гипервентиляции и дыхательного алкалоза. Учащение дыхания вызвано прогрессирующей гипоксе-мией и повышенными метаболическими потребностями, развивающимися при метаболическом ацидозе. У 90 % больных с гипоксемией необходимо проведение оксигенотера-пии, особенно если соотношение PaO2/FiO2<300. B то же время диагноз сепсиса не исключается у па- циентов без тахипноэ и изменений газового состава крови. Тахикардия — важный (кардинальный) симптом сепсиса. Считается универсальным признаком во всех случаях, за исключением заболеваний, связанных с нарушением проводящей системы сердца, или приема β-блокаторов. Изменение уровня циркулирующих лейкоцитов — важный критерий сепсиса. Типично для сепсиса либо повышение числа лейкоцитов, либо падение их и часто появление незрелых форм нейтрофилов. Сердечно-сосудистые расстройства могут иметь различный характер. В ранней фазе сепсиса обычно отмечается снижение ОПСС на фоне увеличенного CB, результатом чего является гипотензия. Позднее CB может уменьшаться, ОПСС оставаться сниженным или как аль-
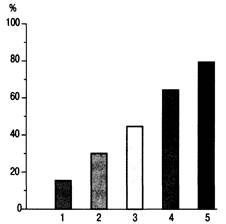
Рис. 27.3. Процент летальных исходов в зависимости от числа пораженных органов (1—5) при сепсисе [по Marini JJ., Wheeler A. Р., 1997]. тернатива развивается вазокон-стрикция; при этом гипотензия сохраняется. В поздней фазе сепсиса развивается почечная недостаточность с такими тяжелыми признаками, как азотемия и олигурия. При поражении печени возрастает уровень билирубина. Вследствие активации системы гемостаза развивается ДВС-синдром. При сепсисе возможно поражение ЦНС, сопровождающееся дезориентацией, летаргией, возбуждением или психозом. По мере прогрессирования сепсиса появляются признаки недостаточности органов, в том числе увеличение в плазме крови лактата, ги-поксемия, олигурия и нарушение сознания. Полиорганная недостаточность (поражение органных систем). Не поддающийся лечению сепсис неизбежно ведет к прогрессирующей дисфункции многих органов, включая легкие, почки, печень и мозг. Кумулятивные эффекты поражения органных систем обычно являются причиной летального исхода. Поэтому выявление начала, течения и исхода органных нарушений имеет важное значение для определения тактики лечения. Имеется прямая взаимозависимость между числом органных нарушений и смертностью от сепсис^. Каждый новый орган, вовлеченнЬш в процесс ПОН, увеличивает эту возможность на 15—20 % от 10—15 % «базового» уровня смертности [Marini J.J., Wheeler A.P., 1997]. Поражение двух органов и более классифицируется как СПОН (рис. 27.3). Данный синдром характерен для терминальной стадии сепсиса. Больные сепсисом в среднем имеют более чем две пораженные органные системы [Горобец B.C. и др., 1997; Сизов Д.H. и др., 1998; Чаленко В.В., 1998; Лейдерман И.Н., 2000]. Наиболее частыми признаками СПОН являются олигурия (65 %), тяжелая гипотензия (шок отмечается в среднем у 62 % больных с тяжелым течением сепсиса). Снижение соотношения PaO2/FiO2<300 — в пределах 56—60 %, развитие РДСВ отмечено у 24—28 % больных. Различные степени дисфункции ЦНС, как правило, развиваются несколько позже и наблюдаются примерно в 3—8 % случаев. Большинство полиорганных нарушений возникает быстро, обычно в пределах 72 ч после начала сепсиса. Шок имеет менее короткий период продолжительности (1—2 дня), а легочная дисфункция более продолжительна. Наиболее быстрое начало СПОН отмечается со стороны легочной функции, нередко формируется РДСВ со значительным снижением PaO2/FiO2. Средняя продолжительность легочной дисфункции составляет 8 дней, изменений ЦНС — 6—7 дней, олигурия и шок купируются в течение 1—2 дней [Marini J.J., Wheeler A. Р., 1997]. Не только число органных нарушений коррелирует с исходом заболевания, но и степень поражения каждой системы. Смертность от сепсиса достоверно выше среднего статистического уровня у больных с PaO2/FiO2>150, длительной гипо-тензией, нарушением сознания и высоким уровнем креатинина (более 3,5 мг/дл). Дисфункция системы дыхания. Легкие — один из первых органов, вовлекающихся в системный воспалительный ответ. Легочные нарушения при сепсисе редко отсутствуют, и обычно сразу возникает дисфункция в виде снижения оксигенации артериальной крови. Полагают, что поражение легких при сепсисе возникает в результате того, что медиаторы, содержащиеся в крови, проходят через легочный фильтр. Следует также полагать, что большая поверхность альвеол при сепсисе в результате воздействия медиаторов существенно уменьшается, при этом повреждается тонкая эндотелиаль-но-эпителиальная структура, через которую осуществляется диффузия газов. При сепсисе значительно возрастает потребность тканей в кислороде, развивается метаболический ацидоз. Это требует компенсации со стороны респираторной системы, т.е. увеличения объема минутной вентиляции для поддержания оксигенации и компенсации метаболического ацидоза. У септических больных возрастает резистентность к воздушному потоку в легких, снижается легочная податливость, что приводит к усилению работы дыхания. Резервы вентиляции при тяжелом сепсисе значительно снижены также вследствие уменьшения пер-фузии и оксигенации дыхательной мускулатуры (усталость дыхательной мускулатуры). Эти патогенетические механизмы ведут к дыхательной (гипоксической и гиперкапни-ческой) недостаточности. Большинству больных с тяжелым сепсисом требуются интубация и ИВЛ. Средняя продолжительность механической вентиляции в этих случаях составляет 7—10 дней. У больных с наиболее выраженной дыхательной дисфункцией ИВЛ может продолжаться дольше. У 35— 45 % больных развивается РДСВ, снижается PaO2/FiO2 до 200 и ниже, на рентгенограмме грудной клетки появляются диффузные двусторонние инфильтраты. Манифестация этих признаков происходит уже через 48 ч после начала сепсиса. Отмечено, что падение соотношения PaCb/FiCb ниже 150 коррелирует с высокой летальностью (плохой прогностический признак). Если процесс компенсируется, то легочная дисфункция проходит через 30 дней [Marini J.J., Wheeler A.P., 1997]. Циркуляторные нарушения. Критерием шока является снижение систолического АД, несмотря на энергично проводимую инфузионную терапию. Обычно шок не продолжается более 24 ч, поскольку длительный период шока сопряжен с высокой летальностью. Примерно у 50 % больных сепсисом развивается шок. Сердечно-сосудистые расстройства могут иметь различный характер. В раннем периоде сепсиса обычно отмечается снижение ОПСС, чем и объясняется артериальная гипотен-зия. Инвазивный мониторинг при этом показывает снижение ДЗЛА и нормальный или умеренно повышенный CB с низким системным периферическим сопротивлением (обычно ниже 1000 дин/с-см~5-м2). При сопутствующих жидкостных потерях (рвота, диарея, потливость, перспирация, повышение сосудистой проницаемости) отмечаются уменьшение плазматического объема и снижение давления наполнения сердечных камер. Общие жидкостные потери достигают 4—6 л, что требует соответствующего возмещения. После возмещения жидкостных потерь следует ожидать повышения ДЗЛА. Оптимальный уровень его в данной ситуации составляет 14—18 мм рт.ст. Однако, если имеется нарушение миокардиаль-ной сократимости (например, вследствие сопутствующего заболевания или присутствия TNF), давление заклинивания может повышаться, но СИ оставаться низким — «кардиогенный механизм шока». Нарушение механизма Франка— Старлинга при этом является плохим прогностическим признаком. В поздней стадии шока CB может уменьшаться, а ОПСС, наоборот, повышаться. Развивается вазокон-стрикция, при этом гипотензия сохраняется, нарастают симптомы почечной недостаточности. Реналъные нарушения. В раннем периоде сепсиса олигурия — довольно постоянный синдром. Диурез обычно меньше 0,5 мл/(кг-ч). Олигурия чаще всего связана с артериальной гипотензией и шоком. При устранении гипотензии, как правило, восстанавливается достаточный диурез. Продолжающийся шок и олигурия сопровождаются более высокой летальностью. У 80 % больных продолжительность олигурии не превышает 5 дней. Уровень креатинина умеренно возрастает (до 2—3 мг/дл). При высоком уровне креатинина в крови (более 3,5 мг/дл) наблюдается высокая смертность (80 %), при уровне креатинина 2—3,5 мг/дл смертность составляет 50 %, а при его снижении до 2 мг/дл и ниже смертность составляет 30 %. У 10— 15 % больных олигурия имеет большую продолжительность. Менее чем у 5 % больных сепсисом требуется проведение гемодиализа [Marini J.J., Wheeler A.P., 1997]. Метаболический ацидоз. Обычно метаболический ацидоз развивается по типу лактат-ацидоза несколько позже, чем возникают гипотензия и олигурия. Причиной лактат-ацидоза служит анаэробный метаболизм, обусловленный низким CB, гипок-семией и сниженной доставкой кислорода. Однако далеко не у всех больных с сепсисом можно констатировать повышение уровня лактата в крови. По-видимому, это связано с тем, что не только доставка кислорода, но и, главным образом, потребление его играют при этом решающую роль. Нельзя исключить поражение митохондрий и органелл клеток при сепсисе, подобно поражениям других органов и систем. При исследовании КОС необходимо иметь в виду, что данные могут быть противоречивы. Они могут зависеть как от ишемии отдельных органов и регионов, так и от восстанавливаемого кровотока в этих областях. Нельзя не учитывать, что повышенный уровень лактата в крови может быть обусловлен печеночной и кишечной недостаточностью (см.. главу 32). Во всех случаях DO2 и VO2 — основные факторы, определяющие направленность метаболических нарушений. Нарушения коагуляции. При сепсисе, в том числе тяжелом, ДВС-синдром возникает нередко. Наличие этого синдрома является чрезвычайно плохим прогностическим признаком. В большинстве случаев развивается умеренная тромбоцитопе-ния (число тромбоцитов 75,0— 100,0-109/л). Небольшое снижение уровня фибриногена и удлинение протромбинового и частичного тромбопластинового времени являются общими признаками. Следует полагать, что основными механизмами коагуляции могут быть эндоте-лиальные повреждения и образование в местах этих повреждений клеточных тромбоцитарных наложений. Дисфункция ЦНС. Незначительные изменения функции ЦНС при сепсисе обычно документируются при использовании шкалы Глазго. Отмечается снижение балльной оценки на 2 и более пунктов. Длительные изменения функции ЦНС предвещают плохой прогноз. Синдром кишечной недостаточности. Выдвинутая Дж. Меакинсом и Дж. Маршаллом в 1986 г. гипотеза о развитии ПОН в результате изменений проницаемости слизистой кишечника нашла дальнейшее свое развитие и подтверждение [Гутие-рез Г., Малик С., 1996]. Действительно, транслокация бактерий и токсинов через поврежденную стенку кишечной трубки в системный кровоток сопровождается выраженной токсемией и сепсисом. При первичном или вторичном воздействии страдают не только органы, называемые ранее шоковыми (легкие, почки), но и чревная область. Гипоксия кишечника — двигатель СПОН. Высокое содержание бактерий в просвете кишечника и предрасположенность кишечной стенки к атрофии, морфологическим изменениям, включая образование стрессовых язв, — все это подтверждает возможность бактериальной транслокации при критических состояниях. Терминальный отдел подвздошной кишки и слепая кишка являются естественным резервуаром грамотрицательных бактерий и других продуктов, содержащих эндотоксин. Целость слизистой оболочки кишки может быть нарушена при различных ситуациях: шоке, крово-потере, септических состояниях. Повреждение целости кишечника приводит к патологической проницаемости внутренней оболочки ЖКТ и сопровождается транслокацией бактерий и/или токсинов в ме-зентериальные лимфатические сосуды и портальную систему. В печени бактерии и токсины могут запускать системную воспалительную реакцию посредством активации купфе-ровских клеток (звездчатые ретику- лоциты) или гепатоцитов и в дальнейшем приводят к СПОН. Транслокация кишечной флоры может быть первичным или вторичным механизмом инициации и распространения системного воспалительного ответа. Трудности диагностики ишемии кишечника у реанимационных больных осложняют проведение убедительных исследований, подтверждающих эту гипотезу. Само повреждение кишечника может привести к активации нейтрофилов и выбросу мощных цитокинов. Эти вещества могут расстроить механизмы печеночного клиренса, особенно у больных с предшествующей патологией печени, и достичь эндотелия легких в количествах, достаточных чтобы вызвать острое поражение легких по типу дистресс-син-дрома. Поражение легких и кишечника могут взаимно усиливать дисфункцию этих органов. Слизистая оболочка кишечника имеет высокую степень метаболической активности и при ишемии становится наиболее уязвимой для возникновения в ней острых стрессовых язв. Если эпителиоциты лишены постоянного притока питательных веществ, снижается репродукция клеток кишечника и нарушается барьерная функция последнего. Дата добавления: 2014-12-11 | Просмотры: 1158 | Нарушение авторских прав |