|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
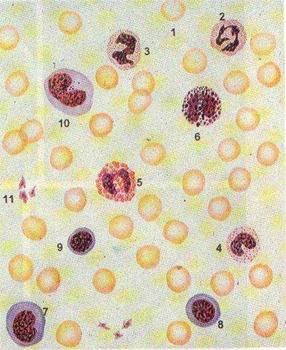
Работа 6. Выведение лейкограммыПроцентное соотношение различных форм лейкоцитов называют лейкограммой, изучению которой, как и общему подсчету лейкоцитов придается большое значение в клинике. Увеличение количества лейкоцитов называют лейкоцитозом, а уменьшение - лейкопенией. Продолжительность жизни гранулоцитов максимум 1,5-2дня, потом уходят в ткани и через 1-2 дня гибнут. В-лимфоциты - до 2 недель, Т-лимфоциты - месяцы. Расчет лейкоцитов. Четырёхпольный метод - по Шиллингу - определяют количество лейкоцитов в четырёх участках мазка. Всего в мазке подсчитывают 100—200 клеток. Трёхпольный метод - метод Филиппченко - состоит в том, что мазок мысленно делят на 3 части: начальную, среднюю и конечную. Подсчёт ведут по прямой линии поперёк мазка от одного его края к другому. В каждой части подсчитывают одинаковое количество клеток. Всего учитывают 100-200 лейкоцитов. Окрашивание клеток. Бактерии окрашиваются в фиолетово-красный цвет, цитоплазма клеток — в голубой, ядра — в красный. При окрашивании простейших их цитоплазма приобретает голубой цвет, а ядра — красно-фиолетовый. Результаты окрашивания мазков крови: цитоплазма лимфоцитов окрашивается в сине-голубой цвет, их ядра - в цвета от интенсивно пурпурного до фиолетового; цитоплазма моноцитов окрашивается в мутный голубовато-серый цвет, их ядра - в более светлый пурпурно-красный, нежная азурофильная зернистость; гранулы базофилов окрашиваются в интенсивный сине-фиолетовый цвет; гранулы эозинофилов окрашиваются в оранжево-розовый цвет; гранулы нейтрофилов окрашиваются в цвета от пурпурного до фиолетового; ядра лейкоцитов фиолетово-красного цвета с хорошо видимой структурой хроматина; хорошо выделяются ядрышки;
Реактивы: смесь Никифорова, иммерсионное масло. Оборудование: микроскоп, стекла с готовыми мазками крови, окрашенные по Романовскому. Ход работы. Смесью Никифорова протереть объектив. Установить предметное стекло на рабочий столик микроскопа, на 4 краевые участка мазка нанести иммерсионное масло, на один из них установить объектив на 90. Объективом просматривать от края мазка к центру по ломаной кривой, возвращаясь к краю от центра. Сосчитать 25 лейкоцитов, отметить формы, перейти на следующий краевой участок. Так подсчитать 100 лейкоцитов в 4 участках, учитывая формы Определить процентное содержание клеток различных популяций в исследуемом образце. Процентное содержание лейкоцитов различного вида не отвечает истинному количеству в 1 мл крови. Для того чтобы получить эту величину, необходимо произвести расчет абсолютного содержания лейкоцитов в 1 мл крови, зная при этом как количество лейкоцитов, подсчитанных в камере Горяева (Работа 4 данного лабораторного практикума), принимая за 100%, так и количество соответствующих видов лейкоцитов, например моноцитов, подсчитанных в мазках крови, в процентах. Более упрощенно этот расчет проводится путем умножения первых двух цифр числа лейкоцитов, подсчитанных в камере Горяева, на число соответствующего вида лейкоцитов, подсчитанных в мазке крови. Если лейкоцитов имеется 10000 и более, то следует брать первые три цифры. Например, число лейкоцитов равно 8000 в 1 мкл крови, а число моноцитов – 4%. 80× 4 = 320 моноцитов в 1 мкл крови. Оформление работы. Вывести лейкограмму крови карпа и человека, сравнить.
Работа 7. Определение жизнеспособности фагоцитирующих клеток Перед использованием суспензий клеток в иммунологических реакциях, как правило, проверяется их жизнеспособность. Жизнеспособность клеток можно определять методом окрашивания 0,1% трипановым синим или его смесью с эозином. Ядра погибших клеток окрашиваются трипановым синим, а их цитоплазма - эозином. Реагенты: раствор трипанового синего 0,1%; фосфатно-буферный раствор (рН=7,2-7,4); раствор эозина 0,1 %; двойной раствор Хенкса без глюкозы (Раствор Хенкса: хлорид натрия (8,00 г/л); хлорид кальция (0,20 г/л); сульфат магния (0,20 г/л); хлорид калия (0,40 г/л);, КН2Р04 (0,10 г/л); бикарбонат натрия (1,27 г/л); глюкоза (2,00 г/л). Все вещества растворяют в 1 литре дистиллированной воды). Оборудование: термостат 37°С; камера Горяева; микроскоп с увеличением 10x40; пипетки. Ход работы. Готовят раствор трипанового синего в фосфатно-буферном растворе (рН=7,2-7,4) или в физиологическом растворе (0,1% раствор эозина на двойном растворе Хенкса без глюкозы). К клеточной суспензии добавляют равный объем раствора красителя (при использовании двух красителей их растворы предварительно смешивают). Инкубируют при 37°С в течение 3 минут. С помощью микроскопа в камере Горяева подсчитывают процент погибших клеток (окрашенных). Жизнеспособность клеток выражают в процентах живых клеток - она должна быть не менее 95—93%, т.е. число окрашенных клеток не должно превышать 5-7%. Оформление работы. Рассчитать количество жизнеспособных фагоцитирующих клеток.
Дата добавления: 2014-12-12 | Просмотры: 1291 | Нарушение авторских прав |
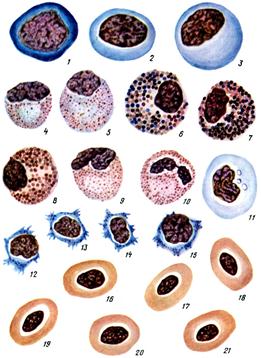 грануломеры тромбоцитов окрашиваются в красный, гиаломеры - в голубой; розовая окраска гемоглобина.
грануломеры тромбоцитов окрашиваются в красный, гиаломеры - в голубой; розовая окраска гемоглобина.