|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Pneumocystis carinii
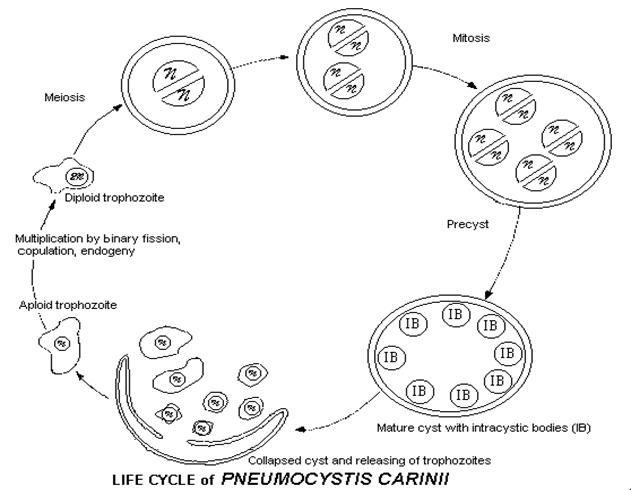
Пневмоцистоз, являясь причиной заболеваемости и летальных исходов у 65-85% больных СПИДом, относится к наиболее важным и значимым СПИД-индикаторным инфекциям. До эпидемии СПИДа, Pneumocystis carinii был известен прежде всего как этиологический фактор оппортунистической инфекции, развивающейся у людей с врожденными или приобретенными иммунодефицитными состояниями (включая пациентов, получающих химиотерапию, реципиентов почечных трансплантатов, детей с недостаточностью белкового питания). В настоящее время инфекция, вызванная P. carinii, преимущественно встречается у больных СПИДом. Заболевание чаще всего проявляется в виде пневмоцистной пневмонии. Pneumocystis carinii - микроорганизм с циклом жизни, подобным Toxoplasma gondii. Возбудитель имеет характерную микроструктуру с внутриклеточными тельцами, типичными для Protozoa. Однако изучение последовательностей рибосомальной РНК показывает наиболее вероятную родственную связь с Saccharomyces. Возбудитель пневмоцистоза — Pneumocystis carinii — внеклеточный паразит многих видов животных, которого отличает строгий тропизм к легочной ткани Весь жизненный цикл пневмоцисты проходит в альвеоле (рис.52). Вегетативная форма пневмоцисты — трофозоит — прикрепляется к эпителию легкого, выстланного альвеолоцитами I порядка. Физиологический контакт паразита с клетками хозяина осуществляется через систему микропиноцитозных пузырьков. Спорозоит — представлен клетками овальной формы (2-3 мкм), окружёнными слизистой капсулой. После инвазии в ткани лёгкого спорозоиты дифференцируются в трофозоиты — плеоморфные клетки с тонкой клеточной оболочкой. Размножается делением; капсула делится в последнюю очередь, предварительно образуя перетяжку и разделяясь на две особи. При окраске по Романовскому-Гимзе окрашиваются в фиолетовый цвет, ядра — в тёмно-синий. После ряда делений некоторые трофозоиты вступают в спорогонию (половой цикл размножения): паразитарное тельце увеличивается, заполняя всю цитоплазму, формируется стенка цисты, и ядро вступает в цикл последовательных делений. Образуется циста (диаметром 5-8 мкм), содержащая 8 спорозоитов.
Рисунок 52.Рисунок 52. Жизненный цикл Pneumocystis carinii
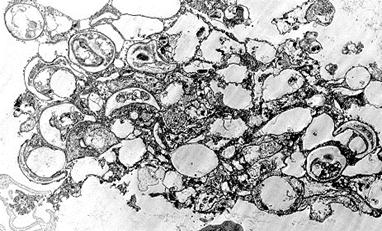
При разрыве цисты высвобождаются спорозоиты, дающие при благоприятных условиях начало популяции трофозоитов. Предцисты и зрелые цисты с внутрицистными тельцами находятся в просвете альвеол, в составе пенистого экссудата (рис. 53 - 57).
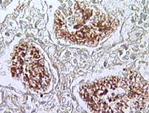
Рисунок 53.Рисунок 53. Предцисты и зрелые цисты с внутрицистными тельцами находятся в просвете альвеол, в составе пенистого экссудата. Окраска - silver methenamine
Рисунок 54.Рисунок 54. Предцисты и зрелые цисты с внутрицистными тельцами находятся в просвете альвеол, в составе пенистого экссудата. Окраска - silver methenamine
Рисунок 55.Рисунок 55. Предцисты и зрелые цисты с внутрицистными тельцами находятся в просвете альвеол, в составе пенистого экссудата. Окраска - silver methenamine
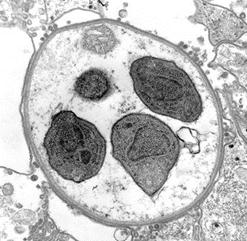
Рисунок 56.Рисунок 56. Электронная микроскопия цисты. Видны nucleus и mitochondria
Рисунок 57.Рисунок 57. Электронная микроскопия цист, находящихся на различных стадиях развития
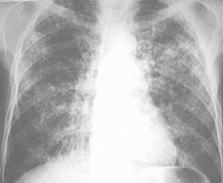
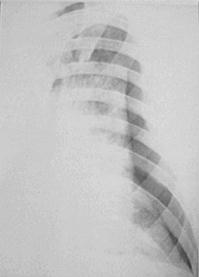
Патогенез пневмоцистной инфекции определяется механическим повреждением интерстициальной выстилки легкого как самим паразитом, так и воспалительными клетками: стенки альвеол инфильтрируются мононуклеарами, клетки интерстиция — плазматическими клетками. Толщина альвеолярной стенки увеличивается в 5-20 раз против нормальной; повреждение сурфактанта приводит к ослаблению растяжимости альвеол при длительной экскурсии. Вследствие этих процессов развивается альвеолярно-капиллярный блок, приводящий к тяжелой аноксии и смерти больных от нарастающей дыхательной недостаточности. Пневмоцистная пневмония (Пп) послужила основанием для диагностики первых 5 случаев СПИДа, описанных в 1981 г., и натолкнула клиницистов на мысль о возможном этиологическом агенте, вызывавшем иммунодефицит у ранее здоровых молодых людей-гомосексуалистов Лос-Анжелеса. Эта инфекция стала в дальнейшем наиболее частым СПИД-ассоциируемым заболеванием. Решающее значение Пп для прогноза течения СПИДа способствовало значительной интенсификации исследований иммунобиологии и патогенеза данной инфекции. У паразитов были обнаружены антигенные детерминанты, идентичные эпитопам некоторых человеческих тканей. Антигенной мимикрией часто объясняют широко распространенное пневмоцистоносительство. Нарушения в клеточных и гуморальных звеньях иммунитета при СПИДе приводят к переходу из латентной к манифестной форме пневмоцистной инфекции. Пп у больных СПИДом развивается медленно, исподволь. От начала продромальных явлений до появления основных легочных симптомов проходит 4 нед. и более, лихорадка и одышка выражены нерезко, постепенно усиливается непродуктивный кашель. Кроме «легочной» формы пневмоцистной инфекции у больных СПИДом иногда обнаруживаются внелегочные поражения (например, пневмоцистные поражения печени, кожи, кишечника, щитовидной железы и др.). Диагноз Пп у больных СПИДом не представляет таких сложностей, какие встречаются при подозрении Пп у больных с иммунодефицитными состояниями другой этиологии. Необычная легкость диагностики связана с «заведомо» предполагаемой причиной появившихся у больного с ВИЧ-инфекцией дыхательных расстройств. Однако найти самого возбудителя оказывается достаточно сложно. Существует 4 показателя, по которым диагноз Пп может предполагаться у больного с ВИЧ-инфекцией: 1) повышение СОЭ > 50 мм/час; 2) повышение ЛДГ > 220 ME; 3) выявление молочницы или волосатоклеточной лейкоплакии; 4) обнаружение на рентгенограммах диффузных интерстициальных изменений, распространяющихся от корней к периферии. Необходимость выявления указанных показателей связана с минимальной информацией, получаемой при объективном осмотре больного. Что касается важности рентгенологических исследований грудной клетки, то при Пп информация от этого метода диагностики существенно меньше, чем при других видах пневмоний. Хотя у 75% больных СПИДом с Пп на рентгенограммах определяются диффузные интерстициальные инфильтраты (рис. 52, 53), аналогичные изменения могут наблюдаться и при цитомегаловирусной (ЦМВ) пневмонии, и при атипичном микобактериозе, и при гистоплазмозе. У 5-10% больных не определяется никаких изменений на рентгенограммах грудной клетки, даже при явной клинике Пп. Наконец, у 30-35% больных наблюдаются чрезвычайно затрудняющие диагностику атипичные признаки. Описываются следующие атипичные находки при пневмоцистозе у больных СПИДом: 1) асимметричные инфильтраты, в некоторых случаях инфильтраты были преимущественно периферической или двусторонней латеральной локализации; 2) лобарные или сегментарные инфильтраты; 3) локализация легочного процесса в верхних отделах легких, что требует дифференциального диагноза с туберкулезом легких; 4) единичные легочные узлы; 5) у 7% больных отмечаются тонкостенные «кистозоподобные образования», не заполненные фибрином или жидкостью.
Рисунок 52.Рисунок 52. Диффузные билатеральные интерстициальные инфильтраты в легком у больного СПИДом
Рисунок 53.Рисунок 53. Диффузный инфильтрат в легком у больного СПИДом Паразитологическое исследование является основным методом верификации диагноза. Считается, что пневмоцисты могут быть обнаружены в альвеолярно-бронхиальном секрете, мокроте из гортани, глотке и даже в желудочном содержимом, однако содержание пневмоцист в перечисленном материале крайне неодинаковое. Эффективность исследования материала, взятого из гортани и глотки, очень низкая (5-15%). Для исследования берут либо самостоятельно отходящую мокроту, либо мокроту, полученную с помощью ингаляции. Более эффективно исследование мокроты после ингаляции, при аспирации ее с помощью бронхоскопа. Было установлено, что при первых двух способах количество цист в препарате бывает небольшим (3-6 в мазке), в то время как при последнем способе их количество существенно большее (до 50 цист в мазке). Из этого следует, что нахождение в мазке мокроты даже единичных цист при наличии соответствующих клинических симптомов может быть расценено как верификация диагноза.
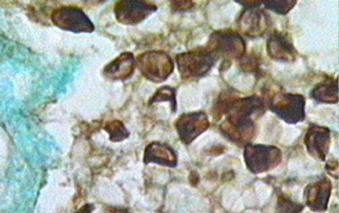
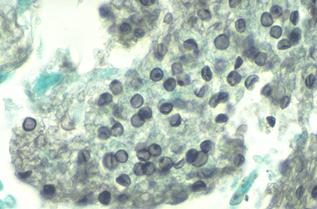
Рисунок 54.Рисунок 54. Цисты и трофозоиты, обнаруживаемые при бронхоскопии Еще более надежным является исследование лаважной (промывной) жидкости (87%). Эта жидкость получается при инсталляции в дистальные отделы бронхиального дерева теплого физиологического раствора с последующей его аспирацией. Аспират может быть разделен на 3 порции: бронхиальный, бронхоальвеолярный и альвеолярный. Исследованию может быть также подвергнут биоптат, полученный при трансбронхиальной, чрескожной, аспирационной или открытой биопсии легкого. Наилучшие результаты получаются при открытой биопсии легкого (100%). Этот метод приравнивается к хирургическому вмешательству, хотя состояние больных, как правило, не позволяет к нему прибегнуть. В то же время с помощью этого метода получается достаточно большой объем материала, и ложно-отрицательный результат исследования исключается. Достаточно эффективные методы лабораторного культивирования Pneumocystis carinii пока не разработаны. Серологические методы диагностики также мало эффективны. Антитела часто обнаруживаются у здоровых людей. Диагноз обычно устанавливается на основании цитологического исследования бронхоальвеолярного лаважа или ткани легкого, полученного путем трансбронхиальной биопсии при бронхоскопии (рис. 54). Зрелые формы P. carinii содержат до восьми спорозоитов. При разрыве пневмоцисты спорозоиты освобождаются, превращаются в трофозоиты и цикл повторяется. Материал для микроскопии обычно окрашивают Gomori methenamine silver (GMS), cresyl violet, или toluidine blue. В срезах ткани легкого пневмоцисты идентифицируются по окраске клеточной стенки. Лучший результат получается при окраске GMS. GMS окраска дает более контрастное изображение тканевых срезов и мазков. Микроорганизмы имеют темно-коричневый или черный цвет. Пневмоцисты обычно группируются по 5-7 образований. Они имеют округлую или эллиптическую форму иногда с заостренным концом с центральной затемненной обрастью (рис. 55-58).
Для диагностики пневмоцистоза используют также иммунофлюоресцентные, иммуногистохимические методы. В последние годы все более широко начинает применяться метод цепной полимеразной реакции. Для лечения пневмоцистоза у больных СПИДом предложено много препаратов с многочисленными схемами ведения больных. Такая разнообразная лечебная стратегия объясняется частотой побочных эффектов, которые развиваются у больных, ослабленных самой ВИЧ-инфекцией, вследствие чего терапию пневмоцистоза часто приходится прерывать. Наиболее длительно применяющимся для лечения Пп препаратом является пентамидин. Дозировки пентамидина не отличаются от таковых у больных без ВИЧ-инфекции, однако частота побочных эффектов значительно выше — 45%. Побочные эффекты развиваются в среднем через 10,4 дня (от 6 до 16 дней): анемия, нейтропения, гипонатриемия, повышение уровня креатинина, почечная недостаточность, брадикардия, панкреатит, гипогликемия или гипергликемия. Для предотвращения указанных эффектов предложено проведение ингаляций пентамидина по 600 мг на 1 ингаляцию. Курс — 21 день. При таком введении препарата отмечено только появление кашля и бронхоспазма, который обычно легко купируется бронходилятаторами. Однако часть исследователей считает, что ингаляционная терапия пентамидином способствует возникновению ранних рецидивов пневмоцистоза, чаще отмечаются внелегочные поражения и спонтанный пневмоторакс. Такие осложнения связаны зачастую с неправильным выбором размера частиц для ингаляций. Если частицы ингаляционной смеси имеют диаметр 10 мкм они оседают или в ротоглотке или в верхних дыхательных путях, оптимальным же является размер частиц до 1-2 мкм в диаметре. Терапия бисептолом больных СПИДом с Пп также представляет большие трудности из-за частых (45-50%) случаев развития побочных осложнений: 1) сыпь; 2) тошнота/рвота; 3) анемия; 4) нейтропения. Наиболее часто осложнения появляются через 11,5 дней от начала терапии, обычно прекращаются после прерывания лечения. К препаратам резерва относится дапсон, который назначают по 100 мг перорально в течение 21 дня. В связи с меньшей эффективностью, чем первые два препарата (61%) его не рекомендуют для лечения тяжелых форм пневмоцистоза. Предпочтителен курс лечения дапсоном в сочетании с триметопримом: 100 мг дапсона + 20 мг/кг/день триметоприма (в 4 дозах), курс — 21 день. Эффективность лечения 1 эпизода значительно выше, чем при лечении только дапсоном и составляет около 100%. Основным побочным эффектом от сочетания этих препаратов является развитие гемолиза у больных с дефицитом глюкозо-6-фосфат-дегидрогеназы. Так как эти два препарата обладают взаимоактивирующим действием, побочные эффекты от их сочетания также выше. Среди других значимых осложнений терапии отмечена метгемоглобинурия, при появлении которой препараты необходимо отменять, а больному следует назначить в/в 1-2 мг/кг метиленовой сини. Применение механической вентиляции легких оценивается неоднозначно: большинство исследователей считают ее применение ненужным и даже противопоказанным из-за снижения сроков выживания у многих больных. В отличие от больных Пп на фоне иммунодефицитных состояний, у больных СПИДом Пп — одна из основных причин летальных исходов, после первого эпизода пневмоцистоза средний период выживания около 9,7 мес. Через 6 мес. после первого эпизода у 18% больных развиваются рецидивы болезни. Более 60% больных СПИДом имеют не менее 2 рецидивов в течение 12-18 мес. после первого эпизода болезни. В связи с этим чрезвычайно актуальной является проблема профилактики инфекции. Различают первичную химиопрофилактику, которую назначают больным с риском развития пневмоцистоза (с содержанием CD4 < 200/мм) и вторичную, для больных, уже перенесших пневмоцистоз. Для первичной химиопрофилактики используют атовахон в дозе 300 мг в мес. или бисептол (по 480 мг/день или по 960 мг/день). Высоко оценивается интермиттирующая химиопрофилактика бисептолом по 960 мг х 3 в нед. по сравнению с ежедневным приемом: в первом случае в 2,4 раза реже развиваются побочные осложнения, чем во втором. Профилактика. Основной этап — раннее выявление и изоляция больных. Общие мероприятия аналогичны таковым при прочих респираторных инфекциях. Дата добавления: 2015-02-02 | Просмотры: 2172 | Нарушение авторских прав |