|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
В.Л. Виноградов
Первой и основной задачей анестезиолога является обеспечение эффективного и адекватного уровня анестезии на всех этапах выполнения оперативного вмешательства. Понятие адекватности анестезии включает в себя как необходимые компоненты: эффективное обезболивание — мы должны гарантировать больному отсутствие любых болевых ощущений, связанных с проведением анестезии и операции; амнезию — пациент не должен «присутствовать на собственной операции», т.е. не должен помнить ничего, связанного с оперативным вмешательством; нейовегетативное торможение — об эффективности которого в первом приближении принято судить по косвенньш признакам: отсутствие реакции АД, ЧСС и т.д. Миоплегия, управление гемодинамикой и другие компоненты общей анестезии определяют качество анестезии, но не влияют на ее глубину. На начальных этапах развития анестезиологии все компоненты общей анестезии достигались применением одного какого-либо наркотического агента. Однако это требовало применения значительных доз общего анестетика и довольно глубокого угнетения жизненно важных структур организма. Такая анестезия, безусловно, была связана с большим риском для больного. В современных условиях, когда используется более прогрессивный метод наркоза — общая комбинированная анестезия, при котором сон, аналгезия, мышечная релаксация, нейровегетативная блокада и т.д. селективно обеспечиваются применением различных препаратов, — проблема контроля глубины наркоза становится еще более необходимой. Хотя следует признать, что в настоящее время вопрос о передозировке анестетиков и, как следствие, неоправданно опасной глубине наркоза не стоит так остро, как в эпоху мононаркоза. Более актуальной становится проблема неоправданно поверхностного наркоза. Анестезиолог порой лишен возможности решить вопрос о достаточности анестезии, чтобы предотвратить наличие сознания и ощущение боли у больного, так как в условиях комбинированного обезболивания ни один из существующих методов контроля глубины анестезии не является полностью надежным. Сообщения о случаях неадекватной глубины анестезии начали появляться одновременно с публикациями о первых опытах операций под наркозом. В 1959 г. Cheek D.B. предположил, что больной даже при глубокой анестезии способен слышать происходящее вокруг на подсознательном уровне, но обычно пациенты не могут вспомнить произошедшего во время операции. Однако интраоперационный период можно воспроизвести в состоянии гипноза. Такую возможность продемонстрировал в 1965 г. Levinson B.W. Ему удалось заставить больных, не имевших во время операции явных признаков сознания, вспомнить ход операции под гипнозом. В настоящее время признается, что сознание сохраняется при наличии или отсутствии последующей памяти на события даже на фоне вполне адекватной, как мы полагаем, анестезии. По литературным данным, частота случаев сохранения сознания во время операций колеблется от 0 до 4% и имеет место даже при «хорошо проводимых анестезиях». Однако при применении техники гипноза удается восстановить слуховые воспоминания о ходе операции у 20—30% пациентов. Этому могут способствовать следующие предпосылки: — легкая ингаляционная анестезия; — тотальная внутривенная анестезия; — неполадки аппаратуры; — ожирение; — хронический алкоголизм или лекарственная зависимость; — гиповенгиляция; — высокая концентрация кислорода; — ошибки медицинского персонала. Также повышают риск интраоперационного пробуждения и определенные клинические ситуации. Считается, что чаще сохранение сознания наблюдается при операциях в кардиологии, акушерстве, экстренной травматологии и у детей. Проблема пробуждения во время операции остается не только большой этической и теоретической проблемой. Наличие сознания и боли во время операции может иметь далеко идущие последствия для физиологического состояния больного, так как неадекватная анестезия в лучшем случае вызывает неприятные ощущения у пациента, а в худшем приводит к развитию шока той или иной степени выраженности и срыву всей стройной системы адаптационных механизмов, что обусловливает в итоге нарушения органного и системного характера и, конечно же, отрицательно сказывается на течении послеоперационного периода и результатах хирургического лечения в целом. Сознательное воспоминание травматических моментов операции можно подавить, но сопутствующие им эмоции не угнетаются и способствуют проявлению тревоги и депрессии в последующем. «Невидимые шрамы операции» — так называет их Cheek D.B. И упреком анестезиологам служит исследование, выполненное Moermann N. с соавт. (1992), показавшее, что четверть из 678 человек, перенесших операции под общим обезболиванием, по той или иной причине не удовлетворены качеством проведенного наркоза.
КОНЦЕПЦИЯ МОНИТОРИНГА ГЛУБИНЫ АНЕСТЕЗИИ Несмотря на внешнюю простоту, на самом деле очень трудно ответить на вопрос о том, как определить и наблюдать за губиной анестезии, так как отсутствие сознания, аналгезия, релаксация — это величины типа «все или ничего». Наблюдая за пациентом, анестезиолог должен решить для себя ряд проблем типа: если у пациента возникает двигательная реакция в ответ на хирургическую манипуляцию, то как это можно расценивать — как побочный эффект или неадекватную анестезию? Если глубина анестезии была достаточна в предоперационном периоде, то может ли хирургическая агрессия изменить ее? Таким образом, глубина анестезии — это категория, зависящая не только от эффекта лекарственного вещества и его концентрации, но и от афферентной импульсации. Такой подход осложняет мониторинг глубины анестезии, так как, будучи зависимым от различных условий, уровень анестезии будет ступенчато изменяться. Поскольку интенсивность хирургических стимулов непредсказуема, то современный подход к этой проблеме означает определение заранее возможного ответа со стороны организма и дозированного введения анестетиков в зависимости от предполагаемой травматизации. В идеале для определения глубины наркоза следовало бы нанести больному четко определяемый и строго дозированный стимул и отметить эффект. На практике таким стимулом часто является кожный разрез. Однако он количественно не верифицируется, зависит от человека, степени травматизации и от многих других причин. К тому же проводится он однократно. Поэтому изучаются и предлагаются другие разновидности неинвазивной стимуляции, которые могли бы дозироваться и наноситься неоднократно. Проблема, ассоциирующаяся с измерением глубины анестезии, осложняется и отсутствием универсальных определений глубины наркоза, которые должны быть предельно понятны и выражены клинической терминологией.
МЕТОДЫ КОНТРОЛЯ ГЛУБИНЫ АНЕСТЕЗИИ Общеклинические Со времен внедрения во врачебную практику эфира и хлороформа ориентиром для определения глубины анестезии служила клиника. В 1847 г. John Snow был первым, кто предпринял попытку классифицировать стадии наркоза. Основываясь на изменениях в характере дыхания, сознания, произвольных и непроизвольных движениях мускулатуры, ресничном рефлексе, Show выделил пять уровней эфирного наркоза. В 1937 г. Guedel A.E. ввел свою классификацию признаков, характеризующих определенные стадии общей анестезии, которые стали «золотым стандартом», определяющим ведение анестезиологического пособия. Исследуя такие клинические признаки, как уровень сознания, мышечный тонус, спонтанное дыхание, влажность кожных покровов, реакцию зрачков на боль, движение глазных яблок, наличие или отсутствие глотательного и рвотного рефлексов, Guedel выделил четыре стадии общей анестезии: I стадия — аналгезия, II стадия — возбуждение, III стадия (стадия хирургической анестезии) была разделена на четыре уровня, к IV стадии автор отнес дыхательный паралич и смерть. В дальнейшем многие исследователи пытались модифицировать эту классификацию. Детализации и обработке подвергались первые три стадии, осталась незыблемой лишь IV стадия. Во всех схемах она считается токсической, заканчивающейся смертью больного. Однако И.С. Жоров в 1959 г. в своей классификации заменил IV стадию, как «стадию интоксикации и смерти», на «период пробуждения» больного, справедливо отмечая, что «...смерть в связи с наркозом может произойти и в начальных его стадиях, еще до начала операции.... Отсутствие стадии пробуждения делает незавершенными все существующие классификации и не дает полного представления о течении наркоза от его начала до конца». По-видимому, как это часто бывает, каждый из приведенных авторов прав по-своему. 1940 год ознаменовался началом применения в клинической практике мышечных релаксантов. Начиная с применения малых доз d-тубокурарина для индуцирования 2—3 уровня III стадии наркоза по Guedel на фоне высоких концентраций ингаляционных анестетиков, анестезиологи очень быстро перешли на применение высоких доз миорелаксантов в сочетании с ИВЛ, несколько снизив при этом концентрацию вдыхаемых анестетиков, так как это существенно снижало риск кардиоваскулярных и респираторных осложнений. С появлением миорелаксантов и ИВЛ непроизвольные мышечные движения перестали быть показателями глубины анестезии. В настоящее время использование клинических признаков для контроля наркоза основано на том, что анестезия и сенсорная активация являются антагонистами. При этом следует помнить, что клиническая картина ответа может меняться под влиянием параллельно вводимых препаратов (вазодилататоров, B -адреноблокаторов, транквилизаторов и т.д.) и зависеть от индивидуальных особенностей организма. Подобные недостатки не исключают использования показателей центральной и периферической гемодинамики (ЦиПГ), которые отражают эффективность сенсорной защиты. Однако мониторинг ЧСС, АД, МОС, ЛАД, ФП, наиболее частая комбинация, используемая в настоящее время в клинике, при всей своей ценности имеет известные ограничения информативности, обладает определенной инерционностью и не всегда легко и правильно интерпретируется. «Классический» вариант реакции ЦиПГ (т.е. одновременное увеличение ЧСС, АД, МОС, ЛАД, ОПС и т.д.) характерен только для начальных этапов длительных и травматичных операций. В условиях же массивной кровопотери и интенсивной инфузионно-трансфузионной терапии (ИТТ) эта реакция определяется темпом кровопотери, характером ИТТ, а не эффективностью проводимой анестезии. На данном этапе нередки случаи неоправданно поверхностной анестезии.
Исследование некоторых показателей метаболизма Мониторинг параметров КОС и кислородно-транспортной функции крови (КТФк), а также динамики гормонов — «индикаторов стресса», по-видимому, может служить наиболее точным отражением адекватности обезболивания. Однако экспресс-методов определения этих показателей, способных работать в режиме on line, пока не разработано.
Концепция минимальной альвеолярной концентрации (МАК) Определенным шагом на пути создания новых методов контроля глубины анестезии явилась разработка Eger E.I. в 1965 г. концепции о минимальной альвеолярной концентрации ингаляционного анестетика (МАК). Полностью концепция была сформирована к концу 80-х годов. МАК — это минимальная концентрация ингаляционного анестетика в альвеолярном газе, предотвращающая двигательную реакцию на стандартный болевой раздражитель (разрез кожи или электрический импульс) у 50% пациентов. В настоящее время получены значения МАК для всех ингаляционных анестетиков (табл. 19.1). МАК-концепция четко продемонстрировала, что необходимая для предотвращения двигательных реакций концентрация анестетиков должна быть выше, чем для выключения сознания или проводниковой чувствительности. Используемые в анестезии медикаменты снижают МАК, чем оправдывается их применение с целью уменьшения дозы основного анестетика. Например, закись азота уменьшает МАК всех использующихся в настоящее время анестетиков (табл. 19.1). Величина МАК является весьма надежным количественным критерием действия анестетика, и эта концепция оказалась важным шагом на пути разработки методов контроля глубины анестезии, установив взаимосвязь между дозой анестетика и его эффектом. Вместе с тем теория альвеолярных концентраций не лишена серьезных недостатков: — концентрация анестетиков в выдыхаемом газе не всегда отражает его концентрацию в артериальной крови; — МАК дает представление лишь об одной точке кривой «доза — эффект». Попытка сравнения эффекта двух анестетиков при 1,5 и 2 МАК не всегда правомерна, так как кривые «доза — эффект» могут быть не параллельны; — не у всех анестетиков существует линейная зависимость между наркотическим и аналгетическим эффектом; — расчет МАК применим лишь в случае проведения анестезии ингаляционными анестетиками.
Таблица 19.1 Минимальная альвеолярная концентрация (МАК) для различных газовых анестетиков (Barash P. et al., 1992)
Дополнительные методы В качестве возможных дополнительных способов оценки глубины анестезии рядом исследователей изучались и изучаются методы, позволяющие на основании анализа косвенных показателей оценить эффективность проводимого обезболивания. К числу последних относятся: — электромиография лобных мышц; — мониторинг спонтанной и спровоцированной сократительной активности нижнего отдела пищевода; — анализ фотоплетизмограммы; — метод «изолированного предплечья»; — анализ респираторной синусовой аритмии; — поглощение O2 и продукция СО2; — математический анализ ритма сердца; — периферическая и центральная термометрия и др. Эти показатели также изменяются в зависимости от глубины анестезии, но они не нашли широкого применения в анестезиологии или при дальнейшем изучении выявилась их недостаточная информативность. Однако мы позволим себе рассмотреть некоторые из них, отмечая оригинальность подхода в попытке решения обсуждаемой проблемы.
Метод «изолированного предплечья» Техника метода заключается в наложении турникета на плечо больного еще до введения миорелаксантов. Таким образом, сохраняется нейромышечная передача ниже уровня наложения турникета. Наблюдая за появлением движения в «изолированном предплечье» в ответ на речевые команды или хирургическую стимуляцию, можно судить об уровне проводимой анестезии. Методика не получила широкого применения из-за опасности развития ишемии в конечности.
Электромиография лобной мышцы Мониторинг глубины анестезии при помощи электромиографии лобной мышцы возможен из-за особенностей иннервации ее за счет висцеральных волокон лицевого нерва и веточек тройничного нерва, оставляющих «окно» для изучения вегетативной нервной системы. Таким образом, даже в условиях тотальной миоплегии лобные мышцы сохраняют возможность реагировать сокращением на хирургическую агрессию. Этот феномен, получивший название «симптом нахмуривания бровей», лег в основу ряда анестезиологических мониторов, например АВМ, DATEX, Финляндия. Paloheimo M. (1989), один из энтузиастов этого метода, сообщает, что неадекватная анестезия или пробуждение в конце операции всегда сопровождается изменением в амплитуде фронтальной ЭМГ, хотя это часто очевидно и по данным других методов мониторинга. Виккерс M. (1991) также высказывает сомнение в абсолютной достоверности этого метода, так как по характеру кривой ЭМГ нельзя ничего сказать относительно сознания больного.
Мониторинг спонтанной и спровоцированной сократительной активности нижнего отдела пищевода Нижний отдел пищевода включает в себя гладкую мускулатуру, на которую мышечные релаксанты не оказывают влияния. Он получает основную иннервацию из блуждающего нерва с наличием механизмов центрального контроля в стволе мозга. Частота и амплитуда сокращений регистрируются с помощью введенного зонда с баллончиком. Исследования показали, что при отсутствии побочных факторов, таких, как применение ганглиоблокаторов, атропина или проведения эпидуральной анестезии на уровне грудного отдела, с уменьшением дозировки анестетика увеличиваются частота спонтанных и амплитуда спровоцированных сокращений. Складывается впечатление, что подобный мониторинг имеет перспективы для первичной оценки глубины анестезии, когда применяются ингаляционные анестетики. Его эффективность при использовании различных внутривенных анестетиков находится в стадии изучения.
Вариационная пульсометрия В настоящее время известно несколько десятков методов анализа сердечного ритма. Отправной точкой является числовая последовательность значения R—R -интервалов. В этой последовательности содержится информация о процессах, протекающих не в самом сердце, а различных звеньях системы управления вегетативным гомеостазом, поэтому изучение вариабельности ритма сердца позволяет вьмснить степень выраженности адаптационных процессов в организме в ответ на то или иное стрессовое воздействие. Ряд исследователей отмечают, что между изменениями функции сердечно-сосудистой и симпатоадреналовой систем, наступающих в ходе операции и анестезии, наблюдается высокая корреляционная зависимость. Однако наряду с сообщениями об успешном применении вариационной пульсометрии для оценки выраженности операционного стресса в литературе имеются работы, в которых использование этого метода привело к получению неинтерпретируемых данных. Это обусловлено наличием «аномальных R—R -интервалов, соответствующих нарушениям проводимости сердца, так как даже сравнительно небольшое их число приводит при расчетах к весьма значительным отклонениям от реальных величин. Поэтому этот вид мониторинга неприменим у больных с постоянными формами нарушения ритма. Снижает ценность и оперативность метода необходимость набора определенного числа кардиоинтервалов, уменьшение которого ведет к возрастанию степени ошибки при вычислении, а увеличение нерационально из соображений оперативности получения данных.
Нейрофизиологические методы контроля ЦНС — главная мишень для анестетиков. Поэтому следует признать, что наиболее точным и информативным бьш бы прямой контроль деятельности ЦНС как интегративной системы реагирования на неэффективность анестезиологической защиты. Современные методы мониторинга неврологических функций пытаются уйти от недостатков, связанных с применением клинических признаков. При этом используют оценку спонтанной и вызванной ЭЭГ-активности.
Электроэнцефалография Частотный спектр ЭЭГ простирается от 0,5 до 100 Гц, хотя большая часть его мощности (99%) сконцентрирована в диапазоне от 1 до 30 Гц. При визуальном анализе ЭЭГ выглядит как сложный апериодический волновой процесс. Появление сигналов флуктуирует в течение дня и циклически меняется в ходе сна. Существует 4—5 основных классов ЭЭГ-частот. Они были установлены на основе применения первых инструментальных методов и находятся в следующих пределах: d(0,5—3 Гц), t (4—7 Гц), a (8—13 Гц), β1 (14—17 Гц) и β2 (свыше 18 Гц). Переход от состояния бодрствования ко сну, применение лекарств, некоторые патологические состояния сопровождаются изменениями ЭЭГ (табл. 19.2). Впервые изменение картины ЭЭГ во время индукции в анестезию описал Gibbs F.A. в 1937 г. В дальнейшем исследования по определению стадий общей анестезии на основе ЭЭГ бьши проведены для: эфира, циклопропана, метоксифлурана и барбигуратов. Внутривенные и ингаляционные анестетики неодинаково влияют на ЭЭГ, и их эквипотенциальные концентрации продуцируют сильно различающиеся ЭЭГ-частоты (табл. 19.3). Тем не менее всеобщее правило изменения картины ЭЭГ под их действием, предложенное Faulconer A.J. и Bickford R.G. (1990), которое проявляется как «замедление частоты и первоначальный подъем, за которым следует снижение амплитуды ЭЭГ в зависимости от клинического диапазона глубины анестезии», может быть применено для большинства используемых сегодня анестетиков.
Таблица 19.2 Изменения ЭЭГ, наступающие при введении некоторых лекарственных препаратов и патологических состояниях (Barash P. et al.. 1992)
Последующие достижения в автоматизированной обработке ЭЭГ позволили дополнить визуальный анализ ЭЭГ частотным и периодиограммным, облегчающими и ускоряющими количественную оценку изменений частотно-амплитудных характеристик ЭЭГ. Хотя Mori К. (1993) считает, что применение обрабатывающих устройств не позволяет извлечь дополнительную информацию, заключенную в первичной ЭЭГ, и обученный персонал может получить больше информации из необработанной ЭЭГ, чем из прошедшей обработку.
Таблица 19.3 ЭЭГ-частоты, продуцируемые различными анестетиками в эквипотенциальных концентрациях
Принцип работы, использующийся в устройствах для обработки ЭЭГ, — это трансформация осцилляций ЭЭГ на основе анализа Fourier в цифровые, выделяемые по их частотному компоненту. К основным, наиболее распространенным, методам количественной оценки ЭЭГ относится частота края спектра (spectral edge frequency — SEF). В зависимости от взятого частотного диапазона SEF подразделяют на SEF-95, SEF-90, SEF-50. Например, SEF-95 определяется вычислением отношения мощности взятого частотного диапазона, в который входит не менее 95% мощности данной частоты, к общей мощности. Она выражает степень замедления и ускорения активности ЭЭГ. Отмечено, что применение фторотана изменяет SEF-95 в зависимости 8 Гц/МАК, энфлюран 20 Гц/МАК. Тиопентал снижает SEF-95 с 25 Гц при бодрствовании до 13 Гц в хирургической стадии наркоза. SEF-50 называют среднемедиальной частотой, на которую приходится не менее 50% общей мощности сигнала. SEF-50 считается некоторыми исследователями наиболее точным методом, отражающим глубину анестезии, и менее инертным, чем SEF-95. Электроэнцефалография была предложена как возможная мера оценки глубины анестезии при использовании эфира, фторотана, этомидата, метокситона, тиопентала, изофлюрана, пропофола. Большинство исследований строилось на определении взаимосвязи между изменением ЭЭГ и концентрации препарата в крови, включая и наблюдение за реакцией на сенсорную стимуляцию. Отмечено, что ЦНС на фоне недостаточной анестезии в ответ на поступление ноцицептивной импульсации из зоны оперативного вмешательства отвечает «реакцией активации», выражающейся в десинхронизации ЭЭГ и переходе к более быстрой электрической активности. Однако в связи с появлением ряда оригинальных, в первую очередь неингаляционных, средств анестезии (дроперидол и фентанил, препараты для атаралгезии, калипсол), расширением применения комбинированной анестезии было отмечено, что столь огромное значение, придаваемое ЭЭГ при мониторинге глубины и адекватности анестезии, может оказаться иллюзорным. Вызываемые этими препаратами изменения невозможно было уложить в рамки привычных клинических и электроэнцефалографических классификаций наркоза. Спонтанная ЭЭГ в условиях комбинированного анестезиологического пособия оказалась близка к ЭЭГ бодрствования, несмотря на наличие общей анестезии и арефлексии. Или, наоборот, отмечалось значительное запаздывание в развитии клиники наркотического состояния от ЭЭГ-картины (например, при применении натрия оксибутирата). Последние исследования показали, что пока не найден «золотой стандарт», который позволил бы соотнести изменения ЭЭГ с глубиной комбинированной анестезии. Это объясняется полифармацией анестезирующих веществ и связанными с этим разнонаправленными изменениями ЭЭГ. Более того, даже в условиях мононаркоза изофлюраном, по данным Rampil I.J. и Las-ter M.J. (1992), не отмечаются дозазависимые изменения ЭЭГ при использовании различных концентраций изофлюрана при наркозах. Drummond J.C. et al. (1991), анализируя данные ряда энцефалографических показателей во время анестезии с использованием изофлюрана и закиси азота, пришли к выводу, что ни один из них не может служить достоверным признаком, предсказывающим возбуждение ЦНС в ответ на хирургическую стимуляцию. По мнению Stanski D.R., причина в том, что параметры ЭЭГ, применяемые для количественной оценки эффектов фармакологических препаратов и глубины анестезии, бьыи выбраны эмпирически. Поэтому нет теоретически обоснованной причины тому, чтобы предпочесть одну характеристику другой. В настоящее время нет ясного или статистически мотивированного выбора того или иного критерия как идеального. До последнего времени процессы возбуждения у пациентов под наркозом принято определять по десинхронизации ЭЭГ и появлению быстрых волн. Однако изменения на ЭЭГ при болевой стимуляции, как выяснилось, могут выражаться не только десинхронизацией, но и смещением в сторону медленных волн (1—3 Гц). Подобный феномен, названный «парадоксальным возбуждением», может представлять характеристики ЭЭГ в условиях возросшей ноцицептивной стимуляции, сходные с теми, что наблюдаются при углублении анестезии. Таким образом, в настоящее время считается, что для расшифровки ЭЭГ наиболее удобна ситуация с использованием одного анестетика, однако это бывает весьма редко, и поэтому применение сложной и дорогостоящей ЭЭГ-аппаратуры в плане интерпретации шубины наркоза в подавляющем большинстве случаев нецелесообразно. Поэтому в настоящее время интраоперационньш мониторинг ЭЭГ в основном применяется для диагностики ишемии головного мозга, во время операций на экстра- и интракраниальных отделах бассейна сонных и верте-бральных артерий, для облегчения диагностики диффузных церебральных расстройств при многих заболеваниях, включая метаболические расстройства, лекарственные интоксикации, дегенеративные заболевания и гипоксию мозга, мониторинг рефлекторной инграоперационной гипотензии и гипоксемии как результата хирургических манипуляций. ЭЭГ «шаблоны» применяются для титрования дозы барбитуратов и контроля эффективности гипотермии для церебральной протекции при недостаточности кровообращения (circulatiry arrest). Также мониторинг ЭЭГ может быть использован для определения глубины анестезии во время вводного наркоза с использованием барбитуратов. При помощи анализа распределения спектральной мощности до ларингоскопии и интубации можно предсказать изменение артериального давления на эти манипуляции. Как хорошо известно, по АДсис до ларингоскопии нельзя прогнозировать гемодинамические изменения на эту процедуру. Полагают, что причина неудач в использовании электроэнцефалографического мониторинга глубины и адекватности проводимой анестезии происходит по следующим причинам: 1. По традиции, ЭЭГ-сигнал рассматривается как реализация случайного процесса и для его анализа применяются методы, основанные на преобразовании Fourier. Однако область применения этих методов в изучении ЭЭГ ограничена, так как интерпретация различных спектров мощности не наглядна и, более того, туманна и затруднительна. Спектральные методы оптимальны для регулярных (синусоидальных, симметричных) периодических сигналов, но применимость этих методов становится весьма ограниченной, когда сигналу присуща внутренняя нерегулярность без острых пиков и хорошо разграниченных частотных полос. 2. Электроэнцефалограмма не является мерой концентрации анестетика в веществе мозга, скорее она является мерой эффективности исполнения мозговых функций. Бесспорно, она — результат работы ЦНС. Но общепринятое мнение, что замедление ЭЭГ представляет собой подавление функциональной активности мозга — всего лишь эмпирическая корреляция, а не отображение механизма протекающего процесса.
Вызванные потенциалы Вызванные потенциалы (ВП) — это ответы ЦНС на специфические внешние стимулы. На сегодняшний день существует более двадцати хорошо изученных компонентов ВП. Однако с целью контроля глубины проводимой анестезии в клинике нашли применение в основном сенсорные ВП, а именно: сомато-сенсорные (ССВП) и слуховые (аудио) вызванные потенциалы (АВП). Одно из несомненных преимуществ этой методики перед всеми остальными — это возможность изучать реакцию в ответ на четко дозированный и повторяемый стимул, что обсуждалось нами выше. Считается, что амплитуда ВП, как соматосенсорных, так и слуховых, зависит от уровня антиноцептивной защиты. В то же время латенгность ВП отражает уровень общего угнетения ЦНС. Однако вполне вероятно, что ССВП, благодаря специфическим проводящим путям, отражают аналгетическое, а не гипнотическое влияние анестезии. Это можно обосновать теми наблюдениями, в которых при применении эквипотенциальных доз различных анестетиков закись азота подавляет ВП больше, чем другие ингаляционные анестетики, и по сравнению с наркотическими аналгетиками такие гипнотики, как этомидат и пропофол, без использования аналгезии не угнетают ВП. Тем не менее необходимо более детальное исследование возможности применения данной методики мониторинга болевой передачи у пациента под наркозом. Что касается АВП, то было отмечено, что с углублением анестезии происходит снижение амплитуды и увеличение латентности ответов. Однако подобный метод может быть достоверным только при использовании анестетиков, для которых не существует специфических рецепторов (изофлюран). Кортикальный компонент, мультисинаптический по своей природе, чувствителен и угнетается большинством анестетиков в зависимости от их дозировки. Этот компонент устойчив к препаратам, к которым имеются специфические рецепторы, такие, как бензодиазепины, опиоиды и кетамин. Возлагаются надежды на его использование в качестве детектора сохранения сознания во время анестезии. Однако, на наш взгляд, в самом методе применения ВП для анестезиологии имеется один принципиальный недостаток: вся информация, полученная в результате многоминутной записи ЭЭГ, сводится к изучению сигнала, длительность которого составляет лишь долю секунды. Иными словами, используется всего один процент той информации, которая зарегистрирована и может быть проанализирована. К тому же сама техника регистрации ВП позволяет производить только дискретный контроль за пациентом. Поэтому мы считаем, что в стратегическом плане более информативными, а, следовательно, и более перспективными являются методы, исследующие ЭЭГ целиком.
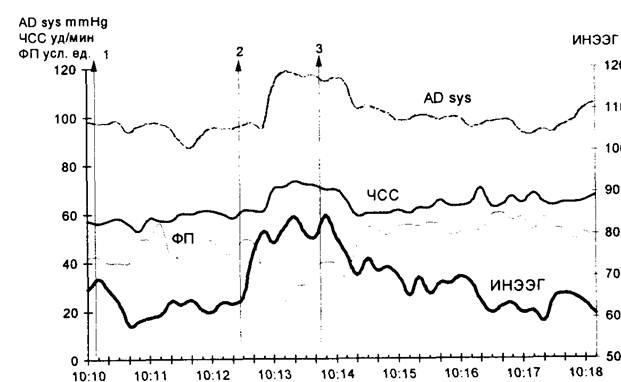
Информационный метод обработки ЭЭГ В последнее время появляется все больше данных о том, что степень детерминированности (предсказуемости) ЭЭГ может отражать функциональное состояние ЦНС. Из теории информации известно, что увеличение предсказуемости системы означает уменьшение ее информативности. Поэтому было бы резонно оценивать деятельность мозга по количеству информации, содержащейся в его биотоках. В Институте хирургии им. А.В. Вишневского РАМН был разработан новый метод определения количества информации, содержащейся в ЭЭГ, используя максимальное сжатие по амплитуде при линейном прогнозировании сигнала. Во время предварительных исследований на добровольцах было показано, что внешний информационный поток, независимо от его модальности (зрительный либо аудиогенный), но в зависимости от его интенсивности, поддерживает строго определенную активность ЦНС, что можно количественно определить, измеряя количество информации в ЭЭГ (информационная насыщенность ЭЭГ — ИНЭЭГ). В ходе клинического изучения оказалось, что динамика изменения ИНЭЭГ при хирургическом вмешательстве хорошо коррелирует с глубиной анестезии независимо от метода общей анестезии. Так, во время вводного наркоза уровень ИНЭЭГ снижался, а в ходе пробуждения больного после операции восстанавливался практически до исходного. Усиление хирургической стимуляции на фоне недостаточной анестезии приводил к резкому подъему информационного параметра на 10—15% (рис. 19.1). Характерно, что эти изменения опережали изменения со стороны гемодинамических показателей. На чувствительность метода не оказывали влияния длительность операции, величина и темп кровопотери, тогда как классические клинические признаки в основном теряют свою информативность.
Рис. 19.1. Фрагмент автоматизированной наркозной карты. Этап — начало операции: 1 — введение 0,1 мг фентанила; 2 — разрез кожи. Отмечается рост ИНЭЭГ, опережающий реакцию со стороны гемодинамических показателей; 3 — повторное введение 0,1 мг фентанила. Все показатели возвращаются к исходному уровню.
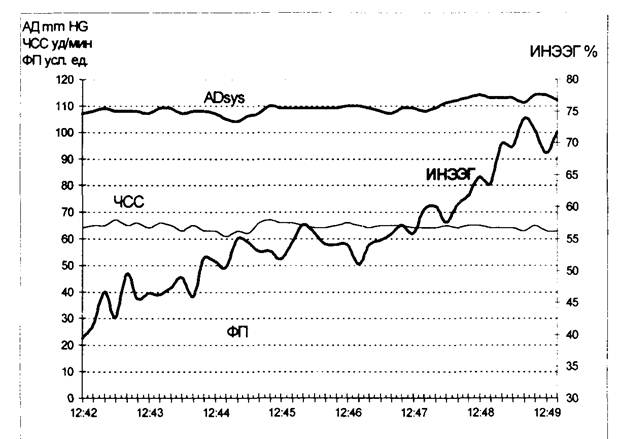
Рис. 19.2. Фрагмент автоматизированной наркозной карты
Таким образом, в ходе исследований нами была подтверждена концепция, что ослабление антиноцицептивной защиты, приводящее к активизации ЦНС, вызывает увеличение количества информации в ЭЭГ, что может быть не только объективно зафиксировано, но и количественно определено по информационным характеристикам ЭЭГ. Были отмечены и эпизоды роста ИНЭЭГ при стабильном ходе операции. Введение анестетиков в этой ситуации приводило к снижению информационного показателя (рис. 19.2). Мы не располагаем еще статистически достоверными результатами, чтобы однозначно сказать о возможности мониторинга интраоперационного пробуждения при помощи предложенной нами методики, но работа в этом направлении представляется весьма перспективной. На рисунке представлен рост ИНЭЭГ с 40 до 75%, что в условиях стабильного хода операции можно расценить как интраоперационное пробуждение. Реакция со стороны гемодинамических параметров проявляется только снижением амплитуды ФП.
Заключение Появление новых методов мониторинга, модификация и повышение точности уже традиционных, апробированных методов в целом не привели, точнее, не приблизили нас сообразно затраченным средствам к выработке однозначной оценки адекватности анестезии. То есть мы до сих пор порой не в состоянии ответить на вопросы: испытывает ли пациент боль? Достаточна ли анестезия, чтобы предотвратить интраоперационное пробуждение больного? Способность анестезиологов эффективно предупреждать развитие подобных ситуаций будет улучшаться по мере дальнейшего развития исследований. В этой ситуации становится понятна та важность соблюдения протоколов, если хотите, традиций или даже ритуала проведения анестезии, безукоризненного знания аппаратуры, механизма действия лекарств и их дозы. Жизнь человека слишком ценна, чтобы пренебрегать опытом ошибок и трагедий. Рекомендуемая литература: Битнер Р.Л. Сознание во время операции. — В кн: Осложнения при анестезии/Под ред. Ф.К. Оркина., Л.Х. Куперман.—М., 1985.— Т. 1.—С.ЗЗ 1—339. Бунятян А.А., Флеров Е.В., Толмачев В.А. и др. Компьютерный мониторинг биоэлектрической активности головного мозга в операционной // Анестезиология и реаниматология.—1985.—№.5.—С.6.—9. Викерс М.Д. Проблема сознания во время анестезии // Анестезиология и реаниматология.—1990.—№.5.—С.3—7. Ефуни С.Н. Электроэнцефалография в клинической анестезиологии. —М., 1960. Жоров И.С. Общее обезболивание в хирургии.—М.: Медгиз, 1959. Зильбер А.П. Клиническая физиология в анестезиологии и реаниматологии.—М., 1984. Клецкин С.3. Математический анализ ритма сердца (научный обзор).—М., 1979. Лихванцев В.В., Смирнова В.И., Ситников А.В. и др. Электрофизиология центральной нервной системы при эффективной анесте-зии//Вестн. РАМН.—1995.—№ 6.—С.22—27. Осипова Н.А. Оценка эффекта наркотических, аналгетических и психотропных средств в клинической анестезиологии. — Л.: Медицина, 1988. Петров О.В. Информационные методы оценки состояния и защиты ЦНС при хирургических операциях //Автореф. дисс.... док. биол. наук.—М., 1997. Субботин В.В. Влияния мониторинга вызванных потенциалов на безопасность выполнения оперативных вмешательств различной степени сложности в абдоминальной хирургии//Автореф. дисс.... канд. мед. наук.—М.,1994. Frost EAM. Electroencephalography and evoked potential monitoring.—In: Monitoring in Anesthesia—3rd ed. (ed. LJ Saidman, NT Smith).—Boston, Butterworth-Heinemann, 1993.—P. 203—223. Jones JG. Awareness under anaesthesia//Anaesthesia Rounds, 1988,21. Pichelmayer I, Lips 1), Kunkel H, eds. The electroencephalogram in anesthesia.—Berlin: Springer-Verlag, 1984. Stanski DR. Monitoring depth of anesthesia.—In: Miller RD (ed) Anesthesia, Churchill, Livingstone.—NY., 1990. Stanski DR. Monitoring for awareness during anesthesia.— In:Saidman LJ, Smith NT, ed. Monitoring in anesthesia, ed3.— Boston: Butterworth-Heinemann, 1993.—P. 225—231.
Глава 20
Дата добавления: 2015-02-06 | Просмотры: 1199 | Нарушение авторских прав |