|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
ВЗАИМОЗАВИСИМОСТЬ ОПУХОЛИ И ОРГАНИЗМА
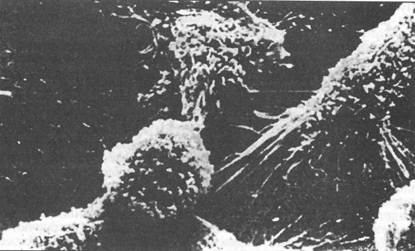
Развитие опухоли в животном организме тесно связано с его исходным состоянием. В то же время появление бластомы влияет на функциональную активность органов и тканей, всего организма в целом. Поэтому говорят об опухолевой болезни, ее системном проявлении. Суть в том, что резкое возрастание глюконеогенеза в мышцах, паренхиматозных органах как компенсация усиленного потребления глюкозы опухолевой тканью ограничивает возможность нормальных клеток синтезировать собственные белки и липиды. Опухолевая ткань, кроме того, сама является активным потребителем аминокислот, жиров, витаминов, особенно альфа-токоферола, других биологически активных веществ. В результате извращается функция не только пораженного органа, но и координированное функционирование органов и систем всего больного организма. Возникают сопутствующие опухолевому процессу сердечная, почечная, печеночная недостаточность, снижение резистентности к инфекции, что может привести к роковым для организма последствиям. Основными регуляторами, определяющими реакцию организма на бластоматозные факторы, являются нервная, эндокринная и иммунная системы. Их функциональное состояние может ограничить или способствовать развитию опухолевой болезни. Нервная система и опухоли. Чтобы под воздействием определенного фактора начался канцерогенез, он должен найти благоприятствующие развитию условия в организме. Эти условия многообразны, одно из них — состояние нервной системы. Эта система выполняет трофическую функцию, влияя на структуру, функцию, развитие органов и клеток воздействием на обмен веществ. Расстройство иннервации органа приводит к дистрофогенным проявлениям в клетке, свойственным и опухолевым процессам, синтезу необычных для клетки белков. Поэтому дистрофические процессы могут рассматриваться как предраковое состояние. Дистрофии нейрогенного происхождения, как показано нашим крупным патофизиологом А. Д. Сперанским (1937 г.), сопровождались в 15—20 % случаев папилломатозом, преимущественно на слизистой оболочке ротовой полости. Внутривенное введение клеток карциномы кроликам с денервированной селезенкой приводило к малигнизации именно этого органа; при денервации желудка опухоль развивалась в его стенках. Следовательно, состояние иннервации органов, ее нарушения могут стимулировать канцерогенез, метастазирование, способствовать рецидивам. Эксперименты и клинические наблюдения показывают, что у животных с сильным неуравновешенным типом нервной системы и слабым типом высшей нервной деятельности опухоли, индуцируемые химическими канцерогенами, возникают в большем числе случаев, более злокачественны, интенсивнее метастазируют. У животных же с сильным уравновешенным подвижным типом моделировать опухоли труднее, чаще наблюдается самопроизвольная регрессия. М. К. Петровой в лаборатории И. П. Павлова было установлено, что у собак с экспериментальными неврозами существенно повышается спонтанная заболеваемость опухолями разного генеза и локализации (рак щитовидной железы, саркомы челюсти и др.). Индуцирование опухоли химическими канцерогенами у подопытных животных с повышенной возбудимостью было более эффективным, чем у клинически здоровых. Получены прямые доказательства того, что невротические состояния являются факторами риска, значительно повышающими возможность заболевания раком. Возникновение и развитие самой опухоли не остается безразличным для организма, его нервной системы. Опухолевую болезнь сопровождает состояние стресса с фазовыми изменениями функциональной активности коры мозга и подкорковых образований. Первоначально превалирует фаза повышенной возбудимости нервной системы, в последующем нарастает угнетение деятельности головного мозга. Коррекцией нейрогуморального статуса в эксперименте удается существенно повысить противоопухолевую резистентность: тормозится химический канцерогенез, ухудшается прививаемость бластоматозных клеток, возрастает срок выживаемости подопытных животных. Эндокринная система и опухоли. От функционального состояния органов внутренней секреции во многом зависит бластоматозный рост. Основным пусковым механизмом, определяющим гормональное влияние на обмен веществ в клетках, органах, организма в целом, является система гипоталамус—гипофиз. Клетки гипоталамуса синтезируют и выбрасывают в кровь нейросекреты (релизинг-факторы), стимулирующие (либерины) или тормозящие (статины) выработку тропных гормонов гипофиза. Увеличение или уменьшение секреции тропных гормонов влияет на формирование опухолевой болезни. Так, избыточное образование гонадотропных гормонов сопровождается гиперэстрогенизацией организма. В свою очередь, избыточное количество эстрогенов — одна из основных причин возникновения так называемых дисгормональных опухолей. Самыми распространенными бластомами этого рода у животных и человека являются опухоли молочной железы, матки, предстательной железы. Эстрогены и андрогены стимулируют клеточную пролиферацию генов в канцерогенезе. Специфичность подобного влияния объясняют тем, что фолликулостимулирующий гормон (ФСГ) помимо активации синтеза половых гормонов непосредственно влияет на ткани органов-мишеней. Кроме того, избыток гонадотропных гормонов гипофиза приводит к дисфункции яичников, которые начинают вырабатывать гормоны с измененной структурой и функцией, способные активизировать пролиферативные процессы в клетках органов половой сферы. Роль коканцерогенов в развитии опухоли молочной железы играют и гормоны щитовидной железы. Найдено, что гипотиреоз способствует бластоматозной пролиферации, тогда как избыточное количество тиреоидных гормонов ее ингибирует. Таким образом, пролиферация, стимулируемая избыточным содержанием гормонов в крови, становится предрасполагающим фактором бластоматоза. При установлении влияния опухолевой болезни на организм нельзя не учитывать изменений гормонального профиля больного. Локализация опухолей в железах внутренней секреции усиливает или ингибирует их функциональную активность со всеми вытекающими последствиями. Локализация опухолей в гипофизе приводит к гипофизарной кахексии, другим соматическим расстройствам. Развитие опухоли в щитовидной железе может сопровождаться гипертиреозом с негативным влиянием на регуляторные системы организма. Поражение опухолевым процессом любой железы внутренней секреции приводит к ее дисфункции. Такие железы, в частности, способны синтезировать гетерогормоны — гормоны, не свойственные данному органу внутренней секреции. Островковый аппарат поджелудочной железы в условиях малигнизации способен к эктопическому синтезу до семи гормонов, не свойственных нормальному органу. Для опухолевой болезни характерны такие общие сдвиги в гормональном статусе, как повышение уровня адренокортикотропного и соматотропного гормонов в крови, глюкокортикоидов, катехоламинов, глюкагона; уменьшение содержания инсулина с явлениями диабета. Состояние иммунной системы и развитие опухоли. Экспериментаторами и клиницистами накоплен огромный материал о взаимосвязи и взаимозависимости бластоматозного превращения клеток и иммунной системы организма. Генетическое постоянство многоклеточного организма — главная функция иммунной системы. Функция иммунологического надзора обеспечивается согласованным взаимодействием различных элементов системы, их динамической реакцией на изменения контролируемых клеточных систем. Трансформация нормальных клеток в опухолевые, появление в последних онкобелков сопровождаются активной реакцией со стороны иммунной системы. В распознавании и возможном уничтожении трансформированных клеток участвуют различные типы иммунокомпетентных клеток и их медиаторы, вовлекающие в процесс элиминирования разнообразные механизмы. Уже на ранних этапах прогрессии бластоматозные клетки экспрессируют на своей мембране опухолеспецифичные антигены, меняются биофизические характеристики измененных клеток. Возникающие изменения индуцируют миграцию к антигенным опухолевым структурам макрофагов, естественных киллеров (NK), цитотоксических Т-клеток (Т-киллеров), других клеточных элементов (рис. 16). Эффективность натуральных киллеров особенно ярко выражена на ранних этапах развития опухолей, микрометастазов, на поздних их активность подавлена, что четко проявляется при экспериментальном канцерогенезе.
Рис. 16. Взаимодействие макрофагов с опухолевой (внизу) клеткой. СЭМх10000
Контроль за развитием опухоли осуществляют не только клеточные механизмы. Большое значение придают интерлейкинам — группе биологически активных веществ, синтезируемых активированными иммунокомпетентными клетками. Так, активированный макрофаг выделяет так называемый фактор некроза опухолей, способный к регрессии бластоматозных клеток. Интер-лейкин-2, выделяемый Т-лимфоцитами, стимулирует естественные киллеры, лимфоциты, инфильтрирующие опухолевую ткань. Макрофаги, опухолевые клетки, NK-клетки продуцируют интерферон, ингибирующий развитие онковирусов. Торможение онкогенеза обеспечивает синергизм действия альфа-интерферона, интерлейкина-2, фактора некроза опухолей. Стимуляция иммунной системы опухолевыми антигенами приводит не только к активации клеточного иммунитета, но и к дифференциации плазматических клеток из В-лимфоцитов. Плазмоциты начинают продуцировать специфические антитела, обладающие цитотоксичностью. Различают опухоли с высокой чувствительностью к антителам, с низкой чувствительностью к цитотоксическому действию антител и группу опухолей, вовсе не чувствительных к гуморальным антителам. К последней относят саркомы, карциномы, дисгормональные опухоли. По мере роста опухоли нарастает иммунодепрессия. Иммунная система противоопухолевой защиты становится все менее эффективной. Опухоль начинает интенсивно расти и развиваться. Причину иммунодепрессии видят в выработке опухолевыми клетками особых веществ — ненасыщенных жирных кислот, протеаз, эмбриональных антигенов. Стимулируется глюкокортикоидная функция надпочечников. Глюкокортикоиды угнетают активность лимфоидных, иммунокомпетентных органов. Большую роль в ослаблении иммунного ответа организма на развивающуюся опухоль отводят повышению активности Т- и В-супрессоров, которые оказываются более чувствительными к опухолевым антигенам, нежели хелперные клетки. Полагают, что вялотекущие, хронические воспалительные процессы, истощая резервные возможности организма, стимулируют опухолевый рост.
Дата добавления: 2015-03-04 | Просмотры: 973 | Нарушение авторских прав |