|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
РЕЗИСТЕНТНОСТЬ
Резистентность как интегративная функция животного организма определяется состоянием барьерных приспособлений для защиты от вредных агентов и механизмами неспецифической и специфической защиты. Барьерные свойства организма определяются тканевыми структурами, препятствующими негативному воздействию механических, физических, химических и биологических факторов, проникновению их во внутреннюю среду. К таким структурам относится кожа с ее производными, слизистые оболочки и кости. Кожа обладает барьерными свойствами благодаря многослойному эпителию и его производным (волосы, шерсть, перья, копыта, рога), наличию рецепторных образований, клеток макрофагальной системы, секрета, выделяемого железистым аппаратом. Неповрежденная кожа здоровых животных оказывает сопротивление механическим, физическим, химическим факторам. Она представляет собой непреодолимый барьер для проникновения большинства патогенных микробов, препятствует проникновению возбудителей болезни не только механически. Она обладает способностью к самоочищению путем постоянного слущивания ороговевающих кератиноцитов, выделения секретов потовыми и сальными железами. Кроме того, кожа обладает бактерицидными свойствами по отношению ко многим микроорганизмам. Ее поверхность представляет собой среду, неблагоприятную для развития вирусов, бактерий, грибов. Это объясняется кислой реакцией, создаваемой выделяемыми секретами. На поверхности кожи рН 4,6. Чем ниже показатель рН, тем выше бактерицидность, так как ионы водорода и гидроксильной группы, подавляя активность ферментов, начинают более интенсивно действовать на микроорганизмы. Бактерицидными свойствами обладают ненасыщенные жирные кислоты, молочная кислота, ферменты, лизоцим, комплемент, другие биологически активные вещества кожи. Большое значение придают аутомикрофлоре кожи. Видовой состав постоянной микрофлоры слагается из эпидермальных стафилококков (до 90 %), некоторых других бактерий и грибов. Постоянная аутомикрофлора способна выделять вещества, губительно действующие на антагонистов — патогенных возбудителей. По видовому составу микрофлоры можно судить о степени сопротивляемости организма, снижении его резистентности. Кожные покровы содержат клетки макрофагальной системы (клетки Лангерганса), способные к презентации микробных и иных антигенов Т-лимфоцитам, инициируя иммунный ответ. Недостаточность нормальной (постоянной) аутомикрофлоры приводит к ослаблению клеточных и гуморальных факторов защиты. Барьерные свойства кожи зависят от общего состояния организма, определяемого полноценностью кормления, уходом за покровными тканями, характером эксплуатации. Известно, что истощенные телята легче заражаются микроспорией и трихофитией. Недостаточный уход за кожей вымени коров может привести к маститу. Плохо подогнанная сбруя способствует развитию у лошадей механических повреждений. Слизистые оболочки ротовой полости, пищевода, желудочно-кишечного тракта, дыхательных и мочеполовых путей, покрытые эпителием, представляют собой барьер, препятствие для проникновения различных вредоносных агентов. Неповрежденная слизистая оболочка являет собой механическое препятствие для некоторых химических и инфекционных агентов. Благодаря наличию ресничек мерцательного эпителия с поверхности дыхательных путей выводятся во внешнюю среду инородные тела, микробы, в обилии попадающие с вдыхаемым воздухом. Раздражение рецепторов афферентных нервных путей инородными телами, химическими соединениями, продуктами жизнедеятельности микроорганизмов сопровождается двигательными защитными реакциями в виде кашля, рвоты, диареи, что способствует освобождению слизистых оболочек от возможного патогена. Повреждение слизистой оболочки рта предупреждается Усиленным слюноотделением, повреждение конъюнктивы — обильным отделением слёзной жидкости, повреждение слизистой оболочки носа — серозным экссудатом. Секреты желез слизистых оболочек обладают бактерицидными свойствами. В слюне, слёзной жидкости, секрете, отделяемом слизистой оболочкой дыхательных путей, находится лизоцим — фермент мурамидаза, способный к лизису стафило- и стрептококков, сальмонелл, туберкулезных и многих других микроорганизмов. Благодаря хлористоводородной кислоте желудочный сок подавляет размножение микрофлоры, но отдельные ее представители, как недавно установлено, заселяют клетки слизистой оболочки и желез желудка. К таким возбудителям относят Helicobacter pylori. Эти спиралевидные грамотрицательные бактерии обнаружены в слизистой оболочке желудка человека, кошек, собак, свиней, обезьян. Защитную роль играет микрофлора, заселяющая слизистую оболочку кишечника, мочеполовых органов здоровых животных. Микробы-синергисты принимают участие в утилизации клетчатки (инфузории преджелудков жвачных), синтезе белка, витаминов. Основным представителем нормальной микрофлоры в толстом кишечнике является кишечная палочка (Escherichia coli). Она ферментирует глюкозу, лактозу, создает неблагоприятные условия для развития гнилостной микрофлоры. Снижение общей резистентности животных, особенно молодняка, превращает кишечную палочку в возбудителя коли-инфекции. Для защиты слизистых покровов, разделяющих внешнюю и внутреннюю для организма среду, созданы иммунологические механизмы, осуществляющие функцию первой защиты против природных антигенных структур. Активно функционируют альвеолярные макрофаги, предупреждая проникновение чужеродных антигенов. Кроме фагоцитирующих клеток на поверхности слизистых оболочек сконцентрированы секреторные иммуноглобули-ны, основу которых представляет иммуноглобулин класса А. Его концентрация в слюне составляет 0,07 г/л, в кишечнике —0,75, в молозиве — 1,5 г/л, что значительно больше, чем содержание других иммуноглобулинов (IgM и IgG). Иммуноглобулины, защищающие респираторную, пищеварительную, мочеполовую системы, препятствуют адгезии вирусов и бактерий к клеткам слизистой оболочки, нейтрализуют токсины и вирусы, предохраняют от восприятия антигенных стимулов. Иммуноглобулины классов А и G активируют фагоцитоз клетками макрофагальной системы, а иммуноглобулины класса Е защищают организм от паразитов — простейших и гельминтов. Костная ткань выполняет многообразные функции. Одна из них — защита центральных нервных образований от механических повреждений. Позвонки предохраняют спинной мозг от травм, а кости черепа защищают головной мозг, подкорковые структуры. Ребра выполняют защитную функцию в отношении легких и сердца. Длинные трубчатые кости оберегают основной орган кроветворении я — красный костный мозг. Нарушения барьерной функции костной ткани в результате переломов, огнестрельных и иных ранений приводят к параличам, парезам, часто несовместимым с жизнью животных. При неспособности внешних барьеров противостоять патогенности чужеродного фактора он поступает во внутренние среды (кровь, лимфа, ликвор) организма. Мобилизуются неспецифические (общие) механизмы защиты и специфические, направленные на борьбу против конкретного патогена. Неспецифические факторы защиты. Неспецифические факторы защиты представляют собой компоненты эндогенного механизма, обеспечивающего генетически обусловленное постоянство внутренней среды. Это та первая линия обороны высокоразвитых организмов, которая предупреждает влияние патогенных факторов на их органы и системы. В нормальных условиях существования неспецифические факторы защиты препятствуют проникновению во внутреннюю среду чужеродных для него раздражителей, особенно биологического происхождения. С раннего постнатального периода организм животных заселяется симбионтной микрофлорой. Это обычные обитатели кишечника (кишечная палочка), кожи, слизистых оболочек. Устойчивое равновесие между макроорганизмом и микрофлорой во многом зависит от состояния неспецифических факторов защиты. Они формировались в процессе длительной эволюции. В борьбе с микромиром выживали животные с более совершенными механизмами противодействия повреждающим факторам, в том числе микробного происхождения. В определенных условиях нормальные обитатели или заведомо патогенные возбудители преодолевают защитные механизмы, внедряются во внутреннюю среду. Отвечая на такую агрессию, организм включает специфические механизмы защиты (Т- и В-системы) против конкретного патогенного раздражителя. Мобилизация специфического иммунного ответа на антиген и; последующая активация борьбы за сохранение и восстановление гомеостаза осуществляются всеми компонентами неспецифических факторов защиты, где основное значение имеет фагоцитарная система. Несмотря на очевидную условность представлений о специфических и неспецифических факторах защиты, в целях лучшего понимания целесообразно их отдельное рассмотрение. Фагоцитарная система. Центральное звено неспецифической защиты организма представлено двумя системами клеток — мононуклеарной фагоцитирующей системой (МФС) и системой полиморфноядерных лейкоцитов (ПМЯЛ). Основная структурная единица МФС —макрофаги. К этим клеткам относятся активированные циркулирующие в крови моноциты, гистиоци-ты соединительной ткани, купферовские клетки печени, легочные, плевральные и перитонеальные макрофаги. Все эти разновидности клеток МФС образуются из стволовой клетки красного костного мозга, проходя стадии монобласта, промоноцита, моноцита. Активированные моноциты отличаются от неактивированных морфологически, функционально и метаболически. Три группы веществ участвуют в активации этих клеток. К первой относят иммуноглобулины, иммунные комплексы, компоненты комплемента системы; ко второй — лимфокины, Продуцируемые активированными лимфоцитами; к третьей — микроорганизмы, эндо- и экзотоксины, синтетические полипептиды и др. Активированные макрофаги полифункциональны. Они участвуют в фагоцитозе, распознавании антигена и презентации его лимфоцитам, способствуют формированию очага воспаления, включаются в развитие трансплантационного и противоопухолевого иммунитета, вовлекаются в процессы регенерации и инволюции (рис. 5). Макрофаги осуществляют бактерицидную активность благодаря фагоцитозу, образованию фагодизосом и перевариванию лизосомальными ферментами. Кроме того, они способны секретировать большое количество биологически активных веществ, обладающих цитотоксическими свойствами в отношении микробов и опухолевых клеток.
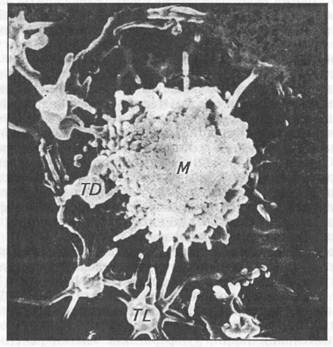
Рис. 5. Макрофаг (М), прикрепляющий к своей оболочке тромбоциты (TD, TL). СЭМ х 7000
Для взаимодействия с другими клетками, участвующими в защите организма, макрофаги выделяют сигнальные молекулы — цитокины. Важное значение в МФС принадлежит бронхоальвеолярным и легочным макрофагам. Главным источником их пополнения служат моноциты крови. Фагоцитирующие клетки бронхолегочного аппарата играют основную роль в механизме защиты легких от микроорганизмов и чужеродных частиц. Эти клетки имеют ряд особенностей. Их размеры больше перитонеальных, они содержат больше лизосом, многочисленные митохондрии, хотя более мелкие по размерам; высоки их ферментативная и дыхательная активность. Они в состоянии включать пигменты (гемосидерин) и частицы пыли, за что получили название «пылевые клетки». Подавление функции фагоцитирующих клеток бронхо-легочного аппарата сопровождается развитием аллергических заболеваний легких, поэтому все агенты, способные подавлять функции этих клеток (вирусы, некоторые лекарственные препараты, переохлаж-. дение), повышают чувствительность легких к неблагоприятным воздействиям среды. Система полиморфноядерных лейкоцитов. Полиморфноядерные лейкоциты (нейтрофилы, базофилы и эозинофилы) также участвуют в фагоцитозе. Им присущи хемотаксис, контакт с возбудителем, поглощение и переваривание. В отличие от моноцитов (макрофагов) нейтрофилы, другие полинуклеары функционируют сравнительно недолго (часы, дни) и, как правило, погибают в процессе фагоцитоза. Наиболее активно он осуществляется зрелыми гранулоцитами. Гранулоцитам присущи различные функции соответственно гистофизиологическим особенностям их.
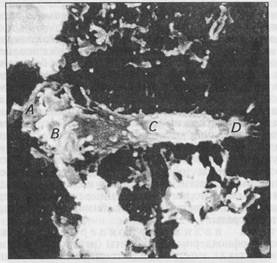
Рис. 6. Нейтрофил из крови лошади: А — мантия; В— микроворсинки; С—псевдоподия; Д—краевые окончания в виде «щетки» Борьбу с микробами и их ядами ведут в основном нейтрофилы (рис. 6). Зрелые, сегментоядерные нейтрофилы представляют собой сильные ферментообразователи. В их составе обнаружены лейкопротеаза, амилаза, трипсин, каталаза, щелочная фосфатаза, другие ферменты, обеспечивающие гидролиз фагоцитируемых объектов. Функция эозинофилов главным образом дезинтоксикационная. Они выделяют гистаминазу, разрушающую гистамин. Эозинофилию наблюдают при инвазионных (гельминтозы, протозоозы) и аллергических болезнях. Базофилы в своих гранулах содержат гистамин, гепарин, гиа-луроновую кислоту, медленно реагирующую субстанцию анафилаксин, калликреин. Дегрануляция (высвобождение содержимого из гранул) базофилов — энергозависимый процесс, происходящий двумя путями: иммунологическим — при действии антигенов и неиммунологическим, возникающим под влиянием биологически активных веществ — катехоламинов, простаглан-Динов и др. Базофилы обладают незначительной способностью к фагоцитозу, но активно перемещаются к очагу аллергического воспаления, инфильтрируют окружающие ткани, освобождают вазоактивные амины. Эти клетки крови — эффекторы развития аллергических реакций немедленного типа. Переваривающая сила клеток ПМЯЛ, как и МФС, напрямую связана с кислородзависимыми и кислороднезависимыми бактерицидными системами. Кислородзависимая система предполагает включение в процесс фагоцитоза пероксида водорода (Н2О2), миелопироксидазы (МПО), гидроксила (ОН), супероксидного радикала (О2) кислорода, синглетного радикала (↑O2). Антимикробную систему в нейтрофилах и макрофагах составляют МПО, Н 2О2 и окисляемый Ко-фактор (галоген). Из взаимозаменяемых галогенов (йод, бром, хлор) наибольшей активностью в антимикробной функции системы обладает йод, что обусловлено йодизацией микроорганизмов. Кроме того, системе свойственны антивирусная и антигрибная активность. Система МПО— Н2 О2 — хлорид также эффективна против бактерий, микоплазм и вирусов. Ее активность реализуется путем переокислительного де-заминирования и декарбоксилирования микроорганизмов. Кислороднезависимая система обеспечивает бактерицидную функцию в лизофагосомах в отсутствие кислорода. К компонентам этой системы относят лизоцим, катионные белки, дегидрогеназы, другие активные соединения. Окончательная дезинтеграция объекта фагоцитоза реализуется лизосомальными гидролазами. Полное переваривание фагоцитированных генетически чужеродных для организма веществ не сопровождается иммунным ответом. Для его инициации необходимо появление на мембране макрофага антигенных структур, поступивших из цитоплазмы. Эти «профильтрованные» антигены легко взаимодействуют с Т-лимфоцитами, обеспечивая начальный этап иммунной, специфической реакции. Система комплемента. Комплементом называют полифункциональную ферментную систему, участвующую в ключевых гомеостатических реакциях, таких, как опсонизация, стимуляция фагоцитоза, цитолиз, нейтрализация вирусов, медиация воспаления, индукция иммунного ответа. Эта система включает в себя 9 компонентов (С1— С9) классического пути активации и 3 компонента альтернативного пути. Классический путь последовательной активации компонентов комплемента опосредуется IgG и приводит к образованию иммунных комплексов антиген—антитело. Комплемент участвует в процессе цитолиза путем последовательного внедрения терминальных протеинов С5b —С9 в бислой липидов клеточной мембраны. Под их влиянием образуются трансмембранные каналы, через которые начинается движение ионов в противоположных направлениях (К+, Na+ Ca2+) и воды внутрь клетки. Осмотический шок завершается киллингом чужеродного микроорганизма. Фрагменты комплемента С3а и С5а способны индуцировать выделение базофилами и тучными клетками гистамина. Пептид С3а стимулирует секрецию серотонина, а С5а опсонирует полиморфноядерные клетки и макрофаги. Компонент С3 участвует во взаимодействии макрофагов, Т- и В-клеток. Фрагмент комплемента С5 осуществляет на поверхности лимфоцитов «сборку» комплементарного мембранолитического комплекса. Система комплемента участвует в диссоциации и элиминации иммунных комплексов. Система интерферонов. Интерфероны представляют собой низкомолекулярные пептиды с небольшим количеством аминокислот и углеводов. Это неспецифический фактор противовирусной защиты, синтезируемый лейкоцитами, макрофагами, Т-лимфоцитами, лимфобластами. Образование интерферонов кодируется геномом клетки и индуцируется вирусами, в меньшей степени — бактериями, грибами, паразитами, микоплазмами, риккетсиями, полисахаридами и липополисахаридами бактериального происхождения, синтетическими полимерами. Интерфероны видоспецифичны, обнаруживаются в повышенных количествах в сыворотке крови, моче, местах размножения при большинстве вирусных инфекций. В механизме действия важное значение принадлежит функциональным изменениям в рибосомах, которые становятся неспособными к вирусной репликации. Выделены и изучены два типа интерферонов. К первому типу относятся альфа- и бета-интерфероны, ко второму — гамма-интерферон. Интерфероны первого типа характеризуются противовирусным и антипролиферативным действиями. Бета-интерферон подавляет развитие внутриклеточных микобактерий, возбудителей токсоплазмоза, некоторых других заболеваний, а также пролиферацию опухолевых клеток. Гамма-интерферон наряду с противовирусной активностью участвует в регуляции иммунного ответа, усиливает антителогенез, цитотоксическое влияние макрофагов и естественных киллеров как в отношении бактерий, так и опухолевых клеток. Система лизоцима. Лизоцим представляет собой фермент из группы гликозидаз. Он секретируется постоянно, выявляется во всех органах и тканях. Бактерицидная активность проявляется в катализе разрыва бета-глюкозидной связи мураминовой кислоты (отсюда второе название — мурамидаза) и ацетилглюкозамина полиаминосахаридов бактериальной стенки. Поскольку у грамположительных бактерий стенка представлена одним слоем мукополисахарида, то лизоцим по отношению к ним проявляет самостоятельную бактерицидную активность. В отношении грамотрицательных бактерий он действует совместно с комплементом цитолитически, проникая через поврежденную им клеточную стенку бактерий к объектам гидролиза. Система пропердина. Пропердин (от лат. perdere — разрушать) — белок сыворотки крови глобулинового типа, обладающий бактерицидными свойствами. С его помощью был обнаружен альтернативный механизм активации комплемента. Он состоит из четырех идентичных субъединиц, соединенных друг с другом нековалентными связями, и углеводов (9,8 %). Этот гликопротеид с молекулярной массой 220 кДа существует в двух формах: нативной и активированной. Нативный пропердин может связываться с образовавшей комплекс С3/С5-конвертазой альтернативного механизма активации комплемента. Его роль заключается в уменьшении скорости распада конвертазы, чем усиливается активация по альтернативному пути. Пропердин активен в комплексе с другими факторами, содержащимися в крови. Система пропердина состоит из пропердина (гамма-глобулин), компонентов комплемента (C1, С2, С3, С4 ) и ионов магния. Система пропердина проявляет бактерицидность по отношению ко многим патогенным и условно-патогенным микроорганизмам. Под ее влиянием инактивируются вирусы гриппа, герпеса, грамотрицательные бактерии. Уровень пропердина в крови животных отражает состояние их резистентности, чувствительность к инфекционным заболеваниям. Выявлено снижение его содержания у облученных животных, больных туберкулезом, при стрептококковой инфекции. Неспецифические механизмы защиты предупреждают болезнетворное действие попавшего во внутреннюю среду чужеродного фактора, стремятся к элиминации патогенного субстрата без существенных изменений в состоянии организма. Через систему макрофагов они включают Т- и В-системы иммунитета, обеспечивающие развитие антигенспецифических реакций.
Дата добавления: 2015-03-04 | Просмотры: 1106 | Нарушение авторских прав |