|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Изменение баланса жидкости при операциях на аортеПри реконструктивных операциях на аорте происходят изменения объема жидкости вследствие местной травмы тканей в операционной ране, ге- модинамических нарушении при пережатии аорты и затем в момент пуска кровотока, а также вследствие кровопотери. Происходит движение воды и растворов из внутрисосудистого, межклеточного пространства в интерсти-циальное пространство на уровне прекапилляров и выравнивание увеличенного гидростатического давления. Переход жидкости во внутрисо-судистое пространство в дистальных капиллярах происходит под действием альбумина, который действует на онкотический градиент давления. Около 7 % внутрисосудистого альбумина пересекает капиллярную мембрану и переходит в интерстициаль-ное пространство. Этот внесосудис-тый белок входит в лимфу и в конечном счете возвращается во внутрисо-судистое русло. При повреждении тканей во время операций на аорте разрушаются лимфатические сосуды, что в присутствии медиаторов воспаления, вызывающих местные и системные изменения в тканях, приводит к повышению проницаемости капиллярных мембран к альбумину. Значительное количество альбумина выходит в ин-терстициальное пространство, что приводит к уменьшению реабсорб-ции воды во внутрисосудистое пространство. Действительно, обычно в раннем послеоперационном периоде обнаруживается послеоперационная гипоальбуминемия. Это главным образом вызвано перераспределением альбумина, а не метаболическими нарушениями. В результате уменьшения внутрисосудистого объема и активации нейроэндокринных механизмов уменьшается почечная экскреция натрия и воды. Кроме того, происходит перемещение натрия и воды во внутриклеточное пространство из внеклеточного депо. Этот процесс наблюдается при снижении клеточного трансмембранного потенциала после реперфузии зоны ишемии или геморрагического шока. Причина мембранных нарушений неясна, однако в них участвуют нарушения функции Na, К-АТФазного насоса и потеря ионного транспорта. Поддержание нормального гомеостаза при уменьшении циркулирующего внутрисосудистого объема состоит в том, чтобы мобилизовать внеклеточную интерстициальную жидкость. Избыток внесосудистой жидкости мог бы быть возвращен при ее большем онкотическом давлении и функциональным запасом жидкости для восстановления уменьшенного внутрисосудистого объема. Если принять во внимание сдвиг кислотно-основного равновесия в ишемизированных тканях во время операции, воздействие невосполненной кровопотери, снижение сердечного выброса при пережатии аорты и активацию стрессовых нейроэндокринных механизмов, то станет очевидным порочный круг реакций, которые приводят к переходу жидкости из циркулирующей крови в межклеточное пространство. На снижение циркулирующего объема жидкости реагируют барорецеп-торы, и для восполнения дефицита объема нейроэндокринные регуляторы задерживают экскрецию воды. Определение внутрисосудистого объема и его связанных растворов после большой операции имеет огромное значение. При реконструктивной операции на аорте в интра-операционном и в раннем послеоперационном периоде увеличивается потеря внутрисосудистого объема. Поэтому важным в послеоперационном периоде является ежечасный контроль в парентеральной потребности жидкости, которая может изменяться в течение времени от 100 до 500 мл/ч. Увеличенная потребность в жидкости продолжается в непосредственном послеоперационном периоде вследствие длительной ее потери в зоне оперативного вмешательства. Мобилизация изолированной внеклеточной жидкости происходит в течение 2—5 дней в зависимости от величины операционного и послеоперационного стресса, сердечного выброса Таблица 6.8. Этиологические факторы, играющие роль в развитии ОПН
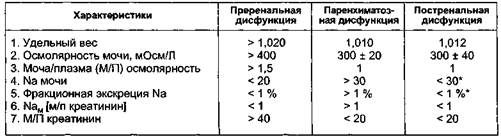
и внутрисосудистого онкотического давления. Реабсорбция межклеточной жидкости обычно начинается на второй или третий послеоперационный день. Управление объемом жидкостей, вводимым парентеральным путем, или назначения диуретической терапии позволяют предупредить перепоглощение интерстици-альной жидкости, что может привести к внутрисосудистой перегрузке и острой остановке сердца. Почечная дисфункция. Нарушения функции почек при операциях на аорте могут быть различными от умеренного натрийуреза до острой почечной недостаточности (ОПН), требующей гемодиализа. Несмотря на некоторое снижение частоты развития ОПН в последние годы, что связано с адекватной предоперационной подготовкой больного, улучшением техники операции и снижением нефротоксичности контрастных веществ, риск развития ОПН остается высоким и играет существенную роль в послеоперационной смерт- ности больных от 10 до 80 %. Летальность обусловлена этим тяжелым осложнением. Этиологические факторы, играющие основную роль в развитии ОПН, можно подразделить на пререналь-ные, ренальные и постренальные (табл. 6.8). Диагностика. Учет возможных причин послеоперационной почечной недостаточности необходим для дифференциальной диагностики и лечения данного осложнения. Общая оценка должна включать полное обследование пациента. Данные о снижении внутрисосудистого объема, нестабильная гемодинамика, сепсис или застойная сердечная недостаточность указывают на возможную почечную недостаточность различного генеза. Интерпретация анализов крови и мочи также существенно помогает в диагностике причин почечной недостаточности (табл. 6.9). Преренальная дисфункция. Прере-нальные факторы наиболее часто яв-
Таблица 6.9. Анализы крови и мочи в диагностике причин почечной недостаточности ляются причиной острой почечной недостаточности в раннеем послеоперационном периоде. Пререналь-ная почечная недостаточность возникает вследствие сокращения внутри-сосудистого объема при неадекватной коррекции потери жидкости в интра-операционном и послеоперационном периоде. Реже острая почечная недостаточность наблюдается при снижении сердечного выброса, что вызывает нейрогормональные изменения для восполнения внутрисосу-дистого объема, увеличивая реабсор-бцию натрия и воды. Поскольку у больных атеросклерозом, подвергающихся большой сосудистой операции, часто имеются поражения коронарных артерий и снижение функции левого желудочка, гиповолемичес-кую и кардиогенную причины прере-нальной дисфункции различить трудно. В чистом виде каждая из этих двух причин снижения почечной функции имеет отчетливые признаки. При гиповолемии наблюдаются спадение вен шеи, сухость слизистых оболочек и снижение давления заклинивания в легочной артерии, напротив, при второй причине почечной недостаточности отмечается снижение сердечного выброса, набухание вен шеи, повышение объема внутрисосудис-той жидкости и повышение давления заклинивания в легочной артерии. Терапия гиповолемической прере-нальной азотемии должна быть направлена на увеличение внутрисосу-дистого объема и заключается в сбалансированном введении солевых растворов и при необходимости эрит-роцитной массы. Наоборот, терапия при почечной дисфункции кардио-генного происхождения направлена на улучшение деятельности миокарда путем снижения постнагрузки и назначения инотропных средств и диуретической терапии для уменьшения преднагрузки и улучшения работы левого желудочка. Если, несмотря на проводимую адекватную терапию, отсутствует положительная динамика, а другие причины развития почечной недостаточности были исключены, то можно заподозрить наличие у больного окклюзирующе-го поражения почечных артерий и ишемической нефропатии. При дуплексном сканировании почечных артерий в таких случаях выявляются гемодинамически значимые стенозы или окклюзии почечных артерий, что характеризуется фокальным увеличением пиковой систолической скорости с дистальной турбулентностью допплеровских волн или отсутствием допплеровского потока. Напротив, интенсивное внутритканевое набухание при паренхиматозных причинах острого тубулярного некроза сопровождается увеличением почечного паренхиматозного сопротивления и характеризуется снижением диастолической скорости на спектрограмме почечной артерии. При отсутствии острых или хронических почечных паренхиматозных нарушений диастолическая скорость увеличивается. При обнаружении по данным дуплексного сканирования поражений почечных артерий целесообразна коррекция имеющегося препятствия кровотоку путем дилатации почечной артерии или открытой операции. Ренальная (паренхиматозная) дисфункция. Наибольший риск нарушений выделительной функции почек возникает при паренхиматозных причинах острой почечной недостаточности. Следует различать почечную недостаточность вследствие ишеми-ческих (шок, острая окклюзия почечной артерии, полиорганная недостаточность и атероэмболические осложнения) и токсических повреждений (миоглобинурия, рентгеноконт-растные вещества). Острый тубуляр-ный некроз (ОТН) возникает при всех паренхиматозных причинах ОПН. Патофизиологический механизм ОТН связан с уменьшением в клетках АТФ вследствие потери актина цитоплаз-матическими структурами. Потеря актина приводит к поляризации клеточной мембраны с последующей потерей внутриклеточных непроницаемых соединений. Разрушение трубчатых ячеек в канальцах приводит к канальцевой обструкции и прекращению гломерулярной фильтрации в нефроне. Развитие ОПН клинически проявляется резким повышением уровня креатинина сыворотки крови и олигурией. Иногда в мочевом осадке возможно присутствие канальце-вых клеток. Острое ишемическое повреждение в результате временного прерывания перфузии почек или системной ги-поперфузии, связанной с сосудистой реконструкцией, имеет двойной патофизиологический механизм. Вначале при значительной и продолжительной ишемии вследствие реперфу-зии происходит набухание трубчатых клеток. Это приводит к обструкции канальцев со снижением или прекращением гломерулярной фильтрации в нефроне. В то же время ка-нальцевые клетки могут потерять связь с базальной мембраной из-за интерстициального отека, возникающего после реперфузии или погибнуть в результате ишемии, слущива-ясь в просвет канальцев. После потери канальцевых клеток возникает реабсорбция гломерулярного фильтрата в почечную паренхиму. Операции на аорте сопровождаются наибольшим риском развития почечной дисфункции в послеоперационном периоде. Реконструкция аорты, требующая наложения зажима над почечными артериями, сопровождается большим риском развития ише-мического инсульта почек. Этот риск еще больше при торакоабдоминаль-ной аневризме, когда ожидается продолжительная почечная ишемия. У больных с реконструкцией торако-абдоминальной аневризмы ОПН наблюдается в 18 % случаев. Полное восстановление функции почек после супраренального пережатия аорты зависит от наличия исходной почечной недостаточности, возраста пациента и продолжительности ишемии почек. Периоды гипотензии, связанной с потерей крови или дисфункцией миокарда, также могут уменьшать почечный кровоток и приводить к развитию почечной недостаточнос- ти. Частота возникновения почечной недостаточности после резекции ин-фраренальной аневризмы аорты колеблется от 1 до 13 %. Острая окклюзия почечной артерии может быть следствием эмболи-зации кардиального генеза, травмы, диссекции аорты или почечной артерии. Когда окклюзия связана с кардиоэмболическим осложнением, диагностика нередко затруднительна. В этих случаях окончательное восстановление почечной функции зависит как от величины окклюзии, так и от возможности коллатерального кровотока в почках. Боли в спине, пояснице или животе, повышение артериального давления, гематурия и повышение уровня лактатдегидро-геназы (ЛДГ) способствуют установлению правильного диагноза и лечения. Травматическая окклюзия почечной артерии может быть заподозрена при гематурии и отсутствии контрастирования почки при внутривенной пиелограмме. Для подтверждения диагноза необходима срочная ангиография. Успех реваскуляризации почки в значительной степени зависит от длительности острой ишемии. Диссекция почечной артерии может быть вызвана повреждением при удалении катетера или являться результатом существующего заболевания (фиброзно-мышечная дисплазия). Возможность восстановления функции почек и исходы лечения зависят от степени повреждения артерии и в случаях полной ее окклюзии — от продолжительности ишемии перед хирургической реваскуляризацией. Сосудистые операции, осложненные сепсисом, нарушением функции миокарда или нарушением перфузии, также могут приводить к транзитор-ным или постоянным нарушениям функции почек. В этих случаях восстановление выделительной функции почек зависит от устранения очага инфекции и восстановления адекватной работы левого желудочка. Атероэмболия в почечные артерии является наиболее частой причиной острой почечной недостаточности. Коронарография и баллонная ангиопластика коронарных артерий — известные источники атероэмболии почечных артерий. Атероматозная эмболия из проксимально расположенных пораженных артериальных сегментов может возникнуть при пережатии аорты над почечными артериями или манипуляциях на аорте. Это также может происходить спонтанно. Правильный диагноз можно заподозрить при наличии нарушения почечной функции у больного, имеющего другие экстраренальные проявления атероэмболии. Ишемическая нефропатия. Традиционно термин "ишемическая нефропатия" используется для характеристики снижения выделительной функции почек при вазоренальной гипертензии. Признаком одно- или двусторонней ишемии почек вследствие поражения почечных артерий является повышение креатинина сыворотки крови с уменьшением перфузии почечной артерии. Ишемическая нефропатия имеет тенденцию к быстрому прогрессированию и более чем в 20 % случаев приводит к почечной недостаточности, требующей гемодиализа. В отличие от вазоренальной гипертензии при одностороннем стенозе почечной артерии, имеющей ренинзависимую природу, гипертен-зия при ишемической нефропатии является объемзависимой. Следовательно, у больных с этой формой заболевания, протекающего с высокой гипертензией, повышается уровень креатинина сыворотки и наблюдается объемная перегрузка. Альтернативно клиника может быть представлена преходящими эпизодами вспышек отека легких. Для диагностики стеноза почечной артерии больному показано дуплексное сканирование и при подтверждении диагноза — ди-латация почечной артерии. Постренальная дисфункция. Пост-ренальные факторы являются редкой причиной почечной дисфункции, ведущей к послеоперационной оли-гурии. Препятствие для отхождения мочи обычно локализуется в уретре или мочевом катетере и реже в мочеточниках. Гематурия или травматичная постановка катетера могут предрасполагать к образованию сгустков крови, нарушающих проходимость мочевыводящих путей, и указывают на развитие обструктивной уропа-тии. При прекращении поступления мочи начальные действия должны быть направлены на ирригацию катетера и его замену, после чего обычно восстанавливается отток мочи. Постренальная олигурия может быть вызвана мочеточниковой обструкцией, ятрогенным повреждением или компрессией мочеточников сосудистым трансплантатом, а также мочекаменной болезнью. Предварительный диагноз может быть поставлен на основании УЗИ почек или изотопной нефрографии и может быть подтвержден ретроградной урографией. Острая задержка мочи, ведущая к обструктивной уропатии, в редких случаях может наблюдаться при удалении мочевого катетера у больных с эпидуральными катетерами и с задержкой мочи у больных с гипертрофией предстательной железы. Чтобы избегать задержки мочи, удаление мочевого катетера следует производить не раньше 6—12 ч после прекращения действия эпидуральной ана-лгезии. Простатит или травма при постановке мочевого катетера в комбинации с общей анестезией также могут привести к острой задержке мочи. Эти причины при раннем выявлении являются легко устранимыми перестановкой катетера, и они редко приводят к обструктивной уропатии. Таким образом, ОПН остается одной из основных причин летальности после операций на аорте. Частота ее в настоящее время колеблется от 1 до 13 %. Риск развития ОПН зависит от клинических обстоятельств, уровня аортальной реконструкции, наличия дооперационного нарушения почечной функции, интраоперационных и послеоперационных осложнений. Послеоперационные нарушения функции почек как причина смерти больных колеблется от 25 % при неоли-гурической почечной недостаточности до 70 % при олигурической форме почечной недостаточности. ОПН чаще всего является результатом комбинированного воздействия нескольких причин, каждая из которых может привести к этому тяжелому послеоперационному осложнению. Продолжительная ишемия почек при пережатии аорты выше почечных артерий, временная окклюзия почечной артерии, эпизоды гипово-лемического шока, гипотензия после наложения зажима или кардиоген-ного шока во время операции являются наиболее частыми причинами острой почечной недостаточности. Почечная атероэмболия как причина развития ОПН встречается значительно реже и зависит от эмбологен-ного потенциала атероматозной бляшки и интраоперационных методов предотвращения эмболии. Защита почечной функции. Меры профилактики нарушения почечной функции во время операции на аорте включают ограничение периода тепловой ишемии почки; обеспечение адекватного объема циркулирующей крови перед операцией, внутривенной гидратацией и адекватным возмещением объема циркулирующей крови в течение и немедленно после операции; исключение повторной или длительной ишемии почек и поддержание максимальных параметров работы сердца. Использование маннитола, фуросемида и других мочегонных средств, почечной гипотермии, почечных вазодилататоров является дополнительным методом. Все эти методики направлены на уменьшение почечной ишемии, снижение метаболических потребностей паренхимы в течение периода ишемии. Использование этих профилактических мер позволяет уменьшить тяжесть и продолжительность почеч- ной недостаточности при операциях на аорте. Для нормально перфузируемой почки толерантность к тепловой ишемии составляет меньше 40 мин. Для хронически ишемизированной почки продолжительность времени безопасной тепловой ишемии зависит от развития коллатерального кровоснабжения. Дооперационная оценка и интраоперационная подготовка могут снизить время ишемии почек и уменьшить риск интраоперационных осложнений. Глубокие и продолжительные нарушения почечной гемодинамики наблюдаются у больных со сниженной почечной функцией и при длительном пережатии аорты. ОПН, развившаяся после операции на аорте, требует активной терапии, направленной на коррекцию дефицита внеклеточного объема. Региональная почечная гипотермия позволяет защитить почечную функцию в течение периода ишемии, что обусловлено уменьшением метаболической потребности. Обычно используют инфузию от 500 до 1000 мл охлажденных до 4—5 °С растворов кристаллоидов с или без дополнительных добавок, вводимых в изолированный интраренальный сегмент аорты или непосредственно в почечную артерию, через ручную канюлю или баллонные катетеры. В плане предотвращения микро-эмболизации атероматозными массами следует избегать повторного пережатия аорты, поскольку это увеличивает риск атероэмболии в почечные артерии из проксимально расположенных атероматозных бляшек. Для ее профилактики целесообразно временное пережатие почечных артерий перед наложением аортального зажима в тех случаях, когда на аорто-грамме визуализируется наличие осложненных околопочечных атеро-склеротических изменений. Этот прием используется как при супра-, так и при инфраренальном пережатии аорты. Дата добавления: 2015-02-06 | Просмотры: 1075 | Нарушение авторских прав |