|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
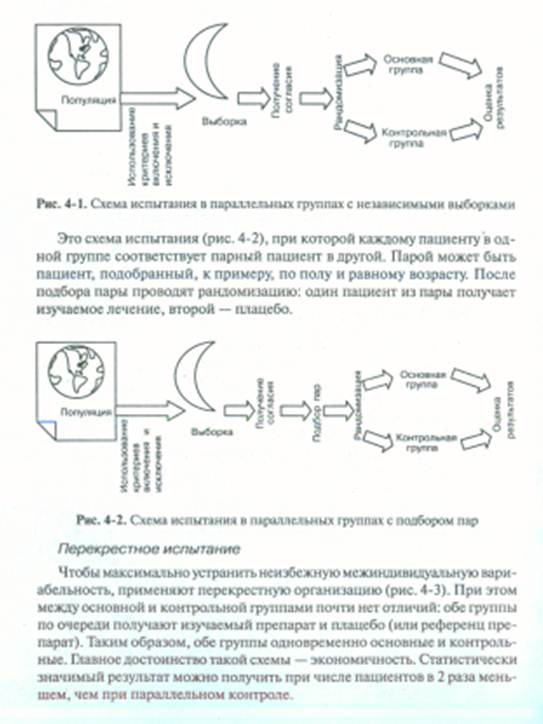
Особенности организации и проведения экспериментальных исследованийНеконтролируемый эксперимент Неконтролируемый эксперимент в виде наблюдения за результатами вмешательства — самый простой вид эксперимента. Он дает достаточные основания для оценки вмешательства только если размер эффекта огромен. Так, хинин при малярии и нитроглицерин при стенокардии демонстрируют замечательный эффект, не требующий дальнейшей проверки. За редкими исключениями медицинские вмешательства незначительно влияют на исход болезни. Поэтому эффект легко не заметить, если проводить неконтролируемый эксперимент и так же легко обнаружить эффект там, где его нет. Испытание в параллельных группах Простейший случай КИ — сравнение результатов вмешательства в двух группах, контрольной и основной. Пациенты основной группы получают исследуемый препарат, а контрольной — плацебо (рис. 4-1). Такую методику обозначают как проспективное исследование с вмешательством и с параллельным контролем. Перекрестное испытание Чтобы максимально устранить неизбежную межиндивидуальную вариабельность, применяют перекрестную организацию (рис. 4-3). При этом между основной и контрольной группами почти нет отличий: обе группы по очереди получают изучаемый препарат и плацебо (или референц препарат). Таким образом, обе группы одновременно основные и контрольные. Главное достоинство такой схемы — экономичность. Статистически значимый результат можно получить при числе пациентов в 2 раза меньшем, чем при параллельном контроле.
Факторная структура эксперимента В случае факторной структуры эксперимента можно сравнить более двух вмешательств на одной группе пациентов (табл. 4-1), Для этого сначала рандомизируют пациентов для препарата 1 и плацебо, а затем — для препарата 2 и плацебо. Как результат: • пациенты, получающие препарат А и В; • пациенты, получающие препарат В и плацебо; • пациенты, получающие препарат Аи плацебо; • пациенты, получающие только плацебо. Такая структура эксперимента экономически выгодна по сравнению с проведением двух самостоятельных испытаний. Таблица 4-1. Пример факторной структуры эксперимента
Трудности назначения препарата Независимо от характера вмешательства (лечебное, диагностическое, профилактическое) оно должно быть ясно описано и стандартизировано. При назначении некоторых вмешательств подбор дозы не вызывает трудностей: парентеральное введение препарата по схеме обеспечивает поступление в организм известного количества активного вещества. Применение пероральных форм препаратов уже приводит к трудностям в дозировке. В зависимости от комплайенса пациенты могут не принять суточную дозу, а в случае выраженных побочных эффектов — и вовсе ее уменьшить. Есть вмешательства, дозировать которые трудно. К ним относят оперативные вмешательства, мануальную терапию, иглорефлексотерапию. В ходе КИ обычно прекращают лечение, ранее назначенное пациенту. Срок после прекращения прошлого лечения и до начала КИ устанавливают таким образом, чтобы упала концентрация активного вещества. Если пациенты основной группы принимают дополнительные препараты (коинтервенция), то может возникнуть смещение результатов в сторону более высокой эффективности. Если пациенты контрольной группы используют те же препараты, что и в основной группе (контаминация, загрязнение), то результат может быть сдвинут в сторону неэффективности препарата. В испытании принимают меры по предотвращению контаминации и коинтервенции и по повышению комплайенса пациентов и персонала в выполнении предписанных протоколом действий. Один из способов — проведение вводного этапа до испытания. На этом этапе не соблюдающих режим пациентов выявляют, например, путем определения в моче веществ, введенных в препарат в качестве метки. Затем в испытание включают только исполнительных пациентов. Коинтервенция и контаминация почти неизбежны, их необходимо учитывать при анализе данных. Исходы («целевые» признаки) — события, по которым будут оценивать эффективность лечения или других вмешательств. Виды исходов: • клинически важные исходы (летальность, продолжительность жизни, частота обострений, сохранение работоспособности); • промежуточные; • косвенные; • суррогатные исходы. Качество жизни При оценке эффективности вмешательства не следует забывать об оценке качества жизни. Иногда небольшого увеличения продолжительности жизни можно достичь неприемлемыми страданиями в процессе лечения, например, в онкологии. Для оценки качества жизни применяют сложные шкалы, итоговую оценку на которых получают в результате суммирования разнообразных сведений (об интенсивности боли, настроении, состоянии дыхания, способности мыться самостоятельно, обслуживать себя). Прекращение испытания Длительность КИ планируют исходя из количества участников, ожидаемой частоты исходов и различия между вмешательствами (размера эффекта), из планируемой статистической значимости результата. Проводить испытания до того момента, когда его результат станет статистически значимым, неправильно, поскольку рано или поздно можно достичь статистически значимые различия. Именно поэтому длительность КИ устанавливают заранее. В длительных испытаниях правила прекращения КИ устанавливают в связи с необходимостью обеспечения безопасности участников и с возможным получением убедительных результатов в пользу одного из изучаемых вмешательств. Испытания с анализом данных в зависимости от назначенного или полученного лечения
Результаты контролируемых рандомизированных испытаний можно анализировать и представлять двумя способами: либо на основании факта назначения того или иного лечения при рандомизации, либо на основании лечения, полученного пациентом фактически. Правильное представление результатов зависит от постановки вопроса. • Если вопрос втом, какая тактика лечения более предпочтительна для принятия клинического решения, то следует применять анализ, исходящий из лечения, назначенного при рандомизации, независимо от того, все ли пациенты на самом деле получали это лечение. Этот подход называют анализом в зависимости от назначенного лечения. Достоинства такого подхода: поставленный вопрос соответствует тому, который обычно интересует клинициста при назначении лечения, а сравниваемые пациенты действительно распределены по группам случайным образом. Недостаток: если многие пациенты не получали предписанного лечения, то различия между экспериментальной и контрольной группами исчезают, вероятность отрицательного результата исследования растет. В таком случае отсутствие различия между группами может быть трактовано по-разному: то ли экспериментальное вмешательство на самом деле неэффективно, то ли оно просто не было применено. • Если нас интересует, действительно ли экспериментальное лечение лучше контрольного. В этом случае для ответа больше подходит анализ, исходящий из полученного лечения, т. е. оценка эффекта того лечения, которое каждый больной получал в действительности и вне зависимости от того, какое лечение ему было назначено при рандомизации. При этом выясняют механизм изучаемого эффекта. Недостаток этого подхода: если большинство пациентов не получали предписанного лечения, испытание перестает быть рандомизированным и становится обычным когортным исследованием. Это значит, что все различия между группами, исключая способ лечения, должны быть каким-то образом нивелированы (путем введения ограничений, подбора пар, разделения на подгруппы или стандартизации) для достижения полной сопоставимости, как это происходит при неэкспериментальных исследованиях, Статистическая оценка результатов испытания Таблица 4-2. Таблица для расчета показателей эффективности
Таблица 4-3. Таблица для расчета показателей оценки побочных эффектов вмешательства
Статистические показатели для расчета побочных эффектов вмешательства
Организации, отвечающие за проверку результатов клинических испытаний В большинстве стран мира открыты специальные отделы, относящиеся к министерству здравоохранения или другим департаментам, отвечающие за проверку результатов КИ, проводимых по новым препаратам, и за выдачу разрешений на поступление медицинского продукта (препарата, аппарата) в сеть аптек. Например, в Соединенных Штатах, это —FDA. Это учреждение действует в соответствии со статьей 21 кодекса федеральных законов. В России в составе Минздрава РФ есть отдел, действующий на основании приказа № 266 «Об утверждении Правил клинической практики в РФ» от 19 июля 2003г. Международные требования Основа проведения КИ — документ международной организации «Международной Конференции по Гармонизации» (IСН). Этот документ называют G СР («Описание стандарта ССР», GСР часто переводят как «Надлежащая (качественная) клиническая практика»). Кроме врачей, в области КИ работают и другие специалисты по КИ. КИ необходимо проводить в соответствии с основополагающими этическими принципами Хельсинкской Декларации, стандарта ССР и действующими нормативными требованиями. До начала КИ необходимо оценивать соотношения предвидимого риска с ожидаемой пользой для испытуемого и общества. Во главе угла — принцип приоритета прав, безопасности и здоровья испытуемого над интересами науки и общества. Испытуемый может быть включен в исследование только на основании добровольного информированного согласия, полученного после детального ознакомления с материалами исследования. Это согласие заверяют подписью пациента (волонтера). КИ должно быть научно обосновано, подробной ясно описано в протоколе исследования. Оценка соотношения рисков и пользы, а также рассмотрение и одобрение протокола исследования и другой документации, связанной с проведением КИ, входят в обязанности Экспертного совета организации/Независимого этического комитета (ЭСО/НЭК). После получения одобрения от ЭСО/НЭК можно приступать к проведению КИ. Разработка ЛС и их КИ — процедуры оченьдорогие. Некоторые фирмы, стремясь снизить стоимость испытаний, проводят их вначале в странах, где требования и стоимость значительно ниже, чем в стране фирмы-разработчика. Так, многие вакцины первоначально были испытаны в Индии, Китае и других странах третьего мира. В качестве 2—3 этапа КИ использовали и благотворительные поставки вакцин в страны Африки и Юго-Восточной Азии. Принципы качественных клинических испытаний В РФ Приказом Федерального агентства по техническому регулированию и метрологии от 27 сентября 2005 г. № 232-ст утвержден Национальный стандарт РФ (см. Приложение 1). Настоящий стандарт идентичен Руководству по надлежащей клинической практике. Международной конференции по гармонизации технических требований к регистрации фармацевтических продуктов, предназначенных для применения человеком. Он подготовлен Ассоциацией международных фармацевтических производителей, Международной конфедерацией обществ потребителей (КонфОП), РАМН. Надлежащая клиническая практика: международный этический и научный стандарт планирования и проведения исследований с участием человека в качестве субъекта, а также документального оформления и представления результатов таких исследований. Соблюдение указанного стандарта служит для общества гарантией того, что права, безопасность и благополучие субъектов исследования защищены, согласованы с принципами, заложенными Хельсинкской декларацией (см. Приложение 2) Всемирной медицинской ассоциации, и что данные КИ достоверны. Цель настоящего национального стандарта — установление единых со странами Европейского Союза, США и Японией правил, способствующих взаимному признанию данных КИ уполномоченными органами названных стран. Принципы качественных КИ (GСР). • КИ необходимо проводить в соответствии с основополагающими этическими принципами Хельсинской декларации, Правилами GСР и действующими нормативными требованиями. • До начала КИ должна быть проведена оценка соотношения предвидимого риска с ожидаемой пользой для испытуемого и общества. КИ может быть начато и продолжено только в случае преобладания ожидаемой пользы над риском. • Права, безопасность и здоровье испытуемого важнее интересов науки и общества. • Обоснованием планируемого КИ должны служить данные доклинического и клинического изучения исследуемого препарата. • КИ должно быть научно обосновано, подробно и ясно описано в протоколе исследования. • КИ проводят в соответствии с протоколом, заблаговременно утвержденным/одобренным Экспертным Советом/Комитетом по этике. • Ответственность за оказание медицинской помощи испытуемому может взять только квалифицированный врач. • Все лица. Участвующие в проведении КИ. должны получить профессиональное образование и опыт, соответствующий поставленным задачам. • Испытуемый может быть включен в испытание только на основании добровольного информированного согласия, полученного после детального ознакомления с материалами исследования. • Сбор, обработка и хранение информации, полученной в ходе КИ, должны обеспечивать точное и правильное представление, объяснение и подтверждение данных. • Документы, позволяющие установить личность испытуемого, необходимо сохранять в тайне от неуполномоченных лиц. • Производство и хранение исследуемого препарата, а также обращение с ним осуществляют в соответствии с Правилами организации производства и контроля качества ЛС, или G МР. Препарат используют в соответствии с утвержденным протоколом исследования. Документы, необходимые для проведения рандомизированного клинического испытания • Протокол исследования и поправки к нему. • Форма письменного информированного согласия, ее последующие редакции. • Материалы для привлечения испытуемых в исследование (например, рекламные объявления). • Брошюра исследователя. • Информация по безопасности исследуемого препарата. • Информация о выплатах и компенсациях испытуемым. • CV исследователя на настоящий момент и/или другие материалы, подтверждающие его квалификацию. • Любые другие документы, которые могут быть необходимы Экспертному совету/Комитету по этике для исполнения своих обязанностей. Экспертный совет/Комитет по этике Согласно Указу Минздрава РФ от 19 августа 1999г. № 891-У функции Комитета по этике при Федеральном органе контроля качества, эффективности и безопасности ЛС возложены на Национальный этический комитет. Основная задача Экспертного совета/Комитета по этике — защита прав и здоровья испытуемых, а также гарантия их безопасности. Особое внимание уделено исследованиям, участниками которых могут стать уязвимые испытуемые. Экспертный совет/Комитет по этике получает на рассмотрение документы, указанные выше (документы, необходимые для проведения РКИ). Экспертный совет/Комитет по этике рассматривает вопрос о проведении КИ в установленные сроки и дает письменное заключение, указывая название исследования, рассмотренные документы и дату одного из следующих возможных решений: • разрешения/одобрения на проведение исследования; • требования о внесении изменений в предоставленную документацию для получения разрешения/одобрения на проведение испытания; • отказа в разрешении/одобрении на проведение исследования; • отмены/приостановления данных ранее разрешения/одобрения на проведение исследования. Экспертный совет/Комитет по этике оценивает квалификацию исследователя на основании его CV на настоящий момент и/или другой необходимой документации, полученной по запросу Экспертного совета/Комитета по этике. В процессе исследования Экспертный совет/Комитет по этике рассматривает документацию с частотой, зависящей от степени риска испытуемых, но не реже одного раза в год. Если протокол указывает на невозможность получения согласия испытуемого или его законного представителя до момента включения в исследование (например, при терапии неотложных состояний), Экспертный совет/Комитет по этике должен убедиться в том, что в предоставленном протоколе и/или другой документации полноценно отражены этические аспекты этого исследования. Во избежание необоснованной заинтересованности или принуждения испытуемых Экспертный совет/Комитет по этике рассматривает порядок и суммы выплат испытуемым. В состав Экспертного совета/Комитета по этике должно входить достаточное количество лиц, обладающих необходимым опытом и квалификацией для экспертной оценки научных, медицинских и этических аспектов планируемого исследования. В состав Экспертного совета/Комитета по этике рекомендовано включение: • не менее пяти членов; среди них: • одного члена и более не научного работника; • одного члена и более не сотрудника медицинского учреждения/исследовательского центра, в котором проводят испытание. Только члены Экспертного совета/Комитета по этике, не являющиеся сотрудниками исследователя или спонсора, могут участвовать в голосовании по вопросу разрешения/одобрения исследования. Экспертный совет/Комитет по этике оформляет список своих членов с указанием их квалификации. Экспертный совет/Комитет по этике действует в соответствии с утвержденными стандартными процедурами, ведет необходимую документацию и протоколирует заседания. Его деятельность должна соответствовать Правилам G СР и действующим нормативным требованиям. На официальных заседаниях Экспертный совет/Комитет по этике принимает решения при наличии кворума, определенного соответствующим положением. Только члены Экспертного Совета/Комитета по этике, непосредственно участвующие в рассмотрении документации по исследованию и его обсуждении, могут голосовать и давать рекомендации по вопросу разрешения/одобрения испытания. Исследователь предоставляет информацию Экспертному совету/Комитету по этике по любым аспектам исследования, однако не участвует в прениях или в голосовании по вопросу разрешения/одобрения испытания. Информированное согласие Доктрина информированного согласия (см. Приложение 2 п. 4.8 и Приложение 3) означает, что врач, прежде чем попросить у пациента согласие на проведение курса лечения или отдельной процедуры, связанных с риском и имеющих альтернативы (особенно если шансы достичь успеха невысоки), должен предоставить пациенту следующую информацию: • суть предлагаемого лечения (процедуры); • риски и выгоды рекомендуемых мер, степень опасности самых неблагоприятных исходов (гибели или тяжелой инвалидности); • альтернативные методы лечения (процедуры), риски, опасность неблагоприятных исходов; • последствия отложенного или не начатого лечения; • вероятность успешного исхода, проявление этого успеха; • вероятные трудности и длительность периода реабилитации и возврата пациента к нормальному для него объему деятельности; • прочие сопутствующие сведения в форме ответов на вопросы, изложение аналогичных случаев из своего опыта, опыта бригады и т. п. Информация должна быть предоставлена в доступной для пациента форме, на понятном для него языке. Вопрос о компетентности решения часто возникает при заведомой неправоспособности пациента (дети, лица, признанные недееспособными в силу психических нарушений, дебильности, старческого слабоумия и т.д.). Здесь решения принимают по тем же схемам, с участием опекунов или попечителей. Относительно бездомных людей решения принимают социальные работники, специально на это уполномоченные. Если в семье или в органах опеки нет единого мнения, то вопрос о единственном опекуне решает суд. Добровольность — отсутствие какого-либо внешнего давления (угроза, подкуп, кабальные финансовые условия) на пациента при принятии решения, особенно при подписании письменных согласий или отказов. Дата добавления: 2015-02-05 | Просмотры: 1231 | Нарушение авторских прав |