|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Особенности неспецифического местного иммунитета при различных формах урогенитальной хламидийной инфекцииИзвестно, что при контакте с инфицированным человеком заражение полового партнера происходит не всегда. Развитие заболевания или его отсутствие, хронизация процесса зависят от исходного состояния иммунитета, массивности инфицирования, патогенности и вирулентности инфекционного агента (Бугрова О.Г., 2000). Схематично иммунный ответ при хламидийной инфекции можно представить следующим образом. Немедленная неспецифическая защита организма, определяемая фагоцитарной активностью макрофагов, длится несколько дней. Гуморальный иммун- 220 Глава II Таблица 2.3] Современные подходы к диагностике различных форм хламидийной инфекции
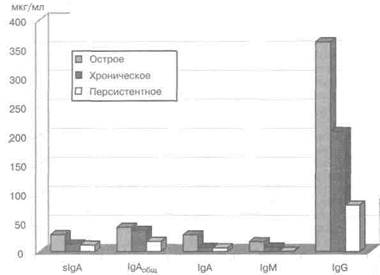
ный ответ характеризуется выработкой специфических IgM, IgG, IgA. Антитела против хламидийного ЛПС образуются на ранней стадии после инфицирования (IgM). Основное количество IgM находится в сосудистом русле (период полураспада 5 сут.). Уже через 48 ч после заражения можно обнаружить IgM (начало индуктивной фазы), его количество достигает максимума к 4—6 дням, после чего начинает снижаться и выявляется IgG. IgG находится как в сосудистом русле, так и в секретах организма (период полураспада 23 дня). IgA -секреторный Ig, период полураспада 58 дней. Первая быстрая защитная реакция состоит в локальном образовании slgA во входных воротах. Между 5-м и 20-м днями болезни последовательно появляются IgM-, IgA-, IgG-антитела против родоспецифических для хламидий ЛПС. Через 4—8 нед. после начала болезни определяются антитела класса IgG к ГБНМ- В женских половых органах обнаруживаются структуры, напоминающие лимфоидные образования в бронхах и пейеровы бляшки в кишечнике. В подсли-зитом слое влагалища, матки, маточных труб определяются диффузные скопле- роль инфекции и факторов реактивности организма в клинике, диагностике и лечении наиболее часто встречающихся воспалительных заболеваний женских половых органов 221 ния лимфоцитов, отдельно расположенные лимфоидные, плазматические клетки, тканевые макрофаги, нейтрофилы. В среднем Т-лимфоциты составляют 4% от нормальной клеточной популяции стромы эндометрия, макрофаги — 5%. Эти клетки выявляются в виде агрегатов в строме, между эпителиоцитами. Часть Т-лимфоцитов и макрофагов обнаруживается в просвете желез эндометрия. В агрегатах имеются лишь отдельные В-лимфоциты. Соотношение этих клеток меняется в зависимости от фазы менструального цикла и при беременности (Вард М.Е., 1996; Галкина О.В. и др., 1999; Яковлев В.М., Новиков А.И., 2000). Таким образом, половые органы женщины имеют собственную локальную иммунную систему. Местом наибольшей иммунологической активности женского репродуктивного тракта является шейка матки. В ее слизистой оболочке в виде отдельных скоплений располагается значительное число плазматических клеток, секретирующих главным образом IgA и IgG, и гораздо меньшее количество клеток, синтезирующих IgM. IgA- и lgG-синтезирующие клетки обнаруживаются не только в шейке матки и эндометрии, но и в слизистой оболочке влагалища (Медведев Б.И., Казачкова Э.А., Казачков Е.Л., 2000). Известно, что первая немедленная защитная реакция организма на хлами-дийную инвазию состоит в локальном синтезе slgA с последующим присоединением неспецифических факторов защиты, проявляющихся в первые часы после инфицирования (Вард М.Е., 1996; Столяров И.Д., 1999). В организме человека IgA находится в двух формах — сывороточной и секреторной. Период полураспада сывороточного IgA равен 6 дням. Около 40% IgA находится в сыворотке крови. На слизистых оболочках генитального тракта продуцируется секреторный IgA, который ингибирует связывание микроорганизмов с поверхностью клеток слизистых оболочек, тем самым препятствуя проникновению возбудителя в ткани. slgA отличается наличием S-компонента и продуцируется клетками двух типов: плазмоцитами, вырабатывающими полимерные IgA с I-цепями, и эпителиальными клетками, продуцирующими секреторный компонент. Установлено, что субэпителиальные плазмоциты обнаруживаются в маточных трубах, эндо- и эктоцервиксе, во влагалище. В эпителиальных клетках труб и эндоцер-викса обнаруживается секреторный компонент. Не исключено, что местный 'иммунный ответ может в определенной степени нейтрализовать инфекционную активность С. trachomatis, поскольку уровень slgA в цервикальной слизи обратно пропорционален количеству хламидийных телец в половых путях (Материалы 4-го Европейского конгресса по хламидиям, 2000). Высокий уровень slgA в секрете генитального тракта свидетельствует о хорошей защитной функции местного иммунитета. Местный иммунитет при хламидийной инфекции в настоящее время вызывает особый интерес клиницистов и иммунологов, поскольку изучение его механизмов имеет большое значение для определения тактики ведения пациенток с различными формами урогенитального хламидиоза. Все чаще появляются данные об отличиях в характере течения хламидийной инфекции, особенностях диагностики, лечения в зависимости от «остроты» заболевания. Для оценки клинической симптоматики, выбора максимально информативных Методов диагностики и проведения адекватной терапии многими авторами Предлагается проведение дифференциальной диагностики между острым, хроническим и персистентным течением урогенитального хламидиоза. А.В.Леонова и соавт. (2004) провели исследования по определению уровня IgМ, IgG, IgA в смыве вагинального секрета у пациенток с острым, хроническим и персистентым течением урогенитального хламидиоза. 222 Глава II ---------------------------,_______________.-------------------------------------------------- ч Вагинально-цервикальный секрет для количественного определения Ig получали путем смыва выделений из шейки матки и влагалища в 10 мл стерильного 0,14 М забуференного физиологического раствора с рН 7,4. В полученный секрет добавляли 0,0196 NaN, затем его центрифугировали при 8000 об/мин в течение 15 мин. Надосадочную жидкость отбирали, и секрет хранили при —20°С до исследования. Материал забирали до лечения. В цервикальной жидкости у всех пациенток определяли концентрации slgA, IgM, IgG и IgA методом сэндвич-ИФА. При постановке ИФА во все лунки 96-луночного плоскодонного полистирольного планшета («Биомедикал», Москва) помещали IgG-фракции AT, выделенные из козьих моноспецифических антисывороток к IgA, IgM, IgG, содержащих AT к тяжелой цепи соответствующего изотипа. Ig-фракции получали методом ионно-обменной хроматографии на ДЭДЭ-32-целлюлозе путем элюции AT из сывороток 0,02 М фосфатным буфером (рН 8,0). IgA, IgM, IgG разводили 0,05 М карбонатным буфером (рН 9,5) до концентрации 10 мкг/мл, добавляли по 100 мкл во все лунки планшетов и инкубировали в течение 16 ч при 4°С. При определении slgA в планшеты помещали AT к IgA в концентрации 50 мкг/мл и также инкубировали в течение 16 ч при 4°С. После инкубации AT планшеты трехкратно отмывали 0,14 М забуференного физиологического раствора (рН 7,4), содержащим 0,0596 твин-20, во все лунки добавляли эту жидкость по 100 мкл. Образцы секрета титровали с 1:2 до 1:256, а стандартные препараты — начиная с 1—4 мкг/мл. После этого планшеты помещали в термостат на 1 ч при 37°С. В качестве стандарта для определения IgM, IgG, IgA использовали пул сыворотки человека с известным содержанием Ig 3 изотипов, выраженным в мг на 1 мл; стандартом для определения slgA служил иммунохимически чистый slgA, выделенный из молозива. Все последующие стадии отмывки были аналогичны процедуре, описанной выше. IgG, IgM, IgA и slgA в секретах определяли с помощью специфических конъюгатов собственного изготовления в разведениях соответственно 1:3200, 1:600, 1:400 и 1:400. Конъюгаты готовили по методу M.Wilson и P.Nakane. Иммунную реакцию проявляли путем добавления в каждую лунку по 100 мкл субстратного буфера, представляющего собой смесь ортофенилендиамина с Н202, и последующей инкубацией планшета при комнатной температуре в течение 30 мин. Ферментативную реакцию останавливали добавлением в лунку 50 мкл H2S04. Интенсивность реакции учитывали на спектрофотометре с вертикальным лучом при длине волны 492 нм («Row»). Отрицательным контролем служили лунки первого ряда, содержащие все ингредиенты реакции, кроме исследуемых образцов. Удовлетворительным считали опыт, в котором оптическая плотность отрицательного контроля не превышала 0,2. Следует отметить, что при определении slgA в качестве посадочных AT использовали AT к а-цепи IgA, которые взаимодействовали с молекулами IgA и slgA. При добавлении конъюгата к slgA происходило его взаимодействие только с молекулами slgA. При этом свободный sc, который мог присутстсво-вать в секрете, а также сывороточный IgA не определялись. Количество Ig рассчитывали, используя универсальную компьютерную программу для ИФА, разработанную в лаборатории молекулярной иммунологии МНИИЭМ им. Г.Н.Габричевского. Для оценки содержания Ig в 1 мл ваги-нально-цервикального смыва полученные показатели увеличивали в 10 раз. Под наблюдением находились 22 пациентки с диагнозом «урогенитальная монохламидийная инфекция». В результате проведенного комплексного обследования было выделено 3 группы. Роль инфекции и факторов реактивности организма в клинике, диагностике и лечении наиболее часто встречающихся воспалительных заболеваний женских половых органов 223 1-ю группу с диагнозом «острая хламидийная инфекция» составили 6 пациенток. Диагноз был поставлен на основании данных анамнеза, указывающих на острое начало заболевания. Жалобы пациенток касались в основном нижнего отдела урогенитального тракта (выделения из половых путей, дискомфорт в области слизистых оболочек генитального тракта, учащенное мочеиспускание, рези при мочеиспускании). При гинекологическом осмотре чаще отмечались патологические изменения нижнего отдела генитального тракта. При лабораторной диагностике у всех пациенток этой группы определялись специфические фрагменты ДНК С. trachomatis методом ПЦР и диагностически значимые титры специфических IgA- и IgG-антител к ГБНМ С. trachomatis. IgG-антитела к Hsp 60 хламидий у всех пациенток 1-й группы не выявлялись. 2-ю группу составили 8 пациенток с хроническим течением заболевания. В этой группе фрагменты ДНК возбудителя выявлялись методом ПЦР только у 2% пациенток. Диагноз «хроническая урогенитальная хламидийная инфекция» выставлялся на основании данных анамнеза (у пациенток этой группы в анамнезе имелось указание на перенесенный ранее урогенитальный хламидиоз либо на длительно существующий воспалительный процесс генитального тракта неясной этиологии с периодически возникающими неярко выраженными обострениями), гинекологического осмотра и обнаружения диагностически значимых титров антител к ГБНМ хламидий. Для исключения персистентного течения заболевания проводилось определение IgG-антител к Hsp 60 С. trachomatis. Ни у одной пациентки не получено диагностически значимого титра антител к этому белку. 3-я группа включала пациенток с персистентным течением заболевания, требующих индивидуального подхода в терапии, динамического наблюдения. В эту группу вошли 8 женщин с жалобами на многократную неэффективную терапию по поводу урогенитального хламидиоза, длительно существующий неярко выраженный воспалительный процесс урогенитальной сферы, бесплодие. Данные гинекологического осмотра указывали на перенесенное заболевание, осложненное спаечным процессом в малом тазу. У пациенток 3-й группы методом ПЦР возбудитель не выявлялся. Однако специфические IgG-антитела к С. trachomatis определялись в диагностически значимых титрах. При этом в сыворотке крови всех пациенток 3-й группы определялись диагностически значимые титры IgG к Hsp 60 хламидий. Пациенткам с острым, хроническим и персистентным течением урогенитального хламидиоза проводилось определение уровня Ig различных классов в цервикально-вагинальном смыве. При оценке уровня IgM у пациенток с острым течением хламидийной инфекции его среднее значение составило 17 мкг/мл, у пациенток с хроническим течением заболевания — 8 мкг/мл, а у пациенток с персистентной формой - 0,8 мкг/мл. Уровень IgG в секрете урогенитального тракта у пациенток 1-й группы составил 361 мкг/мл, во 2-й группе - 206,5 мкг/мл и 80,2 мкг/мл у пациенток 3-й группы. При исследовании вагинального секрета у пациенток 1-й группы среднее значение slgA составило 29,3 мкг/мл, у пациенток 2-й группы - 13 мкг/мл, У пациенток 3-й группы —11,6 мкг/мл. Кроме того, производили оценку уровня сывороточного IgA. Среднее значение у пациенток 1-й группы составляло 29 мкг/мл, у пациенток 2-й группы — 7,2 мкг/мл, а у пациенток 3-й группы — 6,2 мкг/мл. Общий IgA у пациенток 1-й группы равнялся 42 мкг/мл, у пациенток 2-й группы - 36,5 мкг/мл, а у пациенток 3-й группы - 17,6 мкг/мл. 224 _______________________________________________________ [™й1[ Таблица 2.32 Уровень lg различных классов в смыве цервикально-вагинального секрета у пациенток с острым, хроническим и персистентным течением урогенитального хламидиоза
Рис. 2.15. Уровень lg различных классов в смыве цервикально-вагинального секрета у пациенток с различным течением хламидиоза. Полученные результаты представлены в таблице 2.32 и на рисунке 2.15. Известно, что факторы местного иммунитета репродуктивного тракта являются первой линией противоинфекционной защиты и могут предупреждать инфицирование или ограничивать размножение микроорганизмов (Вард М.Е., 1996). У здоровых женщин во влагалищном содержимом выделены lg всех классов. Концентрация IgG в секрете генитального тракта колеблется в пределах 70—370 мкг/мл, IgA — 60—150 мкг/мл, а содержание IgM составляет не более 20 мкг/мл (Галкина О.В. и др., 1999; Шварцман Я.С, Хазенсон Л.Б., 1978). На слизистой оболочке генитального тракта основная часть IgA представлена секреторной формой. При наличии воспаления в секрете может увеличиваться концентрация сывороточного IgA за счет диффузии из кровеносного русла. Анализируя полученные в ходе исследования результаты, следует обратить внимание на снижение у пациенток всех трех групп уровня общего (суммарного) IgA в вагинальном секрете. При хроническом и персистентном течении отмечается снижение уровня slgA, задача которого — предохранять слизистые оболочки от контакта с антигеном за счет антиадсорбционного действия. роль инфекции и факторов реактивности организма в клинике, диагностике и лечении наиболее часто встречающихся воспалительных заболеваний женских половых органов 225 Известно, что пролонгированная альтерация слизистой оболочки гениталь-ного тракта при длительно существующей хламидийной инфекции в результате воздействия ЭТ и РТ, а также аутоантигенов (продукты распада нейтрофиль-ных гранулоцитов и собственных тканей) может приводить к вторичному дефициту slgA. Возможно поэтому при острой хламидийной инфекции наблюдается максимальный по сравнению с другими группами уровень slgA, так как все изложенные изменения еще не успевают развиться. Уровень IgG в секрете генитального тракта при острой, хронической и пер-систентной формах урогенитального хламидиоза определялся в титрах, соответствующих нормальным значениям этого иммуноглобулина на слизистых оболочках половых органов у здоровых женщин. При этом у пациенток с острым и хроническим течением заболевания отмечалось содержание IgG в секрете генитального тракта на верхней границе нормы. Такое высокое содержание IgG может быть связано с его транссудацией из кровеносного русла в очаг воспаления. При персистентном течении заболевания этот показатель был значительно ниже, возможно, по причине уменьшения проницаемости сосудов вследствие ликвидации воспалительного процесса. Известно, что при первом контакте с антигеном В-клетки дифференцируются в плазматические клетки, продуцирующие IgM, IgG, IgA, а повторный контакт с антигеном приводит к значительному увеличению количества плазматических клеток в вагинальном эпителии, при этом количество IgG-плазматических клеток во много раз превышает количество IgA-плазматических клеток. Кроме того, удаление возбудителя из пораженных тканей происходит за счет опсонизации его IgG, по-видимому, поэтому при острой и обострении хронической хламидийной инфекции его уровень в секрете генитального тракта значительно более высокий. По данным литературы, при морфометрическом анализе самое низкое содержание Ig-продуцирующих клеток отмечается при монохламидийной инфекции, а при ассоциации хламидий с другими бактериями и грибами отмечалось наиболее высокое содержание IgG-плазмоцитов при одновременном уменьшении количества IgA-плазмоцитов собственной пластинки слизистой оболочки. Возможно, при острой и хронической хламидийной инфекции мы имеем дело не с моноинфекцией, а с недиагностированной смешанной (Гом-берг М.А., 2000; Дмитриев Г.А. и др., 1999). Уровень IgM, как и должно быть, максимально высок при острой хламидийной инфекции и близок к нулю при хронической и персистентной формах урогенитального хламидиоза. Интересным является тот факт, что уровень всех изотипов Ig при персистентной хламидийной инфекции приближается к нормальному уровню этих Ig в секрете генитального тракта здоровых женщин. Возможно, это еще раз доказывает необходимость выделения в отдельную группу пациенток с персистентной инфекцией. Тактика ведения этой группы больных должна строиться с учетом полученных показателей локального иммунитета. Дата добавления: 2014-12-11 | Просмотры: 920 | Нарушение авторских прав |