|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
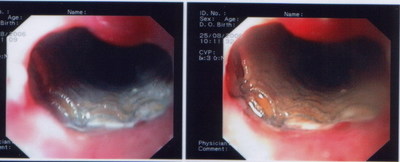
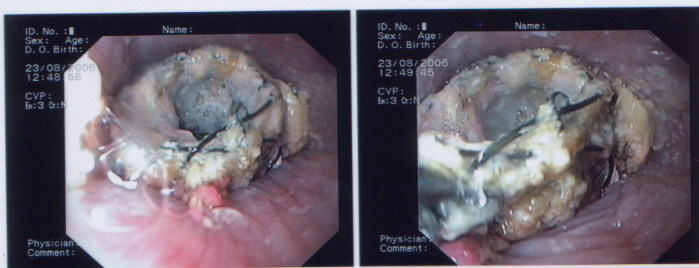
Эндоскопическая диагностика рака пищеводаОсновными способами диагностики рака пищевода являются инструментальные методы исследования - рентгенография и эзофагоскопия. Они дают возможность определить локализацию, форму роста, размеры опухоли и состояние стенок пищевода вблизи нее. Наиболее точным способом диагностики рака пищевода является эзофагоскопия (рис. 51, 52, 53). Данный метод исследования показан при подозрении на любое функциональное или органическое заболевание пищевода. Отказ от применения эзофагоскопии даже при минимальной местной клинической симптоматике следует считать грубой ошибкой. С развитием фиброволоконной оптики этот метод исследования стал практически безопасным для больных. Различные тяжелые осложнения, наблюдавшиеся раньше при выполнении исследования жестким (тубусным) прибором, встречаются крайне редко при использовании фиброэндоскопов. Эзофагоскопия позволяет выявлять опухоли, язвы, эрозии, стенозы пищевода, объясняющие причину возникновения пищеводных болей. Главным достоинством эзофагоскопии является возможность получения биоптата измененных участков слизистой.
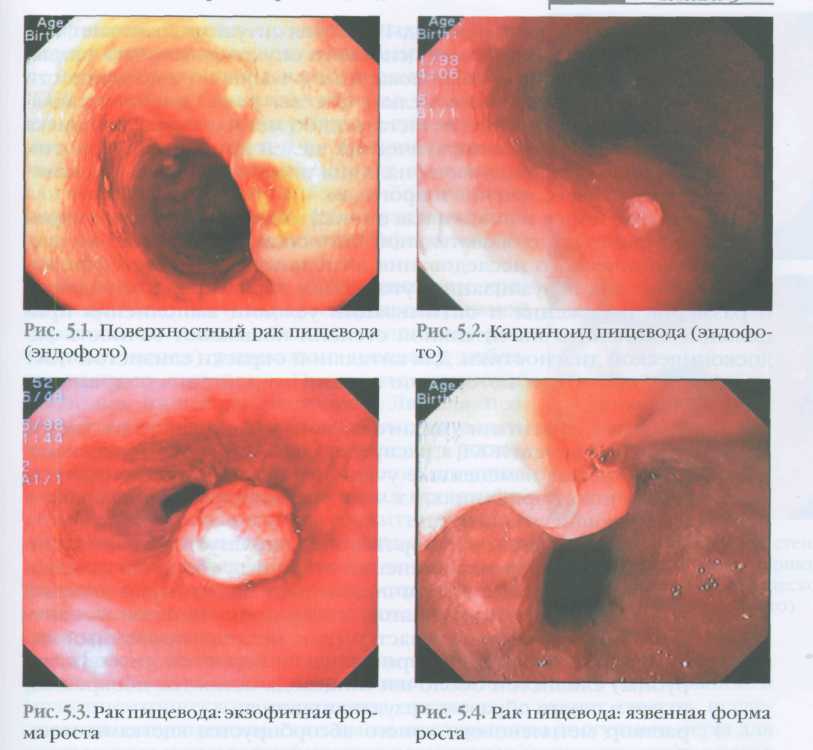
Рис. 51. Эзофагоскопия. Плоскоклеточный рак пищевода с эндофитным ростом
Рис. 52. Эзофагоскопия. Рак пищевода с экзофитным ростом и поверхностный рак пищевода.
Рис. 53. Эзофагоскопия. Инфильтративно-стенозирующий рак пищевода.
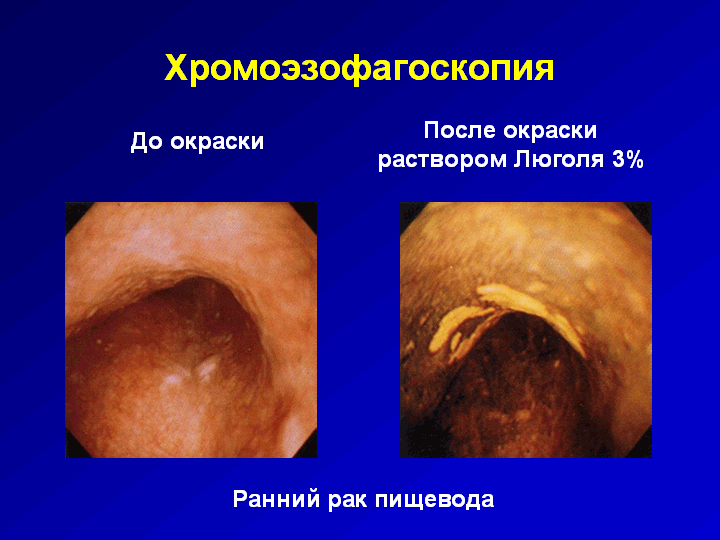
В процессе эзофагоскопии решаются следующие задачи: 1) выявление опухолевого поражения пищевода и оценка его макроскопической картины; 2) выявление воспалительных и неопухолевых изменений слизистой оболочки пищевода; 3) определение верхней и по возможности нижней границы поражения; 4) установление наличия циркулярного поражения стенок пищевода; 5) проведение эндоскопической биопсии (щипцовая, пункционная, эксцизионная, браш-биопсия); 6) оценка непосредственного эффекта лучевой или химиолучевой терапии; 7) оценка возможности использования фотодинамической терапии или лазерной деструкции опухоли (в случаях малых по протяженности опухолей пищевода, не прорастающих в мышечный слой стенки); 8) выявление наличия раннего рака пищевода с использованием диагностических препаратов гематопорфиринового ряда. Расположение зоны патологических изменений пищевода регистрируется как расстояние от резцов до проксимальной и дистальной ее границ. Если для эндоскопической оценки доступна лишь проксимальная граница опухоли, важно установить, не являются ли изменения пищевода вторичными. В подобных случаях возрастает значение рентгенологического метода в уточнении особенностей поражения пищевода. Эзофагоскопическая картина рака пищевода весьма разнообразна и зависит прежде всего от формы роста опухоли и ее размеров (рис. 51, 52). При эндоскопическом исследовании выделяют следующие типы опухолевого поражения: 1) опухоли с преимущественно экзофитным ростом (рис. 52) - полиповидный, папилломатозный, крупнобугристый, блюдцеобразный рак; 2) опухоли с преимущественно эндофитным ростом (рис. 51) - очаговый плоский инфильтрат, язвенно-инфильтративный рак, инфильтративно-стенозирующий рак; 3) смешанные и язвенные формы опухоли. При экзофитном росте выявляются бугристые опухолевые массы, выступающие в просвет пищевода (рис. 52), легко кровоточащие при дотрагивании эзофагоскопом. При эндофитной форме (рис. 51) слизистая оболочка длительное время остается интактной, отмечается лишь локальная ригидность стенки пищевода или изменение окраски слизистой оболочки. Изъязвленные формы (рис. 53) характеризуются наличием язв неправильной формы с неровными бугристыми краями. Хромоэзофагоскопия. Это исследование предназначено для визуализации, уточнения характера, локализации и размеров поражения, а также для выполнения прицельной биопсии. Для витальной окраски слизистой пищевода используют красители, которые по механизму действия подразделяются на 3 группы: I. Контрастные красители (индигокармин) не окрашивают нормальные клетки слизистой оболочки пищевода, распределяясь по поверхности слизистой, окрашивают только ее измененные участки. II.Абсорбирующиеся красители: 1) водный раствор Люголя (2-3%) используется для визуализации минимальных изменений слизистой оболочки пищевода, он окрашивает в коричневый цвет нормальный плоский эпителий, измененные участки слизистой оболочки пищевода остаются неокрашенными и таким образом визуализируются (рис. 54, 55); 2) раствор метиленового синего абсорбируется клетками метаплазированного и диспластического эпителия, участки измененной слизистой оболочки окрашиваются в голубой или фиолетовый цвет и становятся отчетливо видимыми на фоне неизмененной бледно-розовой слизистой оболочки пищевода; 3) раствор толуидинового синего прокрашивает ядра призматического эпителия желудка и цилиндрического интестинального эпителия и используется для выявления участков метаплазированного эпителия при пищеводе Барретта, на фоне которого часто возникает рак пищевода. III. Реактивные красители (конго красный и фенол красный) не применяются для витальной окраски слизистой оболочки пищевода. Они предназначены для изучения кислотопродуцирующих зон (конго красный) и инфицирования Helicobacter pyloriслизистой желудка (фенол красный).
Рис. 54. Эзофагоскопия. Очаги гликогенового окантоза. Окраска раствором Люголя 3%.
По данным S. Yoshida, проведение хромоэзофагоскопии радикально изменяет неблагоприятную ситуацию. Орошение слизистой оболочки пищевода раствором Люголя позволяет визуализировать невидимые патологические очаги, выполнить их прицельную биопсию, получить адекватный биопсийный материал для морфологического исследования, уточнить истинный характер измененных участков слизистой пищевода, планировать и провести лечение больного с учетом реальной распространенности опухоли, улучшить результаты лечения и прогноз заболевания. Использование данной методики дало возможность за счет увеличения доли больных с ранним раком увеличить 5-летнюю выживаемость до 44%.
Рис. 55. Эзофагоскопия. Визуализация невидимых патологических очагов.
Основой активного выявления рака пищевода является динамическое эндоскопическое наблюдение с повторными биопсиями из участков измененной слизистой оболочки. Поэтому одним из современных скрининговых методов ранней диагностики рака является эзофагоскопия с витальной окраской слизистой оболочки пищевода. Таким образом, тщательная оценка изменений слизистой оболочки пищевода с использованием хромоэзофагоскопии дает возможность выявлять значительно большее количество больных с ранним раком. Эндоскопическое исследование в качестве скрининга для выявления метаплазии Барретта и раннего рака пищевода показано: пациентам старше 40 лет с симптомами ГЭРБ более 3 лет, пациентам с эзофагитом, пациентам со стриктурой пищевода, пациентам после операций на пищеводе и желудке. Проведение массового скрининга остается нерешенной проблемой. На сегодняшний день целесообразным является выделение групп риска и проведение диспансерного наблюдения. При выявлении ПБ проводится тщательный поиск диспластических изменений. Если дисплазия не выявлена, эндоскопическое исследование проводится раз в год. При выявлении дисплазии низкой степени назначается консервативная терапия с повторными биопсиями. Выявление дисплазии высокой степени является показанием к оперативному лечению. Всем больным с установленным раком пищевода выполняют трахеобронхоскопию. Поскольку стенка пищевода в пределах средостения лишена хорошо выраженной наружной оболочки, инвазивный рост опухоли пищевода довольно рано распространяется на трахею и бронхи. Исследование направленно на поиск вовлечения стенок трахеобронхиального дерева в опухолевый инфильтрат, а также наличия возможной злокачественной пищеводно-респираторной фистулы.
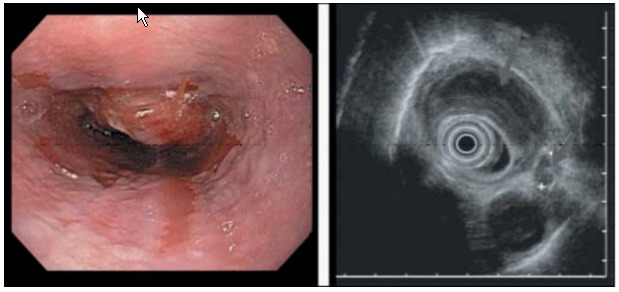
Задачи трахеобронхоскопии: 1. Оценка состояния слизистой бронхиального дерева. 2. Выявление сужений просвета трахеи и бронхов и степень его выраженности за счет прорастания или сдавления извне метастатическими лимфатическими узлами. При выявлении сужения просвета трахеи или бронхов за счет сдавления опухолью более чем на 1/3 резектабельность опухоли весьма сомнительна. 3. Определение расстояния до бифуркации трахеи. 4. Выявление первичной множественности опухолевого процесса (поражения бронхиального дерева синхронными опухолями легкого). Соноэзофагоскопия. В начале 1980-х годов фирмой Olympus Optical Co. Ltd. был разработан принципиально новый диагностический прибор - эхоэндоскоп, соединивший в себе ультразвуковой датчик и гибковолоконный эндоскоп. Методика исследования получила название эндоскопическая ультрасонография - соноэзофагоскопия, синонимы: эндосонография, эхоэндоскопия, эндоскопический ультразвук, эндо-УЗИ. Сочетание стандартного эндоскопического исследования и сонографии в единой диагностической процедуре дает возможность врачу под визуальным контролем подвести ультразвуковой датчик к объекту исследования и получить эхограмму не только патологически измененного участка стенки органа, но и, в зависимости от применяемой частоты сканирования, прилегающих органов, лимфатических узлов и других анатомических структур. При использовании эхоэндоскопов возможно изменение частоты сканирования во время исследования от 5 до 20 МГц. Высокочастотное (15-20 МГц) сканирование обладает большей чувствительностью в определении глубины инвазии опухоли, особенно при поверхностном поражении (раннем раке), но уступает низкочастотному (5-12 МГц) в оценке состояния регионарных лимфатических узлов. Существуют также УЗ-зонды, проводимые через биопсийный канал стандартных эндоскопов. Это исследование особенно ценно при сужениях пищевода различной этиологии. В свою очередь, при применении зондовой методики эндоскопического УЗИ сканирование выполняется только на высоких частотах, что ограничивает его диагностические возможности (рис. 56).
Рис. 56. Эндоскопическая картина и эндосонограмма
Ультразвуковое исследование в диагностике рака пищевода с разработкой внутриполостных датчиков приобретает значительно большее значение, чем компьютерная (КТ), магниторезонансная (МРТ) и позитронная эмиссионная (ПЭТ) томография. Точность данной методики для категории Т колеблется от 77 до 92%, для категории N - 50-88%. Эндосонография особенно информативна при описании опухолей, ограниченных слизистым и подслизистым слоем, то есть в тех случаях, когда КТ, МРТ, ПЭТ не могут достоверно отразить опухолевое поражение. При определении состояния регионарных лимфатических узлов точность эндоскопического УЗИ составляет 81% (чувствительность - 95%, специфичность - 50%). Особо отмечен приоритет внутриполостного УЗИ в определении глубины опухолевого поражения при ранних стадиях, когда КТ и МРТ малоинформативны. Важность дифференциации слоев состоит в том, что вероятность поражения лимфатических узлов резко увеличивается для опухолей, которые распространяются на подслизистый слой. При поражении только слизистого слоя метастазы в лимфатических узлах, как правило, отсутствуют, в то время как при поражении подслизистого слоя частота метастазирования в лимфатические узлы возрастает до 30-40%. При радиальном сканировании стенка неизмененного пищевода равномерно 5-слойная, некоторые авторы различают 7 слоев. Первый, тонкий гиперэхогенный слой представляет собой собственно слизистую оболочку. Непосредственно под ним визуализируется тонкий гипоэхогенный слой, что соответствует мышечной пластинке слизистой оболочки. Следующий гиперэхогенный слой - подслизистая основа. Мышечная оболочка пищевода хорошо определяется как гипоэхогенный слой, далее визуализируются гиперэхогенные адвентиция и окружающие ткани (рис. 57). Слоистое строение пищевода при ЭСГ менее четкое, чем желудка. Пассивное движение пищевода, связанное с дыханием и работой сердца, также в некоторой степени искажает эндосонограммы.

Рис. 57. Эндосонография. Радиальное сканирование стенки пищевода и соответствующие оболочки органа.
Забор биопсийного материала на гистологию и цитологию. Взятие фрагмента ткани опухоли для гистологического исследования является неотъемлемой частью эндоскопического исследования. Однако далеко не у всех больных удается получить морфологическое подтверждение диагноза. Это связано с тем, что в целом ряде случаев наблюдается преимущественно подслизистый рост опухоли. В подобных ситуациях необходима повторная эзофагобиопсия. Весьма эффективным является цитологическое исследование промывных вод из пищевода. Многие авторы считают, что данный метод более эффективен в диагностике рака пищевода, чем гистологическое исследование биоптата из опухоли. Особенно велика ценность цитологического исследования в диагностике раннего рака пищевода, когда рутинная рентгенография и эзофагоскопия не в состоянии выявить специфические признаки опухолевого заболевания. При отсутствии выраженного стеноза целесообразно также исследование промывных вод желудка, куда попадают слущенные клетки из опухоли пищевода. При анализе гистологической картины биоптатов слизистой оболочки пищевода могут быть выявлены выраженные в той или иной степени изменения эпителия. Эпителиальный пласт редко сохраняет обычную толщину, это бывает только при катаральном эзофагите и длительности заболевания от нескольких месяцев до 1-2 лет. Чаще выявляется атрофия эпителия, истончение эпителиального слоя, но изредка наряду с атрофией могут быть обнаружены участки гипертрофии эпителиального пласта. Слоистость эпителия местами нарушена, при этом эпителиальные клетки (эпителиоциты) находятся в состоянии дистрофии, выраженной в той или иной степени. В отдельных случаях дистрофия завершается некрозом клеток, особенно ярко выраженным в поверхностных слоях эпителия. Базальная мембрана эпителия в большинстве случаев сохраняет обычные размеры, но у некоторых больных может быть утолщена и склерозирована. Наряду с выраженными дистрофически-некротическими изменениями эпителия отмечается гиперемия сосудов, во всех случаях количество сосочков значительно увеличено, причём у большинства больных с длительным анамнезом количество сосочков увеличено прямо пропорционально давности заболевания. В толще эпителия и в субэпителиальном слое выявляются очаговые (как правило, периваскулярные), а местами диффузные лимфоплазмоцитарные инфильтраты с примесью единичных эозинофилов и полинуклеарных нейтрофилов. Инфильтраты располагаются как в области сосочков, так и в более глубоких слоях под эпителием, при этом отмечается разволокнение мышечных волокон. В отдельных случаях длительно текущего заболевания среди воспалительных инфильтратов могут быть обнаружены сосуды с явлениями продуктивного васкулита. Инфильтрат, как правило, чрезвычайно полиморфный, доминируют моноциты, плазматические клетки, лимфоциты, макрофаги, а при длительно текущем эзофагите - фибробласты. При активно текущем эзофагите количество нейтрофилов оказывается значительным, при этом часть нейтрофилов обнаруживается в толще эпителиального пласта внутри клеток (лейкопедез эпителия). Данную картину можно наблюдать преимущественно в нижней трети эпителиального пласта. В единичных случаях наряду с нейтрофилами обнаруживаются межэпителиальные лимфоциты и эритроциты. В небольшом проценте случаев морфологических проявлений активно текущего воспалительного процесса не обнаруживается. При этом в слизистой оболочке пищевода отмечается разрастание рыхлой, а местами плотной волокнистой соединительной ткани (склероз). В полях склероза нередко встречаются фибробласты и разрушенные макрофаги. Гладкомышечные клетки собственной пластинки слизистой оболочки подвержены выраженной дистрофии или атрофии, а в редких случаях - коагуляционному некрозу. В отдельных случаях клетки нижней трети эпителиального пласта оказываются полиморфными с умеренно гиперхромными ядрами, в единичных клетках наблюдаются фигуры митозов. Подобные изменения характерны для слабо выраженной дисплазии эпителия. При гистологическом исследовании может быть выявлена метаплазия плоского неороговевающего эпителия пищевода, которая приводит к появлению цилиндрического эпителия с фундальными железами (выявляются париетальные, главные и добавочные клетки в железах, а покровный эпителий формирует типичные валики, покрытые покровно-ямочным эпителием). При этом железы немногочисленны, сдавлены разрастаниями соединительной ткани и диффузным лимфоплазмоцитарным инфильтратом. Если метаплазия приводит к появлению цилиндрического эпителия кардиального или фундального типа слизистой желудка, то риск развития аденокарциномы пищевода не увеличивается. Однако, если метаплазия приводит к появлению специализированного тонкокишечного цилиндрического эпителия, риск озлокачествления становится явным. Специализированный цилиндрический эпителий при этом диагностируется как неполная тонкокишечная метаплазия с наличием бокаловидных клеток Дата добавления: 2015-02-05 | Просмотры: 2125 | Нарушение авторских прав |