|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Лимфодиссекция при раке пищевода
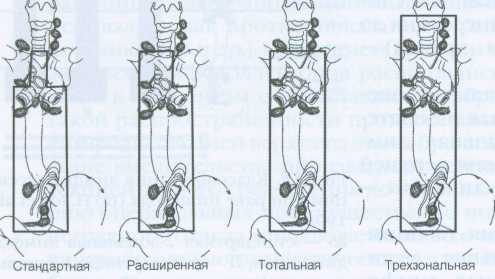
Согласно современным представлениям, лимфатическая система пищевода характеризуется многоуровневым строением. Наиболее разветвленной является слизисто-подслизистая лимфатическая сеть, расположенная по обе стороны muscularis mucosae. Лимфатические капилляры слизисто-подслизистой сети образуют овальные продолговатые петли, вытянутые параллельно продольной оси органа. Наличие большого количества анастомозов делает сеть пространственным трехмерным образованием. Путем слияния от двух до пяти лимфатических капилляров слизисто-подслизистой сети под muscularis mucosae берут свое начало отводящие лимфатические сосуды 1-го порядка. Часть отводящих лимфатических сосудов сразу пронизывает мышечную оболочку пищевода и направляется к параэзофагеальным лимфатическим узлам. Другая часть проходит в подслизистом слое довольно большой путь (до 12 см) и только затем либо направляется к лимфатическим узлам, либо, через коллатерали, дренируется в 5 продольных лимфатических каналов в межмышечном слое. Продольные межмышечные лимфатические каналы через радиальные лимфатические протоки и периэзофагеальные лимфатические узлы, расположенные под адвентициальной оболочкой органа, дренируются в лимфатические коллекторы. Выделяют 3 зоны: брюшную полость (зона I), средостение (зона II) и шею (зона III). Границы лимфодиссекции в брюшной полости и на шее четко определены. В средостении выделяют стандартную, расширенную и тотальную диссекции. В 1995 году на согласительной конференции ISDE было достигнуто соглашение, что тотальная медиастинальная лимфодиссекция должна быть выполнена при радикальных резекциях рака пищевода, расположенного выше уровня бифуркации трахеи. Также при опухолях выше бифуркации должны выполняться 3-х зональные операции. На упомянутой конференции не были определены границы лимфодиссекции при раке пищевода, расположенного ниже уровня бифуркации трахеи. В любом случае границы диссекции должны быть шире, чем распространенность опухоли, только в этом случае можно ожидать улучшения результатов лечения. На основании данных анатомо-морфологических работ по лимфатической системе пищевода был сделан вывод, что следствием многоуровневого строения является значительное развитие как интра-, так и экстраорганной лимфатической системы с преобладанием продольного вектора лимфооттока над поперечным. Такое строение лимфатической системы предопределяет особенности лимфогенного метастазирования при раке пищевода: 1) значительная вариабельность направлений метастазирования различных отделов; 2) отсутствие сегментарности метастазирования; 3) появление пылевидных внутристеночных метастазов в пищеводе, часто на значительном расстоянии от первичной опухоли (до 8 см); 4) появление «прыгающих» метастазов («skip metastasis») в лимфоузлах, которые выявляются до 30% случаев, причем в 23% случаев это экстрамедиастинальные лимфоузлы верхнего этажа брюшной полости и шейно–надключичных зон. Под «прыгающими» метастазами следует понимать метастатическое поражение более отдаленных групп лимфатических узлов, расположенных в следующем этапе метастазирования, при интактности более проксимальных групп лимфоузлов. Преобладание продольного вектора метастазирования определяет возможность поражения любой группы лимфоколлекторов при локализации опухоли в различных отделах пищевода. Однако на большом клиническом материале отмечено, что: 1) рак верхнегрудного отдела пищевода наиболее часто метастазирует в лимфатические узлы верхнего средостения, а также шейно–надключичной области; 2) рак среднегрудного отдела пищевода практически с одинаковой частотой метастазирует как в медиастинальные, так и в абдоминальные лимфоколлекторы; 3) рак нижнегрудного отдела чаще метастазирует в паракардиальные и забрюшинные лимфатические узлы бассейна левой желудочной артерии и чревного ствола, а также лимфатические узлы заднего средостения до уровня бифуркации трахеи. В связи с внедрением в клиническую практику расширенных операций при раке пищевода и широким их распространением возникла необходимость стандартизации объема и классификации лимфодиссекции. Японские хирурги (Ide H. et al) из Токийского института гастроэнтерологии предложили классификацию типов операций по поводу рака пищевода в зависимости от объема лимфодиссекции (рис. 64).
Рис. 64. Классификация лимфодиссекции при раке пищевода (ISDE, 1994).
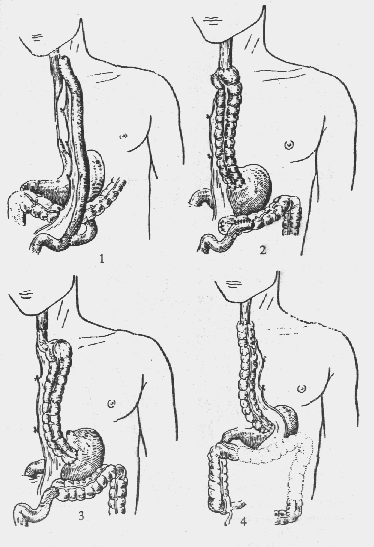
1. Стандартная двухзональная операция (абдоминальная и медиастинальная лимфодиссекция до уровня бифуркации трахеи) - 2S. Удаление параэзофагеальных, парааортальных, бифуркационных, правых и левых корневых лимфоузлов. 2. Расширенная двухзональная операция (абдоминальная и билатеральная медиастинальная лимфодиссекция до уровня верхней апертуры) - 2F. Это стандартная лимфаденэктомия, дополненная удалением правых паратрахеальных, а также лимфоузлов правого возвратного нерва. 3. Трехзональная операция (абдоминальная, билатеральная медистинальная и шейная лимфодиссекция – 3F. Это расширенная лимфаденэктомия, дополненная удалением лимфоузлов левого возвратного нерва. Согласно данным многочисленных авторов, при стандартных операциях удаляются в среднем 20-25%, при расширенных – 40-50%, при трехзональных — 70-75% лимфатических узлов. Показания к трехзональным операциям. В настоящее время трехзональная лимфодиссекция должна выполняться в специализированных учреждениях в следующих случаях: 1) рак средне-/верхнегрудного отделов пищевода; 2) возраст пациентов до 70 лет; 3) опухоли Т1-3; 4) отсутствие отдаленных гематогенных метастазов; 5) метастазы не более чем в 4 лимфоузлах, особенно при поражении узлов верхнего средостения и шейно-надключичной области, подтвержденные пред- либо интраоперационно при срочном морфологическом исследовании; 6) выполнение радикальной резекции в брюшной полости и средостении. При планировании операции с трехзональной лимфодиссекцией предоперационное обследование больного обязательно должно включать томографию органов брюшной полости и средостения, а также эзофагосонографию пищевода. Анализ результатов лечения больных раком внутригрудного отдела пищевода с использованием расширенной двух- и трехзональной лимфодиссекции показал, что оба вмешательства характеризуются удовлетворительными результатами непосредственных осложнений и летальности. Метастазы в лимфатические узлы шейно-надключичной области были выявлены у 37,5% пациентов, что свидетельствует о более достоверном стадировании в группе с трехзональной лимфодиссекцией. Частота рецидива процесса в лимфатических узлах составила 59%, причем в 54,2% это были регионарные узлы шейно-надключичной области, подлежащие обязательному удалению при трехзональной лимфодиссекции. Авторы делают вывод об обязательном выполнении расширенной трехзональной лимфодиссекции у пациентов с раком верхнегрудного отдела пищевода и при выявлении метастазов в верхнемедиастинальные лимфоколлекторы. Вопросы пластики пищевода Вопрос пластического замещения после резекции пищевода в течение многих десятилетий был в центре внимания хирургов. Особенно остро этот вопрос стоял в эпоху широкого применения резекции пищевода по методу Торека. В настоящее время операция Торека не используется в чистом виде, а ее выполнение свидетельствует о чрезвычайно низкой квалификации хирурга. Следует отметить, что предлагается большое количество модификаций эзофагопластики (рис. 65), но все они основаны на принципах одномоментной или многоэтапной пластики.
Рис. 65. Варианты пластики пищевода: 1 – по С.С. Юдину, 2 – по Райту, 3 – по Лафаргу, 4 – по Ореони и Туне.
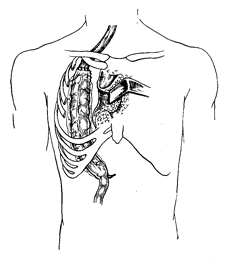
Для пластики пищевода используют тонкую, толстую кишку и желудок, чаще применяют пластику желудком - трубчатым лоскутом, который создают из его большой кривизны. Способы проведения трансплантата: антеторакальным путем, ретростернально, ретрокостально, но чаще всего используют заднемедиастинальное положение. В ходе выполнения общепризнанных в данное время одномоментных операций практически все авторы отдают предпочтение эзофагопластике по Льюису (рис. 66).
Рис. 66. Схема одномоментной операции по Льюису.
Операция Льюиса проводится двумя отдельными доступами: лапаротомным для мобилизации всего желудка и торакотомным справа для мобилизации и резекции пищевода, а также наложения соустья с перемещенным в плевральную полость желудком. Очередность этапов торакотомии и лапаротомии может меняться, или операция выполняется двумя бригадами. Логичнее сначала выполнить торакотомию и убедиться в резектабельности опухоли, а затем произвести лапаротомию и подготовить желудок к перемещению, но можно выполнить сначала полную мобилизацию желудка, а затем торакотомию. Если опухоль не резектабельна, то накладывают обходной пищеводно-желудочный анастомоз. Обычно всегда начинают с лапаротомии, проводя полную мобилизацию желудка, как было описано выше. При этом выясняется наличие метастазов в брюшной полости. Из брюшной полости проводят пальцем мобилизацию пищевода в области отверстия диафрагмы. Рану брюшной полости зашивают наглухо. Больного поворачивают на левый бок и производят правостороннюю торакотомию в пятом межреберье. Пищевод мобилизуют до необходимого уровня. Потягиванием за пищевод осторожно выводят желудок в плевральную полость, предварительно растянув пищеводное отверстие. Пищевод отсекают над кардией и инвагинируют. Осуществляют пищеводно-желудочное соустье и фиксируют желудок. Доступ позволяет осуществить широкий обзор операционного поля, безопасно мобилизовать грудной отдел пищевода на всем протяжении, при этом выполнить лимфодиссекцию в любом объеме. В случае необходимости произвести резекцию смежных органов, сохранить легочные ветви блуждающего нерва (крайне важная деталь для профилактики послеоперационных дыхательных нарушений), надежно сформировать пищеводный анастомоз в верхней апертуре грудной клетки, где имеются хорошие условия для нормального функционирования соустья, а также соблюсти при раке средне- и нижнегрудного отдела положенную границу проксимальной резекции - минимум 8 см. В случаях невозможности выполнения пластики по Льюису прибегают к пластике трансплантатом из толстой кишки (колоэзофагопластика) или к илеоколоэзофагопластике по Добросмыслову-Тореку (рис. 67).

Рис.67. Схема многоэтапной операции Добросмыслова-Торека. А - операционные доступы; Б - уровень резекции пищевода; В - выкраивание трансплантата из толстой кишки; Г - завершение операции эхофагопластикой.
Цель операции - резекция всего грудного отдела пищевода, выведение культи его шейного отдела на кожу и наложение гастростомы. Оперативный доступ - правосторонняя боковая торакотомия в 5-6 межреберье. После вскрытия плевральной полости и отведения легкого вентрально рассекают медиастинальную плевру от диафрагмы до плеврального купола, пересекают дугу непарной вены между лигатурами. Пищевод выделяют вместе с опухолью, окружающей клетчаткой и лимфатическими узлами. Шейный отдел пищевода выделяют тупо со стороны плевральной полости. После мобилизации пищевода на уровне диафрагмального отверстия его дважды перевязывают прошивной лигатурой и пересекают. Культю пищевода погружают в кисетный шов, поверх которого накладывают 2-3 шелковых узловых шва. Шейный отдел пищевода прошивают и пересекают у купола плевральной полости, на культю надевают резиновый колпачок. Резецированный отдел удаляют, грудную полость зашивают с оставлением двух дренажей, введенных к куполу плевры и диафрагме. Затем проводят обнажение шейного отдела пищевода, разрезом длиной 3-4 см вдоль внутреннего края грудино-ключично-сосцевидной мышцы на уровне нижней ее трети. Тупым и острым путем подходят к пищеводу, выделяют его и выводят культю в рану. Формируют свищ на шее, подшивая края пищевода к коже через все слои узловыми шелковыми швами. Затем производят гастростомию. Через 3-6месяцев при отсутствии метастазов - пластика пищевода. Почти никто не имеет сомнений и относительно способа проведения трансплантата. Заднее средостенное лоно пищевода признано оптимальным и наиболее физиологическим. Частные вопросы разные авторы решают по-разному. Так, в случае гастропластики преимущество в основном отдается целому желудку, однако применяется и методика выкраивания лоскута из большей кривизны. Новой тенденцией стали пластические пересаживания свободных трансплантатов с использованием микрососудистых анастомозов. Дальше всех в этом направлении пошли японские хирурги, которые в случае резекции шейного пищевода (удаление гипоглотки и ларингоэктомия) прибегают к свободной трансплантации двух кишечных сегментов: толстокишечного и толстокишечно-клубового. Первый сегмент используется для восстановления глоточно-пищеводного дефекта, а второй - для возобновления голосовой функции. В хирургии пищевода главной всегда была проблема надежности пищеводных анастомозов. В настоящее время частота невозможности их выполнения заметно снизилась и в ведущих клиниках она или равняется нулю, или не превышает несколько процентов. Сегодня большинство хирургов формируют пищеводные анастомозы вручную двурядным или, изредка, однорядным швом в бесчисленных технических модификациях. Используют современные атравматичные монолитные шовные материалы. Однако механический способ анастомозирования также широко используется. Это связано с тем, что на базе советских циркулярных сшивающих аппаратов, созданных еще в конце 50-х, в США были разработаны более совершенные аппараты. Их главное отличие – двухрядность накладываемых швов. Важно и то, что в этих аппаратах используются более тонкие скрепки из титана, а заряжение скрепок в кассеты осуществляется в заводских условиях, что существенным образом повышает качество и надежность соединения тканей. Современные принципы хирургии рака пищевода сформулированы М.И.Давыдовым и И.С.Стилиди: 1) максимальная безопасность вмешательства: правильный выбор оперативного доступа и объема хирургического вмешательства, рациональные приемы мобилизации и обработки смежных органов, формирование надежных пищеводных анастомозов; 2) онкологическая адекватность: мобилизация "острым путем" по принципу от сосуда к пораженному органу, правильная последовательность мобилизации пораженного органа с целью профилактики интраоперационной диссеминации, моноблочный принцип интраабдоминальной, медиастинальной и шейной лимфодиссекции; 3) высокая функциональность: выбор рационального метода пластики, формирование технически простого антирефлюксного анастомоза. Сравнительный анализ эффективности одномоментных и многоэтапных операций показал преимущество первых по показателям послеоперационной летальности (6,6%), завершенности лечения (98%) и отдаленным результатам (33% пятилетней выживаемости). Субтотальная одномоментная резекция и пластика пищевода с формированием эзофаго-гастроанастомоза в куполе правого гемиторакса с расширенной абдоминальной и медиастенальной лимфодиссекцией (операция типа Льюиса) соответствует требованиям онкологической абластики при раке нижне-среднегрудного отдела пищевода и может быть рекомендована практическим хирургам-онкологам в случае отсутствия признаков генерализации и функциональной неоперабельности. Разработанный эзофаго-фундоанастомоз отличается высокой надежностью, хорошими антирефлюксными свойствами и практически исключает развитие недостаточности швов соустья при строгом соблюдении методики и техники оперирования.
Дата добавления: 2015-02-05 | Просмотры: 3154 | Нарушение авторских прав |