|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Аденилатциклаза и ее регуляцияОткрытие цАМФ и аденилатциклазы группой Sutherland было связано с изучением регуляции печеночного гликогенолиза адреналином и глюкагоном [4]. Эти исследователи показали, что такие гипергликемизирующие агенты вызывают активацию гликогенфосфорилазы и последующее расщепление гликогена до глюкозофосфатов. Затем было показано, что активация гликогенфосфорилазы зависит от промежуточного этапа (позднее идентифицированного как фосфорилирование под действием протеинкиназы), который стимулируется термостабильным фактором, образующимся при взаимодействии гормона с нерастворимой фракцией печеночной клетки. Было установлено, что последняя реакция требует АТФ, который в присутствии гормона и иона магния превращается в цАМФ и неорганический фосфат. Далее было показано, что фермент, ответственный за эту реакцию, располагается на внутренней поверхности плазматической мембраны и активируется разными пептидными гормонами (рис. 4—10). Названный первоначально Sutherland аденилциклазой фермент плазматической мембраны впоследствии стали называть аденилатциклазой или аденилилциклазой. Эти термины точнее описывают его специфическое циклизирующее действие на АТФ. Фермент, ответственный за образование цАМФ, следует называть наиболее широко употребительным термином «аденилатциклаза». Вслед за идентификацией аденилатциклазы в качестве фермента, связанного с мембраной, и определением его регуляции со стороны катехоламинов и пептидных гормонов появилось огромное число сообщений об участии (или неучастии) цАМФ в гормон-зависимых процессах. Вскоре выяснилось, что способностью активировать аденилатциклазу обладают только пептиды и трансмиттеры, которые связываются с поверхностью клетки, тогда как другие гормоны, (тироксин и стероиды) не оказывают закономерного действия на систему аденилатциклаза — цАМФ. Sutherland рассматривал циклазу как фермент, обладающий рецепторной субъединицей (местом распознавания пептидных гормонов) и каталитической субъединицей (превращающей АТФ в цАМФ). Позднее предполагалось, что эти субъединицы существуют в виде отдельных структур, плавающих в липидном бислое клеточной мембраны и объединяющихся в активную форму при взаимодействии гормона с рецепторным местом [10]. Это представление легло в основу двухэтапной теории активации фермента, согласно которой гормонрецепторный комплекс диффундирует по клеточной мембране и взаимодействует с каталитической единицей (активируя ее), расположенной на цитоплазматической поверхности мембраны (см. рис. 4—3).
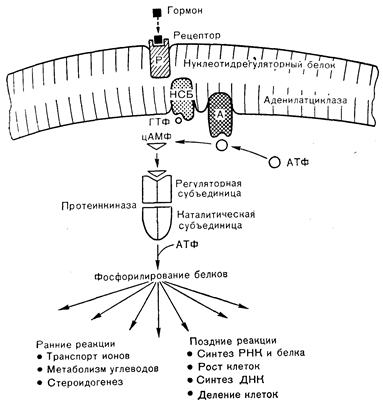
Рис. 4—10. Активация ранних и поздних реакций в эндокринной клетке-мишени гормонами, стимулирующими аденилатциклазный-протеинкиназный путь. НСБ — нуклеотидсвязывающий белок; Р — рецептор.
Эта относительно простая модель аденилатциклазы впоследствии усложнилась, благодаря выяснению роли промежуточного процесса (трансдукции) между гормонрецепторным взаимодействием и изменением конформации каталитической субъединицы, приводящим к активации фермента. Существование и свойства этого промежуточного (сопрягающего) этапа были продемонстрированы группой Rodbell в процессе изучения глюкагончувствительной аденилатциклазы, присутствующей в плазматических мембранах клеток крысиной печени [31]. На этой системе было показано, что гуаниловые нуклеотиды (особенно ГТФ) усиливают активирующее действие гормона на аденилатциклазу, а также способствуют диссоциации комплекса глюкагона с его рецептором. Исследования Rodbell свидетельствовали о том, что глюкагон облегчает активацию аденилатциклазы гуаниловыми нуклеотидами, а не оказывает прямого стимулирующего влияния на фермент. Регуляторный участок аденилатциклазы, взаимодействующий с гуаниловым нуклеотидом, идентифицирован в различных эукариотических тканях, и предполагается, что он играет фундаментальную роль в действии пептидных гормонов, катехоламинов и простагландинов. Последующие эксперименты подтвердили общую зависимость активирующего аденилатциклазу действия пептидных гормонов от гуаниловых нуклеотидов, причем было подчеркнуто значение связывания ГТФ с регуляторным участком как обязательного этапа гормонального действия [12]. Современная точка зрения на механизм гормональной активации аденилатциклазы в качестве первичного этапа действия пептидного гормона предполагает зависимое от лиганда присоединение ГТФ к регуляторному участку (см. рис. 4—4). Связывание ГТФ с этим промежуточным регуляторным белком превращает неактивную каталитическую единицу в ее активную циклизирующую форму; процесс активации прекращается при гидролизе связанного ГТФ с образованием ГДФ, и фермент восстанавливает свое исходное состояние. В пользу существования такого механизма свидетельствуют данные о том, что стимулируемая гормоном активность ГТФазы связана с гуапилнуклеотид-регуляторным участком, а также о способности негидролизуемых аналогов ГТФ (Gpp (NH) p и ГТФgS) вызывать выраженную и длительную активацию аденилатциклазы. Последний эффект обусловливается резистентностью синтетических аналогов к гидролитическому действию ГТФазы, что является причиной персистирующей занятости регуляторного участка активным нуклеотидом вместо обычно транзиторного эффекта связывания ГТФ [32]. Этот механизм лежит и в основе выраженного действия холерного токсина на активность аденилатциклазы с «фиксированием» фермента в постоянно активном состоянии. Указанный феномен зависит от присутствия ГТФ и обусловливается ингибированием токсинов гормонзависимой ГТФазной активности [33]. Этот эффект холерного токсина реализуется через стимуляцию переноса АДФ-рибозы (от НАД) на ассоциированный с аденилатциклазой ГТФ-связывающий белок [34], что приводит к угнетению активности ГТФазы. Все эти данные позволяют считать, что активность аденилатциклазы «включается» возникающим под действием гормона связыванием ГТФ в присутствии АТФ как субстрата и «выключается» путем гидролиза ГТФ в регуляторном участке [33] (рис. 4— 11). «Выключение» реакции блокируется нефизиологическими агентами, такими, как Gpp (NH) p и холерный токсин, а также может служить способом регуляции активности аденилатциклазы другими внутриклеточными сигналами. Дальнейшие указания на значение регуляторного участка были получены при попытках реконструкции гормончувствительной активности аденилатциклазы путем слияния клеток или добавления растворимых клеточных экстрактов к комплементарным мембранам. В опытах по слиянию клеток гетерокарионы, образуемые из характерных для эритролейкемии клеток крови (лишенных b-рецепторов) и эритроцитов индюшки (с инактивированной аденилатциклазой), обнаруживали катехоламинчувствительную циклазную активность, отсутствовавшую в донорских клетках [35]. Подобно этому, рецепторы ЛГ, содержащиеся в богатых липидами экстрактах яичников, были перенесены в клетки сетчатой зоны коры надпочечников, в которой они опосредовали действие гонадотропинов на продукцию цАМФ и кортикостероидов [6]. В экспериментах по реконструкции солюбилизированная детергентом аденилатциклаза включалась в состав содержащих рецепторы мембран мутантных клеток, дефицитных по аденилатциклазе, с восстановлением стимулируемой катехоламинами активности фермента [36]. Подобно упомянутым результатам исследований со слиянием клеток эти данные подчеркивают пространственную независимость гормональных рецепторов и аденилатциклазы и свидетельствуют о способности рецепторов к движению в латеральном направлении и взаимодействию с нуклеотидрегуляторной единицей аденилатциклазы в клеточной мембране. Такие данные свидетельствуют о том, что между гормональными рецепторами и компонентами аденилатциклазной системы существует общий сопрягающий механизм, проявляющийся при взаимодействии гетеротопных рецепторов и аденилатциклазы клетки-хозяина. Это могло бы указывать на существование области конформационного сходства у всех рецепторов пептидных гормонов при сохранении уникальности их областей, ответственных за специфическое связывание гормонов [36]. Выяснению вопроса о том, действительно ли рецепторы пептидных гормонов обладают общим доменом, определяющим возможность взаимодействия с регуляторными компонентами эффекторных мембранных ферментов, должен был бы способствовать более подробный структурный анализ этих рецепторов.
Рис. 4—11. Роль циклических нуклеотидов в гормональной регуляции аденилатциклазы. Гормонрецепторное взаимодействие приводит к связыванию ГТФ регуляторным участком и активации аденилатциклазы. Гидролиз ГТФ до ГДФ, локализованной в этом участке ГТФфазой, восстанавливает неактивную форму фермента. Токсин холерного вибриона (ТХВ) необратимо инактивирует фермент, блокируй активность ГТФазы. Связывание регуляторным участком негидролизуемых аналогов ГТФ, таких, как Gpp (NH) P, также вызывает длительную активацию фермента (Cassel и соавт. [33] в модификации). Фн — фосфор неорганический.
Результаты опытов по реконструкции, проведенные на мутантных клетках, обладающих b-адренергическими рецепторами и аденилатциклазой, которая, хотя и присутствовала, но была «разобщена» (т. е. не реагировала на катехоламины), показали восстановление стимулируемой катехоламинами активности при добавлении экстрактов клеток дикого типа. Это свидетельствует о том, что сопрягающий фактор (возможно, нормальная нуклеотидрегуляторная единица), включающийся в мембрану мутантной клетки, замещает предположительно дефектный у таких мутантов регуляторный участок [36]. Помимо участия в активации аденилатциклазы, гуаниловые нуклеотиды часто влияют и на кинетику связывания и сродство гормонрецепторного взаимодействия. Анализ солюбилизированных мембранных систем и раздельных эффектов гуаниловых нуклеотидов на связывание гормона и активацию циклазы указывает на структурную и функциональную обособленность участков, влияющих на конформацию рецептора и ферментативную активность [32]. Разделенность «рецепторной» и «каталитической» единицы регуляторного белка надежно доказывается результатами этих и более ранних исследований, но вопрос о механизме взаимодействия компонентов реакции остается нерешенным. Важным аспектом влияния ГТФ на сродство рецепторов к лиганду является способность нуклеотида снижать «прочность» связывания гормона почти с необратимой ассоциации до состояния (в некоторых случаях) с гораздо меньшим сродством. Это наблюдалось в отношении рецепторов глюкагона, а также в отношении связывания лигандов-агонистов с b-адренергическими рецепторами. В отличие от этого, гуаниловые нуклеотиды не изменяли связывание b-антагонистов, что указывает на роль сопряжения с аденилатциклазой в способности нуклеотидов повышать диссоциацию связанного с рецептором агониста [20]. Хотя данные, полученные при исследовании глюкагоновой системы, свидетельствуют в пользу существования обособленных мест действия нуклеотидов на регуляцию рецепторного связывания и активность аденилатциклазы, однако роль этих мест в гормональной активации и рецепторферментном сопряжении все еще остается не выясненной. Состояние низкого сродства рецептора, вызываемое ГТФ, рассматривается как благоприятное предшествующее состояние процесса трансмембранного сопряжения, а разобщенная форма рецептора, обладающая высоким сродством, могла бы отражать неактивное состояние фермента. Последнее могло бы иметь отношение к «десенситизации» аденилатциклазы повышенными концентрациями гормона [20].
Дата добавления: 2015-02-05 | Просмотры: 1448 | Нарушение авторских прав |