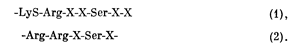|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
Роль фосфорилирования в эффектах цАМФ: протеинкиназы
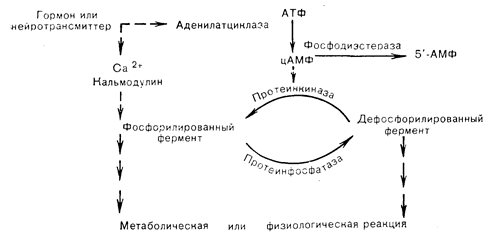
Вслед за открытием цАМФ и анализом его роли в опосредовании эффектов глюкагона и адреналина на гликолиз было выяснено, что циклический нуклеотид принимает участие в регуляции разнообразных метаболических функций. Свидетельством тому служит глобальное присутствие цАМФ у прокариот и эукариот и его участие в реакциях, связанных не только с действием гормонов [4]. Было установлено, что способность цАМФ активировать фосфорилазкиназу в печеночных клетках является общим свойством эукариотических клеток, в которых все эффекты цАМФ реализуются через фосфорилирование белковых субстратов. Подобно цАМФ в эукариотических клетках присутствует фермент, называемый цАМФ-зависимой протеинкиназой, который опосредует эффекты цАМФ на клеточный метаболизм [37]. У прокариот эффекты цАМФ реализуются через другой механизм — взаимодействие цАМФ-связывающих белков с регуляторными участками генома. В животных тканях цАМФ-зависимая протеинкиназа катализирует фосфорилирование многих белковых субстратов, перенося фосфат с АТФ на специфические сериновые (и иногда треониновые) остатки. По данному месту фосфорилируется ряд известных белковых субстратов, в том числе ферменты, такие, как фосфорилазкиназа, гликогенсинтетаза и гормончувствительная липаза, и неферментные клеточные белки, такие, как гистоны, ядерные негистоновые, рибосомные белки, белки микротрубочек и мембран [38]. Большинство субстратов, обладающих ферментативной активностью, существует либо в фосфо-, либо в дефосфоформах, взаимопревращение которых из активного в неактивное состояние происходит в результате согласованного действия протеинфосфокиназы и фосфопротеинфосфатазы. Протеинфосфокиназы, в том числе цАМФ-зависимая протеинкиназа, переносят g-фосфатную группу с АТФ на белковые субстраты, тогда как фосфопротеинфосфатазы катализируют гидролиз фосфопротеинов, отщепляя от них фосфатные группы. Этот цикл фосфорилирование—дефосфорилирование считается в настоящее время повсеместно распространенным механизмом регуляции метаболизма, причем применительно не только к ферментам, но и к сократительным реакциям, мембранным активностям и ядерным процессам. На функциональном уровне такие эффекты проявляются физиологическими процессами мышечного сокращения, секреции и деятельности нейронов. Открытие Greengard того факта, что все животные клетки содержат цАМФ-зависимую протеинкиназу, привело к созданию концепции, согласно которой разнообразные эффекты цАМФ реализуются через этот единственный класс ферментов [39]. С этой точки зрения, специфичность опосредуемых цАМФ реакций определяется характером протеинкиназы и особенно характером белковых субстратов, присутствующих в клетках данного типа. Считается, что каждый белковый субстрат контролирует специфический метаболический или физиологический процесс, скорость которого увеличивается или уменьшается при фосфорилировании регуляторного белка. Способ, с помощью которого фосфорилирование белка опосредует биологические эффекты гормонов и трансмиттеров, действующих через цАМФ, представлен на рис. 4—12. Следовало бы полагать, что для катализа фосфорилирования отдельных белковых субстратов при опосредовании многочисленных эффектов цАМФ должно существовать множество протеинкиназ. Однако в животных клетках идентифицировано лишь небольшое число основных форм этого фермента; поэтому специфичность каждой реакции фосфорилирования должна определяться локализацией и характером белкового субстрата. Протеинкиназы широко различаются по своей зависимости или независимости от циклических нуклеотидов (табл. 4—2).
Рис. 4—12. Общая схема действия пептидного гормона через аденилатциклазный и протеинкиназный метаболический путь, предполагающая контроль регуляторных белков с помощью фосфорилирования и дефосфорилирования (Greengard [37] в модификации).
Таблица 4—2. Классификация протеинкиназ
1. Ферменты, зависимые и не зависимые от циклических нуклеотидов 2. цАМФ- и цГМФ-зависимые ферменты 3. цАМФ-зависимые ферменты I и II типов
Протеинкиназы, не зависимые от циклических нуклеотидов, присутствуют во всех областях клетки и регулируются, по-видимому, другими внутриклеточными сигналами. Недавно обнаруженный класс протеинкиназ для своей активности требует присутствия липидных компонентов мембраны и кальция; ферменты этого класса могут быть частью трансмембранных контролирующих систем, регулируемых кальцием. Большинство контролируемых гормонами протеинкиназ клеток-мишеней зависит от цАМФ или (реже) от цГМФ. Такие зависимые от циклических нуклеотидов протеинкиназы сосредоточены в цитозоле, по встречаются также в плазматических мембранах и в других клеточных органеллах. Они активируются микромолярными концентрациями циклических пуриновых нуклеотидов (цАМФ и цГМФ) и быстро стимулируются при повышении продукции циклических нуклеотидов в результате действия гормона на клеточную мембрану. Оба типа зависимых от циклических нуклеотидов протеинкиназ активируются при связывании нуклеотида специальным участком фермента. цАМФ-зависимая протеинкиназа в неактивной форме представляет собой тетрамер, состоящий из субъединиц двух типов: для связывания цАМФ и для катализа переноса фосфата. Неактивный тетрамер состоит из двух связывающих, или регуляторных (Р), субъединиц и двух ферментных, или каталитических (К), субъединиц. При связывании цАМФ с Р2-субъединицами тетрамер Р2К2 диссоциирует, высвобождая активные каталитические субъединицы, обладающие фосфотрансферазной активностью [38]. Эту реакцию можно представить следующим образом:
Р2К2 (неактивная) + 4цАМФ «Р2•цАМФ4 + 2К (активная).
После своего образования свободная К-субъединица обнаруживает функциональное сходство с цАМФ-независимыми протеинкиназами, но ее можно отличить по характерному размеру (молекулярная масса 38000) и реакции на термостабильный ингибиторный белок, который блокирует ее каталитическую активность и предотвращает рекомбинацию с регуляторной субъединицей. Каталитические субъединицы, по всей вероятности, едины во всех формах цАМФ-зависимых протеинкиназ, тогда как регуляторные субъединицы обнаруживают индивидуальные особенности. Считается, что регуляторные субъединицы, высвобождающиеся при диссоциации протеинкиназы, остаются в виде Р2-димера и позднее подвергаются повторной ассоциации со свободными каталитическими субъединицами, в результате чего восстанавливается неактивный голофермент. В отсутствии цАМФ регуляторные и каталитические субъединицы связаны друг с другом с высоким сродством и в физиологических условиях присутствуют преимущественно в виде неактивного голофермента [40]. цГМФ-зависимые протеинкиназы вначале были обнаружены у беспозвоночных, но позднее их нашли и в тканях млекопитающих, где они функционируют иным образом, чем цАМФ-зависимый фермент. Их сродство к цАМФ гораздо ниже, чем к цГМФ, а ферментативная активность обычно также уступает таковой цАМФ-зависимого фермента. Активация осуществляется путем связывания цГМФ регуляторным участком фермента, причем считают, что подобно цАМФ-зависимой протеинкиназе этот фермент также диссоциирует с высвобождением активной каталитической единицы. Недавно была установлена гомология между двумя формами зависимых от циклических нуклеотидов ферментов, что привело к мысли об их общем эволюционном происхождении из примитивной фосфотрансферазы [41]. Растворимые формы цАМФ-зависимой протеинкиназы из тканей млекопитающих с помощью ионообменной хроматографии удается разделить на два главных типа (табл. 4—3). Протеинкиназа I типа имеет менее кислый оптимум, быстро диссоциирует под влиянием субстрата (гистонов) или высокой концентрации соли (0,5 М NaCl) и медленно реассоциирует после вызванной цАМФ диссоциации. Фермент II типа имеет более кислый оптимум и медленнее диссоциирует под действием гистонов и соли, но быстро реассоциирует, образуя неактивный олигомер. В большинстве тканей присутствуют обе формы протеинкиназ, но их соотношение в клетках разного типа варьирует. Так, в скелетной мышце кролика преобладает фермент I типа, а в сердечной мышце крупного рогатого скота—фермент II типа. Оба голофермента обычно сходны по составу и молекулярной массе субъдиниц: каждая связывает по две молекулы цАМФ, а их каталитические субъединицы, по всей вероятности, идентичны. Различия касаются молекулярной массы и функции регуляторных субъединиц, причем главное различие заключается в том, что фермент I типа связывает Mg-АТФ, тогда как фермент II типа катализирует фосфорилирование своей собственной регуляторной субъединицы за счет АТФ. Связывание АТФ ферментом I типа снижает его сродство к цАМФ и, по-видимому, способствует сохранению неактивного состояния фермента. Субъединица I типа, хотя и связывает АТФ, не фосфорилируется каким бы то ни было ферментом, что отличается от «аутофосфорилирования», свойственного ферменту II типа [42].
Таблица 4—3. Свойства цАМФ-зависимой протеинкиназы
Функциональное значение этих двух эффектов на Р-субъединицы не ясно, хотя фосфорилирование ферментов II типа могло бы представлять собой эволюционно более позднюю форму связывания субстрата (АТФ), характерного и для фермента I типа. Фосфорилирование протеинкиназы II типа сопровождается снижением скорости воссоединения диссоциированных Р- и К-субъединиц. Таким образом, фосфорилирование могло бы служить фактором контроля за активностью диссоциированного фермента и регулировать скорость восстановления его неактивной формы. Ускорение дефосфорилирования Р-субъединицы должно было бы способствовать рекомбинации голофермента Р2К2, приводящей к высвобождению и разрушению цАМФ. Таким способом могла бы осуществляться регуляция соотношения активного и неактивного ферментов в отсутствие изменений концентрации цАМФ. Другая возможность заключается в том, что ферменты II типа, участвующие в быстрых циклах метаболических процессов, что наблюдается в сердечной и нервной тканях, приобрели способность более тонко регулироваться (инактивироваться) эффектами этапа фосфорилирования: дефосфорилирование на регуляторную субъединицу по механизму ультракороткой обратной связи. После установления роли цАМФ-зависимой протеинкиназы в фосфорилировании и активации фосфорилазы киназы было показано, что этот фермент фосфорилирует основные белки, в том числе гистоны, казеин и протамин, как и многие денатурированные белки (такие, как протеин яичного белка, лизоцим и бычий сывороточный альбумин), в своем нативном состоянии не являющиеся субстратами фосфорилирования. Небольшие основные пептиды также фосфорилируются этим ферментом, как и синтетические пептидные последовательности, сходные с участками фосфорилирования нативных и денатурированных белковых субстратов. Эти данные указывают на то, что реакция фосфорилирования, осуществляемая протеинкиназой, является не слишком специфичной в отношении аминокислотных последовательностей отдельных белков, но обладает сравнительно высокой специфичностью по отношению к остаткам серина, локализованным в определенных участках первичной аминокислотной последовательности многих белков. При анализе структур, необходимых для фосфорилирования, обнаружили, что пептидные субстраты протеинкиназы обладают двумя близко расположенными основными аминокислотами, одной из которых является аргинин, локализующийся через 2—5 остатков от фосфорилируемого серинового остатка на аминоконцевой стороне пептида [43]. В физиологически важных белковых субстратах цАМФ-зависимой протеинкиназы были определены две формы аминокислотной последовательности на участке фосфорилирования
В этих последовательностях на месте Х может стоять любая аминокислота, хотя остатки, располагающиеся в непосредственной близости к серину, обычно имеют гидрофобные боковые цепи. Участок фосфорилирования I типа, где основные аминокислоты отделены от серина двумя остатками, присутствует в b-субъединице фосфорилазы киназы и в гликогенситетазе. Участок II типа ним промежуточным остатком) присутствует в пируваткиназе и регуляторной субъединице цАМФ-зависимой протеинкиназы II типа. Поскольку скорость фосфорилирования главным образом зависит от сравнительно часто встречающейся первичной последовательности на определенном участке пептидной цепи, специфичность отдельных белков как субстратов фосфорилирования должна определяться их вторичной и третичной (т. е. трехмерной) конформацией, которая может ограничивать присутствие потенциально фосфорилируемых участков для каталитической единицы фермента. Предполагаемая роль вторичной структуры в определении субстратной специфичности сводится к положению фосфорилируемого серина на гидрофильной поверхности белкового субстрата, в сформированных водородными связями складках b-структуры, которая может быть «узнана» протеинкиназой [44].
Дата добавления: 2015-02-05 | Просмотры: 1282 | Нарушение авторских прав |