|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
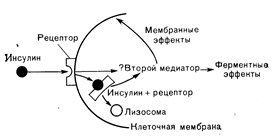
Рецепторы инсулина и механизм его действияПервым этапом действия инсулина, как и других полипептидных гормонов, является его связывание со специфическими репепторами на плазматической мембране клетки (рис. 10—19). Инсу Рис. 10—19. Взаимодействие инсулина с рецептором. Первым этапом действия инсулина на клетку является его связывание рецептором на клеточной мембране. Это взаимодействие «запускает» один или более пока не идентифицированных внутриклеточных процессов (вторые медиаторы?), обусловливающих мембранные (увеличение транспорта глюкозы в адипоциты и мышечные клетки) и ферментные (повышение активности гликогенсинтетазы в печени) эффекты. Инсулинрецепторный комплекс проникает в клетку. где подвергается лизосомному разрушению. Необходимо ли проникновение инсулинрецепторного комплекса в клетку для «запуска» внутриклеточных эффектов инсулина (мембранных и ферментных) неизвестно. линовый рецептор можно определить как компонент клеточной мембраны, который избирательно распознает и связывает инсулин и обладает характеристиками связывания (кинетика, оптимум рН, специфичность по отношению к аналогам), удовлетворяющими требованиям к возможности генерировать сигнал, обусловливающий биологическую реакцию [67]. Хотя химическая структура инсулинового рецептора точно не известна, считают, что он представляет собой гликопротеин с молекулярной массой от 75 000 до 300 000. Физиологической сущностью инсулинового рецептора является специфичность, с которой он связывает гормон, и тесная зависимость действия гормона от этого связывания. При изучении 40 аналогов инсулина была показана прямая зависимость между сродством аналога к инсулиновым рецепторам и его биологической активностью (рис. 10—20). Хотя показано, что число инсулиновых рецепторов на клетку колеблется от 50 000 (в адипоцитах) до 250000 (в гепатоцитах), максимальные биологические эффекты наблюдаются при занятости небольшого количества их (менее 10%). Функциональный смысл существования такого «запаса рецепторов» заключается в том, что в условиях снижения числа рецепторов (например, при ожирении) при адекватном увеличении концентрации инсулина число гормонрецепторных комплексов может достигать критического уровня,.необходимого для «запуска» биологической реакции (т. е. кривая доза — реакция для инсулина окажется сдвинутой вправо).
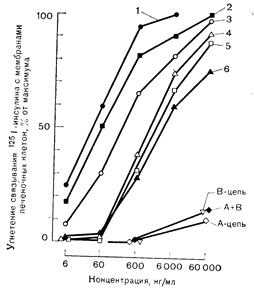
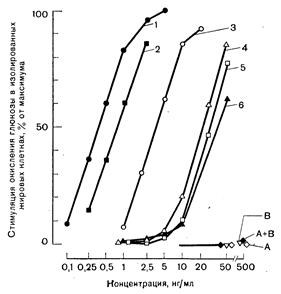
Рис. 10—20. Влияние инсулина и его аналогов на связывание 125I-инсулина с мембранами печеночных клеток (а); и окисление глюкозы жировыми клетками (б). Можно видеть близкую корреляцию между сродством к рецепторам (а) и биологическим эффектом (б) (по Freychet P.. et al. Ргос. Natl. Acad. Sci. USA, 1971, 68, 1833). а: 1 — инсулины свиньи, быка и-человека; 2 — рыбий инсулин: 3— проинсулин: 4 — дезоктапептид; 5 — дезала. дезаен; 6 — инсулин морской свинки,.
Взаимодействие между инсулином и его рецептором — это не простая обратимая реакция между двумя молекулами с одной константой сродства или равновесия, а процесс, имеющий более сложную природу и характеризующийся гетерогенностью сродства связывания. Указанная сложность проявляется криволинейной зависимостью, получаемой при скетчардовском анализе данных по связыванию инсулина [68]. Эти данные рассматриваются как указание на отрицательную кооперативность — феномен, при котором увеличение занятости рецепторов приводит к снижению сродства вследствие взаимодействий связывающих мест между собой [67, 68]. Можно, однако, дать и другое или дополнительное объяснение, особенно применительно к адипоцитам, которое сводится к признанию существования двух разных классов рецепторов: с высоким сродством и низкой емкостью и с низким срод-
Рис. 10—20. Влияние инсулина и его аналогов на связывание 125I-инсулина с мембранами печеночных клеток (а) и окисление глюкозы жировыми клетками (б). Можно видеть близкую корреляцию между сродством к рецепторам (а) и биологическим эффектом (б) (по Freychet P. et al. Ргос. Natl. Acad. Sci. USA, 1971, 68, 1833). б: 1 — свиной инсулин; остальные обозначения см. рис. 10—20, а.
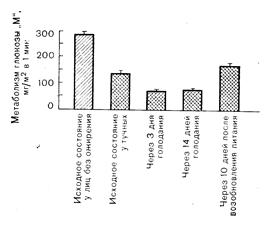
Рис. 10—21. Действие инсулина у лиц с нормальной массой тела (косо заштрихованный столбик) и у тучных людей после ночного голодания и на 3-й и 10-й день голодания. О действии инсулина судили по-скорости метаболизма глюкозы «М» в условиях физиологической гиперинсулинемии, создаваемой с помощью специальной методики введения инсулина. В исходном состоянии ослабление действия инсулина при ожирении наблюдалось на фоне снижения связывания инсулина; это указывает на то, что ограничивающим скорость инсулинового эффекта является рецепторный уровень. Напротив, после голодания эффект инсулина снижался еще больше, несмотря на, повышение его связывания, что указывает на ограничивающую скорость роль пострецепторных реакций (по данным DeFrouzo R. et al., J. Clin. Invest,. 1978, 62, 204). ством и высокой емкостью [69]. Еще одно свойство инсулиновых рецепторов — их регуляция окружающей концентрацией инсулина. В условиях гиперинсулинемии (например, при ожирении) число инсулиновых рецепторов уменьшается («снижающая регуляция»), тогда как при гипоинсулинемии (например, при голодании) оно увеличивается [67, 68]. На биологическое значение инсулиновых рецепторов в качестве регуляторного фактора указывают различные состояния, при которых изменения чувствительности к инсулину сопровождаются изменением их числа и/или сродства. Изучение инсулиновых рецепторов у человека получило особый стимул после обнаружения; того факта, что связывание инсулина с циркулирующими моноцитами отражает его связывание с тканями-мишенями (печень,. мышцы и жировая ткань) и во многих случаях тесно коррелирует с биологическим действием инсулина in vivo (рис. 10—21). Изменениями инсулиновых рецепторов пытались объяснить патогенез инсулинорезистентных состояний, а также состояний,. характеризующихся повышением чувствительности к инсулину (табл. 10—5) [70]. Инсулинорезистентность диагностируют обычно на основании снижения реактивности либо к эндогенному инсулину (гиперинсулинемия на фоне нормального или повышенного уровня глюкозы), либо к экзогенному инсулину (больные диабетом, нуждающиеся в получении массивных доз гормона). Наиболее распространенным инсулинорезистентным состоянием является ожирение при котором наблюдается снижение связывания инсулина с моноцитами, адипоцитами и мышечными клетками. Изменение функции рецепторов наблюдали также у больных диабетом с гиперинсулинемией, отсутствием ожирения и началом болезни в зрелом возрасте (II тип диабета), у некоторых больных липоатрофическим диабетом и у больных с синдромом acanthosis nigricans и резкой инсулинорезистентностью. При последнем синдроме встречается либо снижение числа рецепторов, либо присутствие антирецепторных антител в крови, препятствующих связыванию инсулина [70]. Наоборот, у тренированных спортсменов, при нервной анорексии [71] и дефиците гормона роста или глюкокортикоидов повышение чувствительности к инсулину сопровождается увеличением его связывания. Однако снижение связывания инсулина может быть не единственным или даже не самым главным механизмом инсулинорезистентности данной клетки-мишени. Например, при различных формах ожирения у экспериментальных животных можно обнаружить дефект внутриклеточного окисления глюкозы при максимальных концентрациях инсулина, что невозможно отнести за счет снижения связывания гормона [72]. Кроме того, при голодании связывание инсулина с моноцитами и адипоцитами увеличивается, тогда как внутриклеточная утилизация глюкозы уменьшается [73]. Эти данные свидетельствуют о том, что инсулинорезистентность может быть обусловлена различными механизмами, связанными с нарушениями на рецепторном и/или пострецепторном внутриклеточном уровне. Таблица 10—5. Корреляция между связыванием и действием инсулина 1. Инсулинорезистентность — снижение связывания инсулина Ожирение Диабет взрослых Тяжелая инсулинорезистентность и acanthosis nigricans Избыток гормона роста Избыток глюкокортикоидов Липоатрофический диабет 2. Гиперчувствительность к инсулину — повышение связывания инсулина Тренированные спортсмены Нервная анорексия Дефицит глюкокортикоидов
Главный нерешенный вопрос в отношении механизма действия инсулина заключается в идентификации внутриклеточных процессов, «запускаемых» инсулинрецепторным взаимодействием и приводящих к биологическому эффекту (изменение транспортной и ферментативной активности) (см. рис. 10—19). Электронно-микроскопические исследования позволили получить прямое доказательство того. что после связывания инсулина со своим рецептором гормонрецепторный комплекс проникает в клетку и подвергается затем разрушению лизосомами [74]. Однако не выяснено, является ли такая интернализация инсулина необходимой для его непосредственного воздействия на функцию мембраны (например, транспорт глюкозы и аминокислот) и активность ферментов (например, гликогенсинтетазы). Альтернативная гипотеза предполагает существование «второго медиатора» (аналогичного» цАМФ, опосредующего действие глюкагона), активация которого «запускается» образованием гормонрецепторного комплекса (см, рис. 10—19). Однако природа этого «второго медиатора» остается; неясной. Хотя первые исследования показали, что инсулин может противодействовать повышению цАМФ, вызываемому глюкагоном и адреналином, в других опытах четкий биологический эффект инсулина (например, стимуляция гликогенсинтетазы) наблюдали в отсутствие изменений уровня цАМФ [62]. В качестве альтернативного механизма действия инсулина предполагалось увеличение уровня циклического гуанозин-3-монофосфата (цГМФ); однако другие авторы показали отсутствие связи между повышением содержания цГМФ и стимуляцией инсулинчувствительных внутриклеточных процессов (липолиз, гликогенолиз). Инсулин мог бы влиять на активность ферментов и мембранный транспорт не путем изменения уровня циклических нуклеотидов, а непосредственно изменяя активность различных протеинкиназ и/или фосфатаз, расположенных внутри клетки и на плазматической мембране. Инсулин стимулирует фосфорилирование крупного пептида с молекулярной массой 123 000 в жировой ткани и с молекулярной массой 46 000 в печени независимо от изменения уровня цАМФ [75]. С другой стороны, инсулин генерирует химический медиатор, контролирующий процессы фосфорилирования» а также дефосфорилирования [76, 77]. Дата добавления: 2015-02-05 | Просмотры: 1088 | Нарушение авторских прав |