|
|
АкушерствоАнатомияАнестезиологияВакцинопрофилактикаВалеологияВетеринарияГигиенаЗаболеванияИммунологияКардиологияНеврологияНефрологияОнкологияОториноларингологияОфтальмологияПаразитологияПедиатрияПервая помощьПсихиатрияПульмонологияРеанимацияРевматологияСтоматологияТерапияТоксикологияТравматологияУрологияФармакологияФармацевтикаФизиотерапияФтизиатрияХирургияЭндокринологияЭпидемиология |
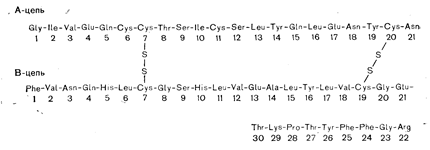
ИНСУЛИНИСТОРИЧЕСКИЙ ОЧЕРК В 1899 г. фон Меринг и Минковский показали, что удаление поджелудочной железы у собак приводит к развитию тяжелых нарушений обмена глюкозы с повышением ее концентрации в крови и клинической картиной сахарного диабета. Предположение о том, что этот эффект является следствием выпадения действия необходимого гормона, было подтверждено в 1921 г., когда Бантинг и Бест приготовили экстракт поджелудочной железы, способный снижать уровень сахара в крови. Это вещество, названное инсулином,.было получено в кристаллическом виде Абелем в 1926 г. Sanger определил аминокислотный состав инсулина — первого белка, последовательность которого была полностью расшифрована. В 1965 г. Katsoyannis сумел осуществить химический синтез инсулина. В 1969 г. с помощью методик рентгенодифракции была определена трехмерная структура инсулина. Steiner в 1967 г. обнаружил проинсулин — биологический предшественник инсулина более крупного размера. Позднее с помощью методик рекомбинаций ДНК удалось добиться синтеза инсулина бактериями. ХИМИЯ Молекула инсулина состоит из двух полипептидных цепей, обозначаемых как А- и В-цепи, соединенные двумя дисульфидными мостиками. Кроме того, имеется дисульфидный мостик между 6-м и 11-м аминокислотным остатком А-цепи (рис. 10—10). Полная молекула содержит 51 аминокислоту и обладает относительной молекулярной массой 5800 и изоэлектрической точкой 5,35; 1мг чистого вещества содержит 24 ME. Аминокислотный состав инсулина у разных видов постоянен, за исключением остатков в положениях 4, 8, 9 и 10 А-цепи и 1, 2, 3, 27, 29 и 30 В-цепи. Чаще всего применяемыми в клинических целях инсулинами являются гормоны, экстрагируемые из поджелудочных желез свиней и крупного рогатого скота. Свиной инсулин отличается от гормона человека только присутствием аланина вместо треонина в терминальном положении В-цепи, тогда как между бычьим и человеческим инсулином существуют еще два различия [в 8-м (аланин) и 10-м (валин) положениях А-цепи] (см. рис. 10—10). Согласно результатам рентгенокристаллографических исследова-
Рис. 10—10, Аминокислотная последовательность инсулина человека. Свиной инсулин в качестве терминальной аминокислоты В-цепи содержит не треонин, а аланин. Бычий инсулин отличается от инсулина человека тем, что содержит аланин в положении 30 В-цепи, а также аланин (вместо треонина) в положении 8 и валин (вместо изолейцина) в положении 10 А-цепи. яий, единичная ячейка кристаллического свиного инсулина состоит из инсулинового гексамера, построенного из трех димеров, расположенных вокруг оси, на которой лежат два атома цинка. Содержание цинка в большинстве кристаллических препаратов инсулина составляет примерно 0,4—0,5%. В слабых растворах инсулин адсорбируется на стекле или пластмассе (например, на стенках системы для внутривенных инфузий). Эту адсорбцию удается свести к минимуму путем добавления альбумина. Расщепление инсулина на составляющие его А- и В-цепи путем окисления или восстановления дисульфидных мостиков приводит к полной потере им биологической активности. С другой стороны, удаление амидной группы аспарагина на карбоксильном конце А-цепи или терминального аланина В-цепи практически не влияет на активность молекулы инсулина. При удалении всего аспарагина (или аспартата) из карбоксильного конца А-цепи и аланина из соответствующего участка В-цепи теряется примерно 95% активности гормона. Удаление последовательности из 8 аминокислот (с 23-го по 30-й остаток) с карбоксильного конца В-цепи (инсулин-дезоктапептид) с помощью трипсинового гидролиза приводит к исчезновению всей определимой активности. Считается, что участок между 22-м и 26-м остатком В-цепи имеет решающее значение для связывания инсулина с его рецептором, как и для действия инсулина вообще [27]. Дата добавления: 2015-02-05 | Просмотры: 1001 | Нарушение авторских прав |